Marfan症候群とは細胞外基質の構成タンパク質であるfiblilin-1をコードするFBN1遺伝子変異が原因となり水晶体亜脱臼,大動脈拡張,大動脈弁閉鎖不全,僧帽弁逸脱症などの心大血管病変,側弯,くも状指などの骨格病変を呈する症候群である.約1万人に1人の頻度で認められ,男女差はない.常染色体優性遺伝で,約75%は両親のいずれかの変異,約25%は新生児突然変異が原因とされている.診断には家族歴,大動脈拡張,水晶体偏位,身体的特徴を指標とした改訂Ghent基準1)が用いられる.
Marfan症候群の大動脈拡張は進行すると大動脈解離を来すため,予防的外科手術が行われる.Guillaumeが報告した後ろ向きコホート研究に基づき2),本邦の成人では大動脈基部径または上行大動脈径が50 mm以上の症例に対して予防的外科手術がクラスIで推奨されている.手術法は大動脈基部置換術(Bentall術)と自己弁温存大動脈基部置換術(valve sparing root replacement: VSRR)に大別され,VSRRとして大動脈基部と人工血管を縫合し交連部の機能を温存するYacoub法,交連部を含め大動脈基部を人工血管に置換し弁輪部を縫縮するDavid法が行われてきた.小児例では,適切な手術法は十分に確立されていない.
心大血管病変の診断,手術適応の決定,術後のフォローアップを適切に行うためには,経胸壁心臓超音波検査(transthoracic echocardiography: TTE)による評価が必須である.しかし,Marfan症候群では側弯などの胸郭異常を来しやすく,描出が不十分なことがある3).今回われわれは,生体弁置換術後短期間で重症大動脈弁狭窄に至り緊急入院となり再手術を要したが,入院前のTTEでは大動脈弁狭窄の進行を診断できなかった1例を経験したので報告する.
症例は15歳,女子.在胎39週1日,体重3,456 g,正常分娩で出生した.顔貌・四肢の異常のため前医に紹介され,心臓超音波検査で大動脈弁輪の拡大を認め,新生児Marfan症候群が疑われた.遺伝子検査でFBN1遺伝子の第27番エクソンのバリアント(P1148A c.3442C>G)を認め確定診断となった.アンジオテンシンII受容体遮断薬とβ遮断薬の内服を開始し,上行大動脈拡張や大動脈弁閉鎖不全(AR)の進行を認めず経過した.
5歳時に転居に伴い当院に紹介され,外来で経過観察を行っていたが,8歳時に海外へ転居した.海外の病院での経過観察中,上行大動脈の拡張と僧帽弁逸脱,三尖弁逸脱による僧帽弁閉鎖不全(MR),三尖弁閉鎖不全(TR)の進行を認めたため,11歳時に19 mm径の生体弁を縫着した24 mm径の人工血管による大動脈基部置換,および僧帽弁形成術,三尖弁形成術を行った.その後は同病院の外来でフォローアップされ,術後2年のTTEでは大動脈弁での血流加速(大動脈弁圧較差30 mmHg)と中等度ARがあり,三尖弁と僧帽弁には異常所見を認めなかった.
13歳時に帰国し,当院で半年ごとの通院を再開した.外来でのTTEでは大動脈弁通過血流速度1.2 m/s,軽度AR,Valsalva洞径23~26 mmで経過していたが,側弯の影響で描出不良であった.心不全症状なく経過していたが,受診1週間前より運動時の息切れを自覚し,その頃から就寝時の臥位で増悪する呼吸苦を認め,当院救急外来を受診した.
入院時現症
身長174.3 cm(+3.2 SD),体重35.9 kg(−1.9 SD),体表面積1.39 m2,心拍数120~140回/分,血圧87/68 mmHg,SpO2 96%(酸素投与2 L/分).心音はII音の亢進と胸骨左縁中部にLevineII度の収縮期雑音を認めた.肺音は呼吸音清,胸骨上と肋骨弓下に陥没呼吸を認めた.肝脾腫は触知しなかった.四肢末梢は暖かく,毛細血管再充満時間は1秒であった.
検査所見
血液検査
脳性ナトリウム利尿ペプチド(BNP)1389 pg/mL,トロポニンT 0.37 ng/mL,CK 339 U/Lと高値であったが,CK-MBは46 U/Lと正常であった.
胸部レントゲン
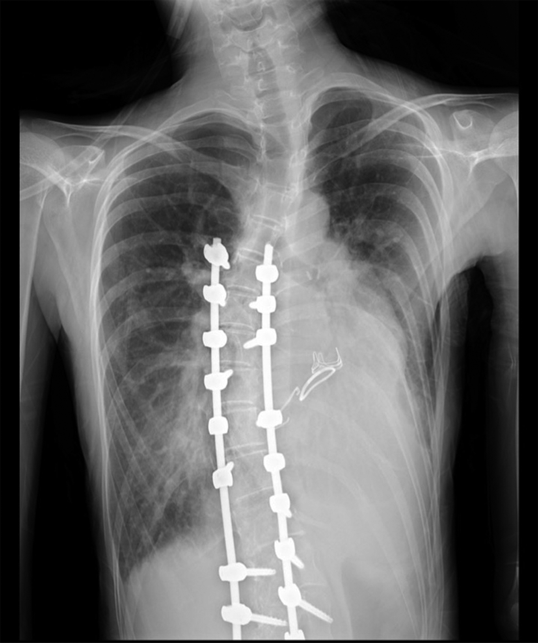
心胸郭比63%,肺血管陰影増強と側弯を認めた(Fig. 1).
心電図
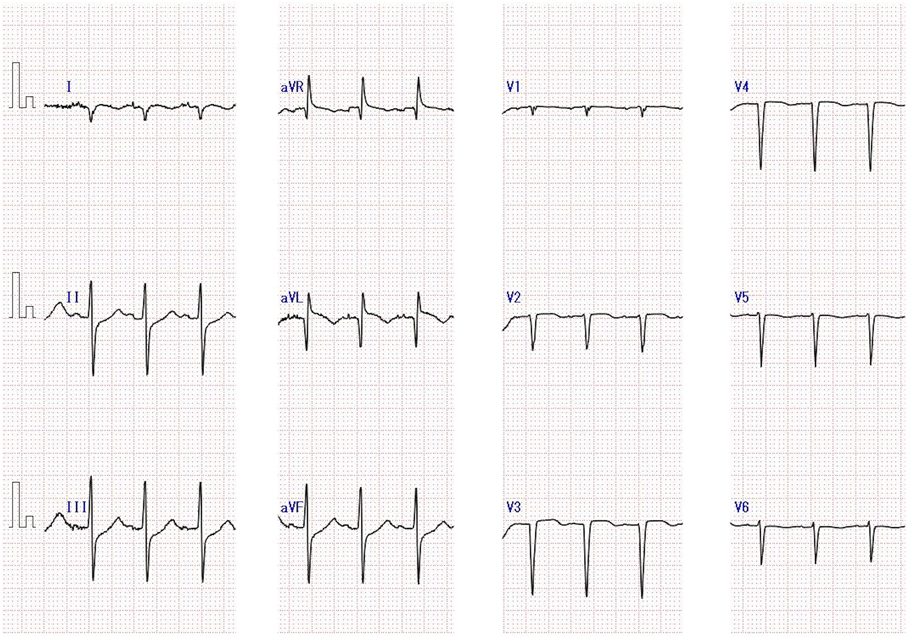
洞調律,心拍数127回/分,軸−120度,時計方向回転,V2~V4誘導でST上昇,V5・V6誘導で陰性T波を認める.左室肥大は認めなかった(Fig. 2).
TTE
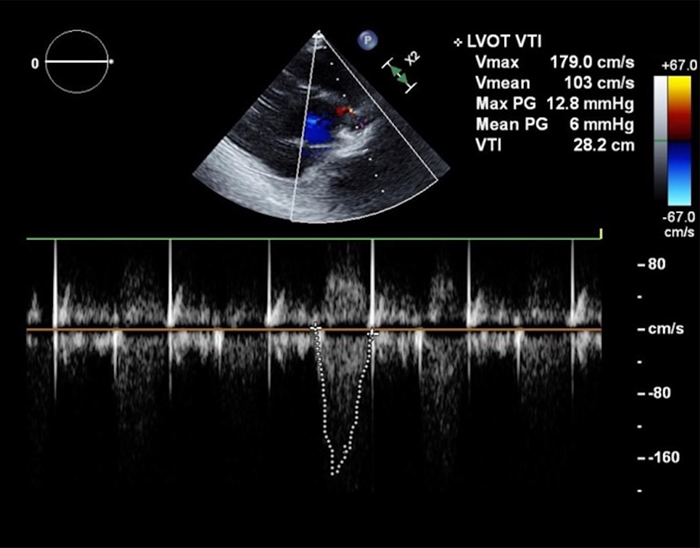
心尖部から中部にかけて前側壁で壁運動不良,中等度の大動脈弁逆流を認めた(Fig. 3).大動脈弁狭窄は評価困難であった.Simpson法にて左室駆出率40%,左室内径短縮率16%,拡張末期容積98 mL(76 mL/m2),収縮末期容積58 mL(45 mL/m2)と左心機能の低下を認めた.MRはわずかで,TRは中等度あり,三尖弁逆流圧較差は50 mmHgであった.両側の胸水もみられた.
入院後経過
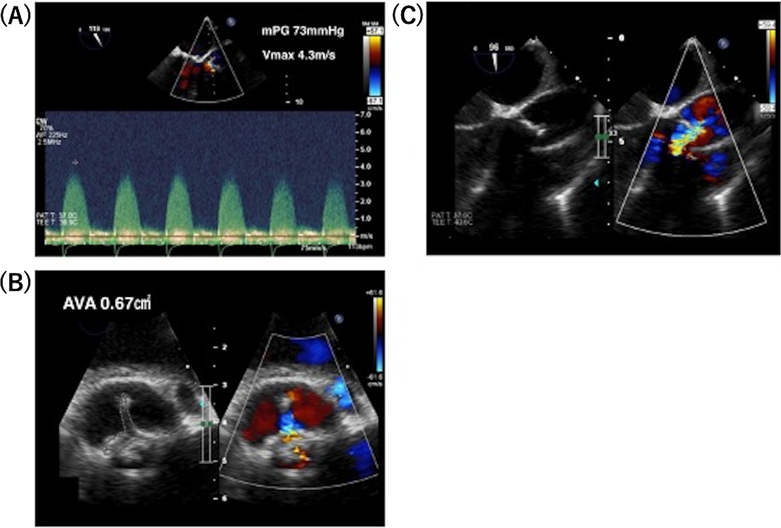
心電図のST-T変化とトロポニンT上昇を認めていたことから急性心筋炎の可能性も考慮し,小児集中治療室へ入室となった.低血圧やST-T変化が持続していたため,経口挿管と全身麻酔の上,経食道心臓超音波検査(transesophageal echocardiography: TEE)と心臓カテーテル検査を実施した.TEEでは,収縮期血圧50~70 mmHgの条件下で,大動脈弁平均圧較差は73 mmHg,大動脈弁最大血流速度4.3 m/sec,大動脈弁開口面積は0.67 cm2と重症大動脈弁狭窄の所見であった(Fig. 4).心臓カテーテル検査では,大動脈圧75/59(平均64)mmHg,肺動脈圧64/39(50)mmHg,肺毛細血管楔入圧38 mmHg,右室圧62/9(拡張末期圧13)mmHgであった.再度の大動脈弁基部置換術を要すると判断し,手術可能な施設に転院した.
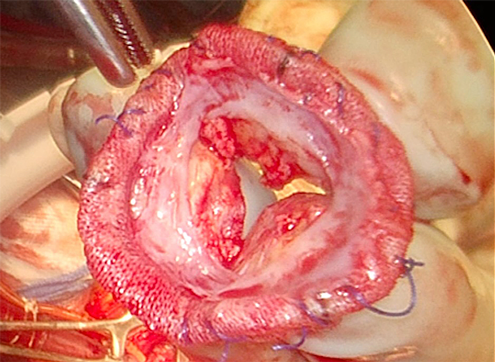
転院後より急激に循環不全が進行し,静脈脱血–動脈送血(VA)–体外式膜型人工肺(ECMO)導入を行った.同院でのTEEでは,構造的弁劣化による重症大動脈弁狭窄,生体弁周囲逆流を認めた.転院翌日に21 mm生体弁での大動脈基部置換術を施行した.術中所見として,生体弁は人工血管に直接縫合されており,生体弁と人工血管の縫合部の1/3周が破綻し,高度石灰化も認めた(Fig. 5).病理検査では高度石灰化を伴って線維化しており,培養は陰性であった.人工心肺からの離脱は困難であり,左室ベントを加えたECMO下に開胸帰室となった.
術後1週間でcentral ECMO離脱を行い,術後13日目で抜管,術後15日目でカテコラミン終了し,術後16日目で一般病棟へ転床となり,術後1か月で退院となった.退院時のTTEでは左室駆出率52%,ARなし,有効弁口面積1.84 cm2,大動脈弁最大血流速度1.84 m/s,大動脈弁平均圧較差8 mmHgであった.退院時のTTEでも心尖部アプローチでは描出困難であり,心窩部アプローチでの評価を行っている.今後,TEE,MRI,CTなどの検査も併用してフォローする予定である.
本症例では,人工血管と生体弁のアーチファクトに加え,側弯症によりTTEの描出が困難であった.側弯症を有する患者でTTEの評価が不十分であった症例は,最大矯正位Cobb角が有意に大きく,脊椎のflexibilityと胸椎後弯角が有意に小さかった3)との報告がある.そのため,このような胸郭異常を認めTEEが描出困難と予想される症例に対しては,左側臥位から腹臥位に近い体位で描出し,陥没した肋間をゼリーで埋めるなど工夫が必要である4).また,胸郭異常の患者にしばしばみられる痩せ型,立位心では,心窩部からアプローチしたり,心尖部四腔断面から3D探触子でビームの角度を回転させたりすると観察できることがある5).
TTEで評価が困難な場合の代替として,MRIやCT,TEEによる検査が有用と考えられる.MRIは検査時間が長くかかるが被爆なく,大動脈形態,心室容積および機能評価,弁逆流の定量化,有効弁口面積を求めることができ,4D-Flowを追加することで精密な血流解析ができる6).側弯症手術ではチタンが用いられることの多いが,その場合でもMRI撮影は可能である.一方,心臓CTは短時間で終了するため鎮静薬はより少量の投与で施行可能で,生体弁の石灰化や大動脈形態,周辺組織の評価,3D画像による立体的な構造評価も評価できる7).しかし,心臓CT撮像に際し至適心拍数を得るため,しばしば用いられるβ遮断薬によって低血圧,徐脈,呼吸困難などの副作用,また被爆を生じうる.TEEは侵襲性が高く静脈麻酔が必要であるが,アーチファクトが少なく大動脈弁,僧帽弁の形態や狭窄・逆流の機序の評価に優れている.
本症例では生体弁による大動脈基部置換術を行ったが,初回の手術時に有意な大動脈弁狭窄・逆流を認めなかったのでVSRRのほうが望ましかった可能性がある.Marfan症候群の患者におけるBentall術とDavid法に限定したVSRRの比較では8),VSRRのほうが大動脈遮断時間,体外循環時間が長いにもかかわらず,院内生存率,中長期生存率,再手術回避率は優れ,心不全と大動脈弁閉鎖不全の発生率はBentall手術で高かった.大動脈基部拡張,中等度以上のARはBentall手術群でそれぞれ69%,65%であったのに対し,VSRR群ではそれぞれ91%,20%であった.また,Flynnらのメタ解析では,VSRRのほうで遠隔期死亡が少なく,出血関連合併症や感染性心内膜炎も少なく,再手術回避率は両群で有意差を認めなかった9).本症例で認めた生体弁の石灰化の機序はよくわかっていないが,ステロイドの長期投与が石灰化の進行を抑制したとの報告もあり,免疫反応が介在している可能性がある10).またMarfan症候群ではElastin fragmentationにより上行大動脈で石灰化を来すことが多いとされている11).60歳以下の生体弁置換術例における人工弁機能不全発生率は15年で33%,20年で63%と報告されており12),本症例は先述の免疫学的機序やElastin fragmentationによる生体弁への石灰化により人工弁機能不全を来した可能性があるかもしれない.Marfan症候群のBentall手術では生体弁の石灰化の進行が早い可能性があり適応は慎重にすべきと考えられる.
以上より,若年者の予防的外科手術としてVSRRが良い適応と考えられるが,手術手技に複雑さを要するため熟練した外科医と施設の下で行う必要がある.