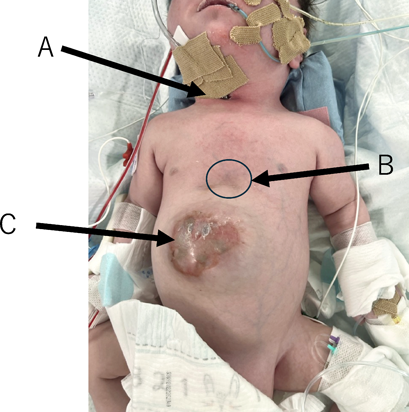
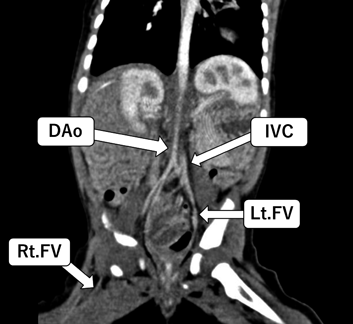
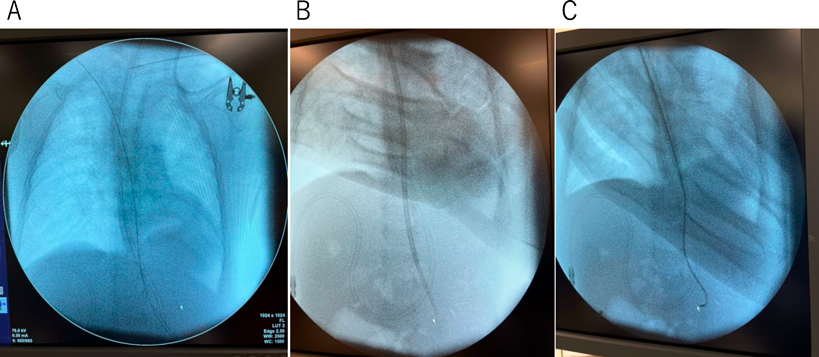
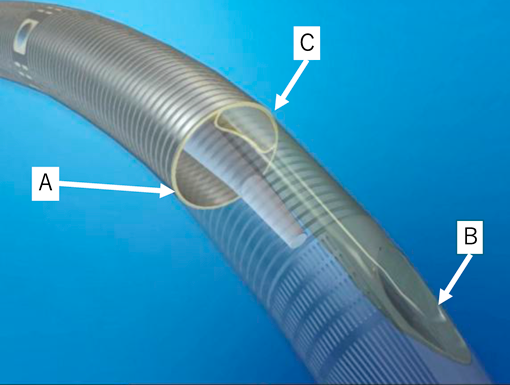
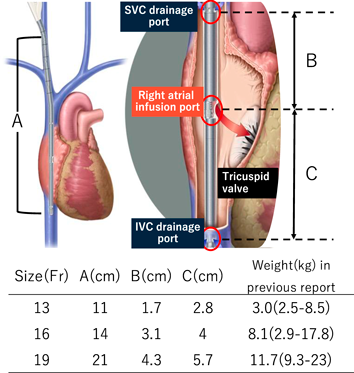
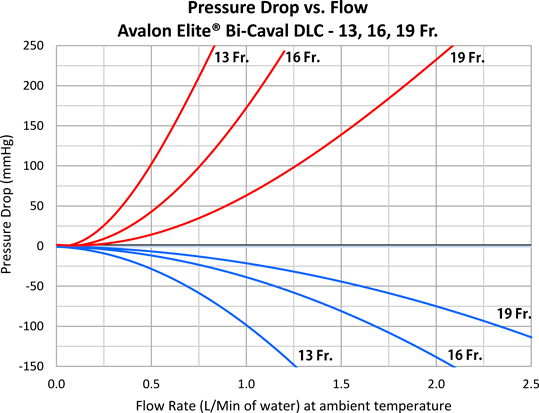
先天性心疾患乳児に対するAvalon Elite Bi-Caval Dual Lumen Catheterを用いたV-V ECMOの使用経験Avalon Elite Bi-Caval Dual Lumen Catheter to Facilitate Veno-Venous Extracorporeal Membrane Oxygenation in a Cardiac Infant with Limited Vascular Access: A Case Report
1 北海道立子ども総合医療・療育センター小児循環器内科Department of Pediatric Cardiology, Hokkaido Medical Center for Child Health and Rehabilitation ◇ Hokkaido, Japan
2 北海道立子ども総合医療・療育センター集中治療科Department of Pediatric Intensive Care Unit, Hokkaido Medical Center for Child Health and Rehabilitation ◇ Hokkaido, Japan
3 北海道立子ども総合医療・療育センター臨床工学部Department of Clinical Engineering, Hokkaido Medical Center for Child Health and Rehabilitation ◇ Hokkaido, Japan
4 北海道立子ども総合医療・療育センター新生児科Department of Neonatology, Hokkaido Medical Center for Child Health and Rehabilitation ◇ Hokkaido, Japan