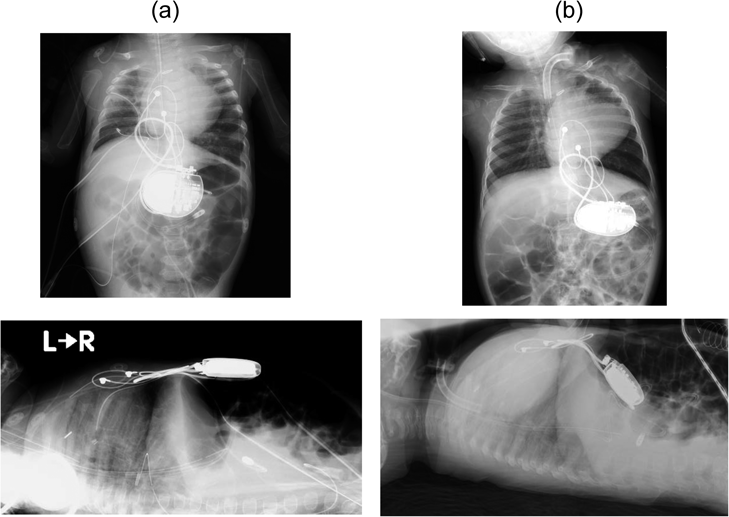
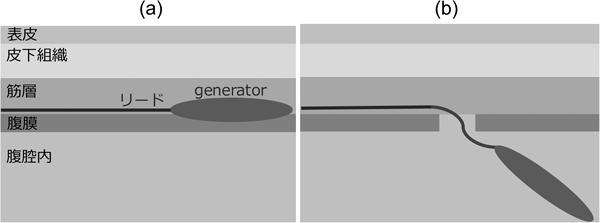
腹腔内へのペースメーカmigration診断から6か月後に待機的抜去術を行った1歳女児例A Pediatric Case of Elective Removal Surgery at 6 Months after the Diagnosis of Pacemaker Migration into the Abdominal Cavity
伊藤 智由希1,白神 一博1,佐藤 要1,渡辺 恵子1,小澤 由衣1,高見澤 幸一1,小川 陽介1,田中 優1,益田 瞳1,松井 彦郎1,柴田 深雪2,平田 康隆2,犬塚 亮1Tomoyuki Ito1, Kazuhiro Shiraga1, Kaname Sato1, Keiko Watanabe1, Yui Ozawa1, Koichi Takamizawa1, Yosuke Ogawa1, Yu Tanaka1, Hitomi Masuda1, Hikoro Matsui1, Miyuki Shibata2, Yasutaka Hirata2, Ryo Inuzuka1
1 東京大学医学部附属病院 小児科Department of Pediatrics, University of Tokyo Hospital ◇ Tokyo, Japan
2 東京大学医学部附属病院 心臓外科Department of Cardiac Surgery, University of Tokyo Hospital ◇ Tokyo, Japan
受付日:2025年1月22日Received: January 22, 2025
受理日:2025年7月9日Accepted: July 9, 2025
発行日:2025年8月1日Published: August 1, 2025