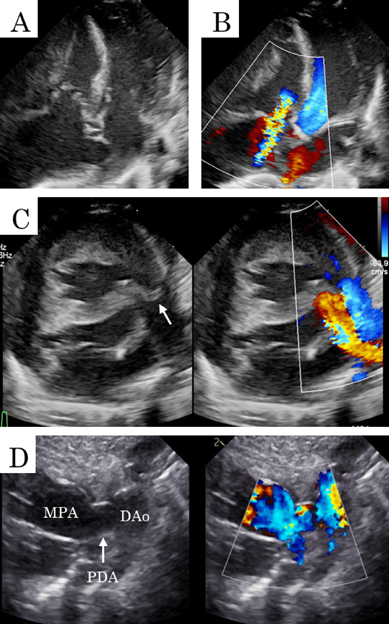
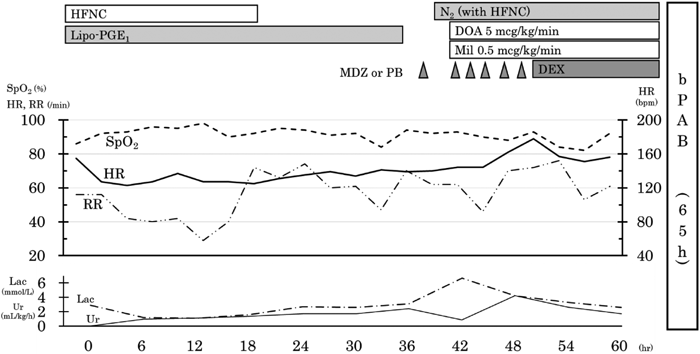
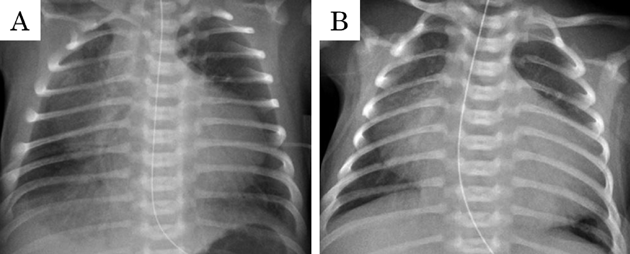
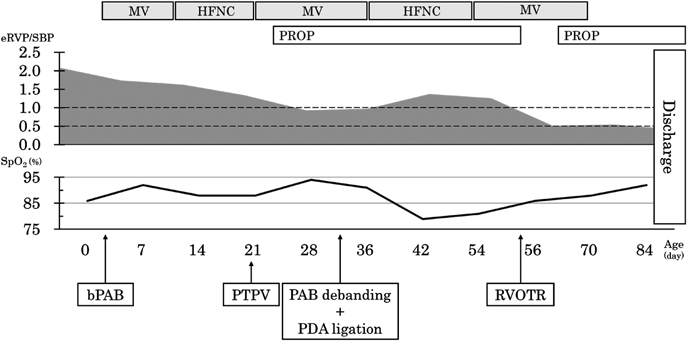
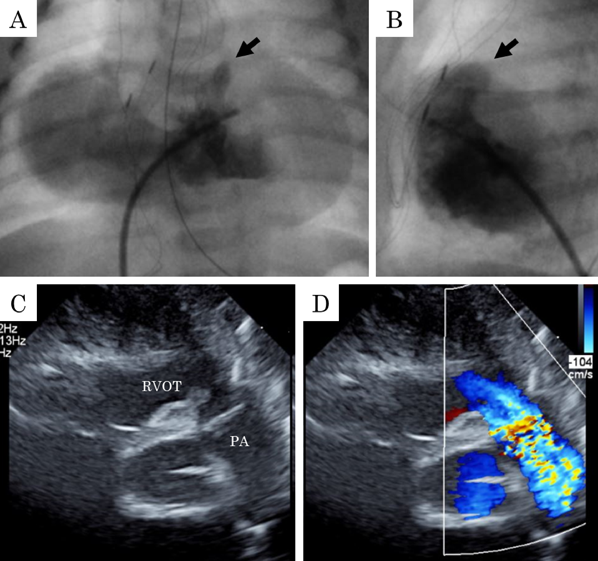
在胎35週の心室中隔欠損を伴わない肺動脈閉鎖における両側肺動脈絞扼術を用いた肺血流制御Bilateral Pulmonary Artery Banding to Regulate Excessive Pulmonary Blood Flow in Pulmonary Atresia with an Intact Ventricular Septum at 35 Weeks of Gestation
1 宮城県立こども病院 集中治療科Department of Intensive Care, Miyagi Children’s Hospital ◇ Miyagi, Japan
2 宮城県立こども病院 心臓血管外科Department of Cardiovascular Surgery, Miyagi Children’s Hospital ◇ Miyagi, Japan
3 宮城県立こども病院 循環器科Department of Cardiology, Miyagi Children’s Hospital ◇ Miyagi, Japan