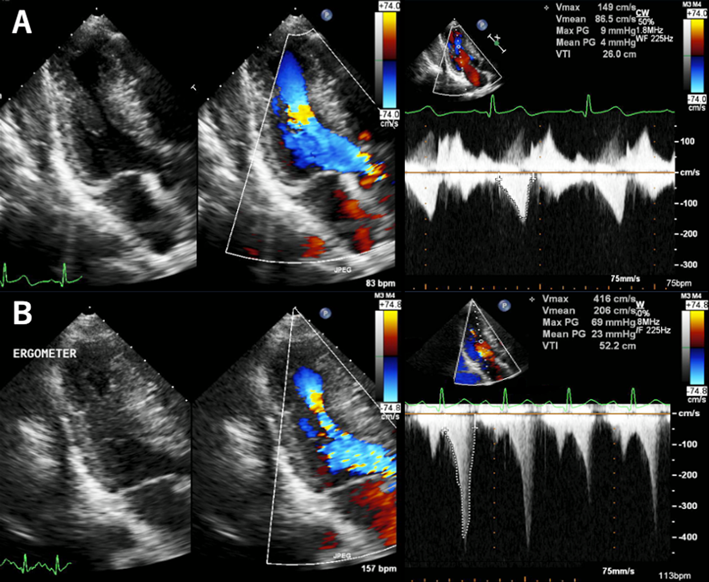
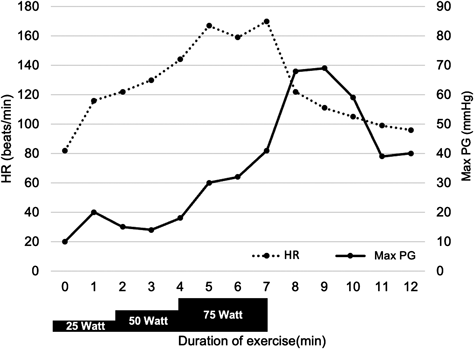
運動負荷心エコー図により心室中部閉塞を診断することができた無症候性小児肥大型心筋症の1例Asymptomatic Pediatric Hypertrophic Cardiomyopathy Diagnosed as Midventricular Obstruction by Exercise Stress Echocardiography
1 慶應義塾大学医学部 小児科学教室Department of Pediatrics, Keio University School of Medicine ◇ Tokyo, Japan
2 東京歯科大学市川総合病院 小児科Department of Pediatrics, Tokyo Dental College Ichikawa General Hospital ◇ Chiba, Japan
3 慶應義塾大学医学部 予防医療センターCenter for Preventive Medicine, Keio University School of Medicine ◇ Tokyo, Japan