心臓MRI(CMR)の最大の特徴は無被爆・非侵襲であることである.また多くの場合,非造影検査が可能であることも大きな特徴である.CMRは心血管解剖の可視化や心室容積/機能の定量化だけでなく,心筋組織の性状評価のためのゴールドスタンダードとなる非侵襲的心血管イメージングとして大きく発展してきている.特に,先天性心疾患congenital heart disease(CHD)で重要となる血行動態評価については,基本的な内容は非造影で評価可能であり,無被爆・非侵襲・非造影の検査となり,小児循環器領域にとても適した検査と言える.
また,成長に伴いエコー検査でビームが入りにくくなる右心系の評価はCMRが得意とする分野であり,CHD・成人先天性心疾患adult congenital heart disease(ACHD)領域では治療方針決定のキーとなることも多く,日常臨床でのCMRの活用が広がってきている.
そのようななか,再現性の高い一定水準以上の検査報告を日常臨床で行っていくためには,CMR検査の読影・撮影後の解析処理に対して,標準的な基準を設ける必要がある.また,定量的な測定値は,十分な品質の画像に基づいてのみ提供されるべきであるが,画質を不十分と判断する客観的基準がないため,この判断は読影する医師の経験に依存している.読影者には,正常例を含めた十分なトレーニングと臨床経験が必要で,正常変異の判断も含めたある程度の慣れが必要にもなる.
そのようなわずかな障壁はあるものの,無被爆・非侵襲・非造影で行えるCMRは,経時的に繰り返し検査が必要となるCHD・ACHD患者さんへ益する面が大きく,積極的に撮影されたい.
本稿では,CMRの撮影における技術的な側面と解析・読影に関する側面との両者について述べているが,いずれについても世界的なCMRの学会であるSociety for Cardiovascular Magnetic Resonance(SCMR)からGuidelines & Position Statementsが出ており,非学会員でもアクセス可能であり,非常に有用であるので一読を勧める1, 2).CHDに特化したものも発表されている3).
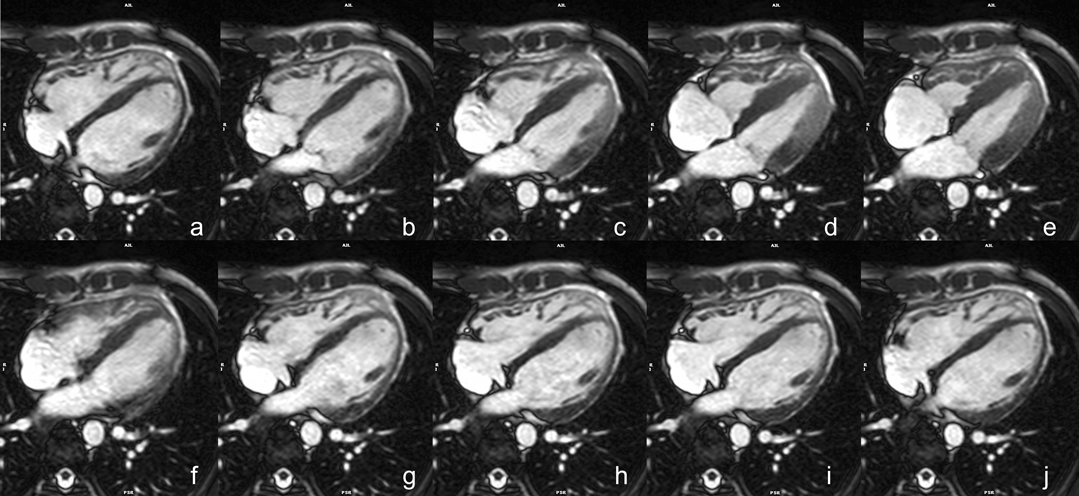
シネMRIは一心拍当たり数十コマの画像で心拍動を描出する(Fig. 1).この画像を連続的に再生(動画となる)することで,エコーのB modeと同様の映像を見ることができる(Movie 1).この画像を用いて心室の壁運動や心筋容積の評価を行うため,基本となる撮影法である.もちろん,心臓外の血管についても同様に評価可能で,体内で任意の断面を設定・評価できることが特徴的である.
撮影に用いるシーケンスはbalanced SSFP法(bSSFP法:balanced steady-state free precession法.MRIメーカーによってはtrue-FISP:true fast imaging with steady precession法,FIESTA法:Fast imaging employing steady state acquisition法と呼ぶこともある)である.このシーケンスは,シネMRIだけでなくパーフュージョンMRIやcoronary MRAなどにも用いられており,CMRの中心をなすシーケンスである.グラジエントエコー(GRE)法と呼ばれるシーケンスの一種で,当初そろっていた水分子のスピンの位相を傾斜磁場により分散させ信号が減衰した状態から,位相を元のようにそろった状態にすることで,信号が回復する際の位相変化を捉えて画像化する撮影法である.工学的な話になるため,詳細は文献を参照されたい4).なお,MRIシーケンスの解説については良質なwebサイトがある(https://www.mriquestions.com/).webサイトの作者が過去に出版した教科書5)の内容がweb上で更新が続いており,書籍よりもwebサイト(無料)をあたるほうがよいだろう.
MR機械の磁場強度(1.5 T or 3 T, Teslaテスラ:静磁場強度の単位)
シネMRIを撮影するためのシーケンスであるbSSFP法は1.5 TにおけるシネMRIのデフォルトの撮像法として確立されており,現在,大多数の施設で1.5 T装置が使用されている.しかし,3 Tで行われる検査が増えてきており,以下のような利点や注意点を認識する必要がある.
1.5 Tと3 Tを比較すると,静磁場強度に比例して3 Tのほうが信号強度が強くなるという差があるが,
- シネ画像ではT2値/T1値の比を用いて画像にしているため,1.5 T, 3 Tにおける画質の差は生じにくい.
- 使用する静磁場の不均一性(B0, B1の不均一性)から,血液と心筋のコントラストが低下したり,アーチファクトが目立ったりする.
- 肺と心臓のように磁化率が違うものが隣合っていると黒い線が入ってしまうbanding artifactと呼ばれる現象が生じるが,これは1.5 Tのほうが起きにくい.
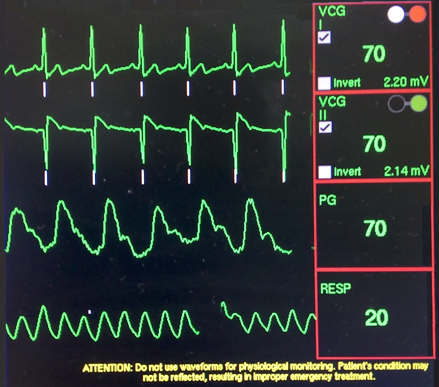
- 心電図同期は1.5 Tよりも3 Tで問題が生じる場合が多い.なお,シネMRIのようなレトロスペクティブ同期を要する撮像では,心電図の代わりに末梢脈拍ゲーティングが有効なこともある(Fig. 2).Fig. 2では,図の上段にベクトル心電図(VCG)が,その下に末梢脈拍信号(PG: pulse gating)が表示されている.これら3つの波形はいずれも心拍数が70で一致している.末梢脈拍信号は心電図と同様に心周期を示しており,この信号によるゲーティングでも心周期に同期したMRI画像を撮影できる.
- 磁界を介して体内へ投入できる単位時間当たりのエネルギー量(体へかけられる磁力)はSAR(specific absorption ratio:比吸収率)として法律で制限されている(体内での発熱を抑制するため).SARは1.5 T, 3 Tで共通した上限値が設けられており,静磁場強度の2乗に比例してSARは高くなることから3 Tは1.5 Tと比較してこの面からも不利である.
撮影条件を調整することでこれらの問題はある程度改善し,現在では3 TでのシネMRIは臨床的に有効とされているが,1.5 TでのシネMRIと比較して臨床的優位性は確立されていない6).
ここで,CMRで撮影される,シネ以外の撮影法における1.5 T/3 Tの差異についても言及しておく.通過血流量を計測するのに用いるphase contrast画像においては,それぞれの液体の流速差を画像の信号差としているため,1.5 Tと3 Tにおいて画像コントラストに差を認めない.また,造影検査であるLGE: (late gadolinium enhancement)においては信号値そのものを画像にしているため(LGE該当部分のT1短縮(緩和時間が速くなる)効果によってコントラスト差がつく),3 Tのほうがよりコントラストの強い画像となる.
順に以下の画像を撮影していく.
- スカウト像(体軸横断,冠状断,矢状断のうち体軸横断のみでもよい).1回の呼吸停止,1心拍での撮像とする.
- 胸部全体をカバーする体軸横断(スライス厚8~10 mm)のbSSFPまたは高速スピンエコーの画像.これらは1~2回の呼吸停止で撮影するシングルショット,1心拍での撮像である.
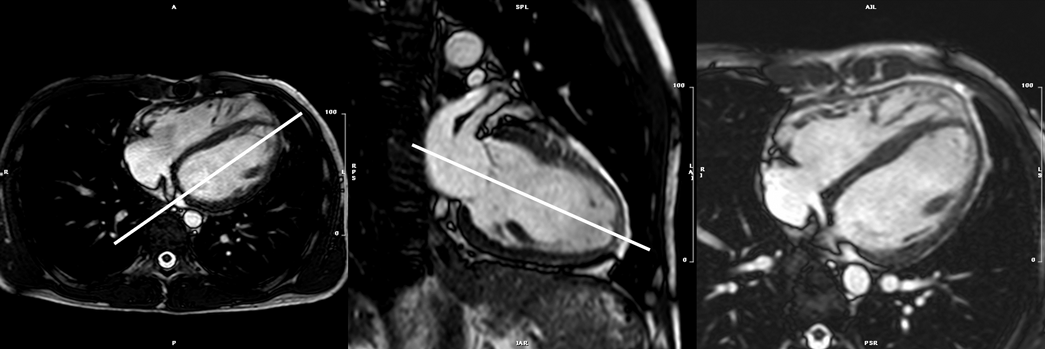
- bSSFP左室短軸像シネMRI(Fig. 3)
- 左室や右室の駆出率など心機能計測に用いる,非常に重要な撮影である.左室心基部から心尖部までを含める.スライス厚は,6~8 mm,ギャップ2~4 mm(全体で10 mmとなるように設定).壁運動の評価を最適化するためにシネMRI各時相間の時間分解能<45 msecとする.呼吸停止下で撮像するのが理想的.呼気時の呼吸停止のほうが安定した体位を得やすいが,患者によっては吸気時の呼吸停止のほうが楽という場合があり,その際には吸気で撮影する.左室短軸断面は二腔長軸像および四腔長軸像のスカウト像を用いて決定する.この断面は長軸像の左室中央部と直交するスライスとなる.長軸方向の壁運動と血液の流入が描出される必要があるためシングルショットMRIよりシネMRIが望ましい.
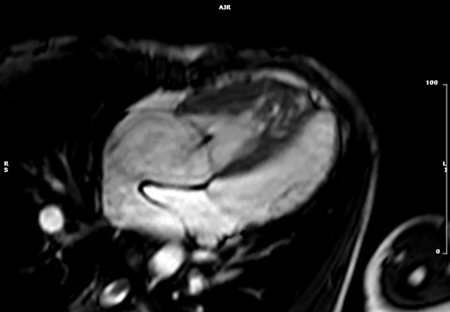
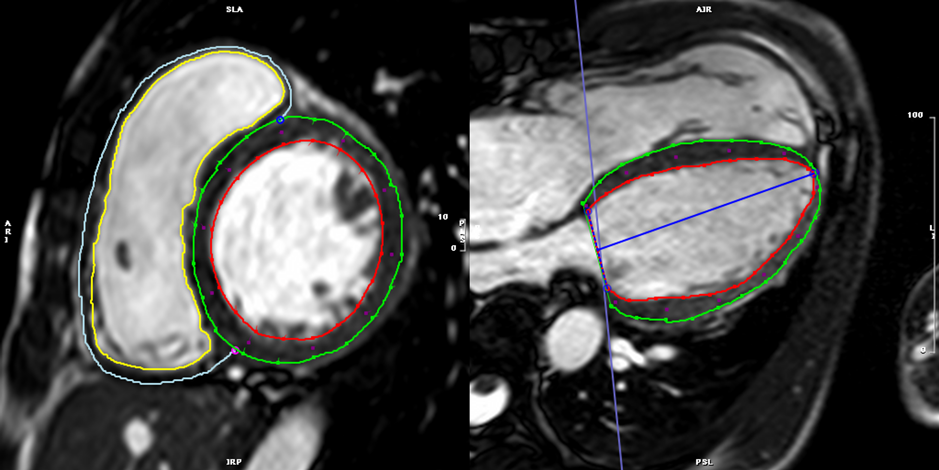
- 左室二腔(垂直)長軸像:体軸横断上で僧帽弁の中心と心部を結ぶスライス(Fig. 4)
- 四腔(水平)長軸像:二腔長軸像に垂直で,僧帽弁と左房の中心を通り,左室の長軸へと続くスライス(Fig. 4)
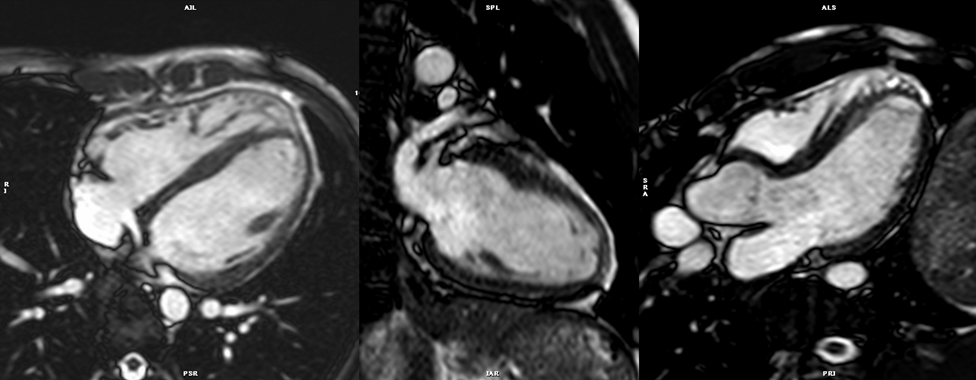
- bSSFP長軸像シネMRI(Fig. 5)
- 左室短軸断面以外に以下の基本3断面の撮影をする.検査時間の関係で,心臓全体をカバーするような撮影は行わず,撮影範囲は該当する3断面のみとすることが一般的である.
- 四腔長軸像:二腔長軸像上で,僧房弁の中心,三尖弁の中心および心尖を通る断面.
- 左室二腔像:すでに得られた垂直長軸断面から左室前壁・下壁を通るように設定.
- 左室三腔像:心尖と僧房弁の中央を通り,左室流出路(LVOT)の中心と大動脈弁を含む断面.
右室のためにわざわざ撮影断面の設定をせずとも,上記の左室短軸像シネ画像に一緒に映るRV形態を評価すればよい(RVのためだけに撮影を追加する必要はない).
あえて右室の撮影断面を設定する場合は以下のとおりである.
- 右室容積計測に短軸像を使用する場合は,最も心基部側の短軸断面を右室心筋縁の直上とする.
- 右室長軸像としては,三尖弁流入部を通る右室垂直長軸像と右室流出路長軸像(肺動脈弁を通る矢状断像またはオブリーク矢状断像)などがある.
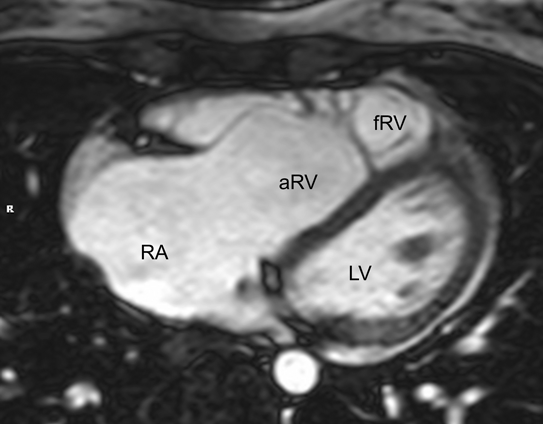
なお,右室容積計測には,右室全体を含む体軸横断像のシネMRIを代替的に用いることも可能である.これはエコーにおける四腔像に相当し,特にEbstein病の患者さんで,三尖弁前尖,中隔尖の形状,右房や心房化右室の大きさの評価に有用である.
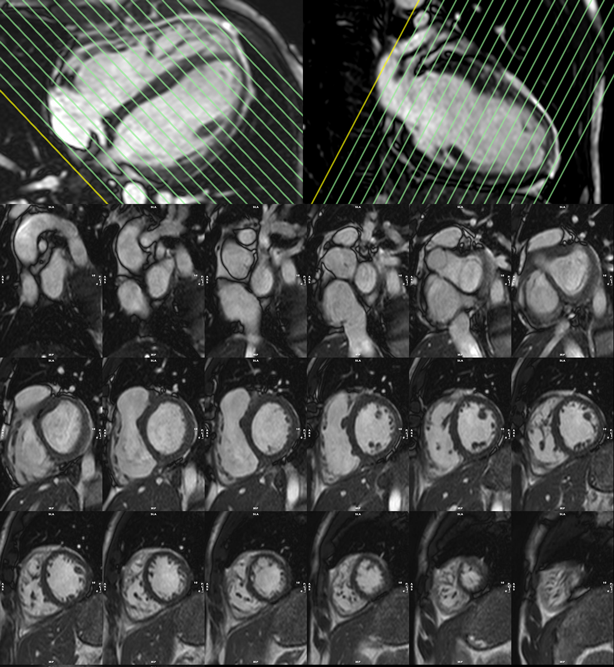
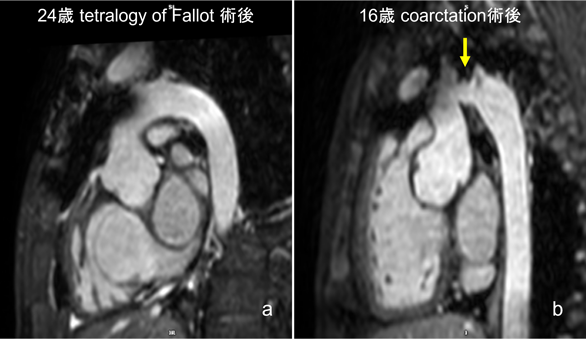
心室だけでなく,aortaなどの大血管形態評価も可能である(Fig. 6).
詳細はMR angiographyの項へ譲るが,空間分解能はCTに劣るが,息止めができるとCMRでも十分な形態評価が可能である.小児において息止めができない症例においては撮影にあたって2つの工夫が考えられる.一つ目は腹帯を巻いたり,寝台への固定ベルトを強めに巻いたりして,腹部を軽度圧迫することにより呼吸運動を浅くすることである.浅い呼吸運動とすることで撮影対象の動きを抑えられる.一方で呼吸を弱めることになるためSpO2モニターでの監視をしっかりと行う必要がある(薬剤鎮静時ほどの呼吸抑制には通常至らない).もう一つの工夫は撮影時の画像の加算平均回数を増やすことである.例えば,静脈系での撮影時には3拍分の加算平均で画像を作るものを5拍分の加算平均とするなどの工夫である.
シネMRIの撮影の項で記載したように,左室長軸に沿って心臓全体を連続する単軸像で撮影し評価する(Fig. 3).
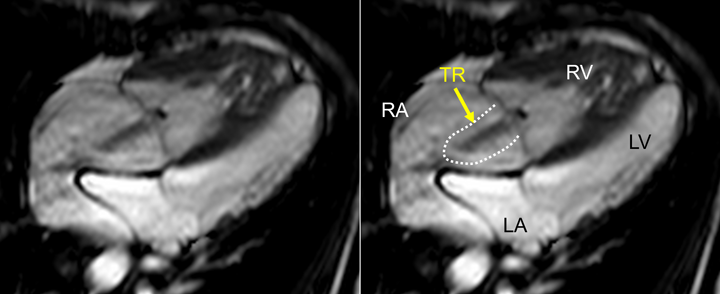
- a)詳細な解析を行う前に,すべてのシネ画像を確認し全体像を把握する.また同時に,各断面の観察を行い,アーチファクトの有無をチェックする.CMRは心電図同期下に撮影・作像するため,特に不整脈患者でアーチファクトを来しやすい.重度の不整脈患者では,収縮末期容積が過大評価され,駆出率が過小評価される傾向がある.シネMRI画像で弁逆流の定量的評価はできないが,血流を描出できるため,逆流の定性的な評価は可能であり,最初に確認しておく(Fig. 7).ただし,同一平面上の逆流しか描けないため,同一平面上に吹かない逆流については逆流の程度をunder estimateしてしまうことにも注意が必要である.
- b)収縮期における壁厚増加率に基づいて左室各セグメントの局所的な機能を,過運動(hyperkinetic),正常運動(normokinetic),低運動(hypokinetic),無運動(akinetic),逆方向運動(dyskinetic)に分類して評価する.冠動脈支配領域に則った標準的な左室セグメント分類に則る7).
- c)グローバルな心室機能の評価(EFやstroke volumeの算出)をする.別稿で扱うflow studyと合わせて,Qp, Qsの評価を行う.シャントや弁逆流が存在しない場合には,右室と左室の一回拍出量はほぼ同程度となるはずである(気管支動脈・静脈から左房へ還流する血流の存在によって,5%程度の差異が生じうる)8).
以下の方法により,左室拡張末期容積,左室収縮末期容積,左室駆出率,一回拍出量,心拍出量,左室心筋重量を計測する.左室駆出率以外のすべてのパラメータでは,体表面積で除した値を算出する.
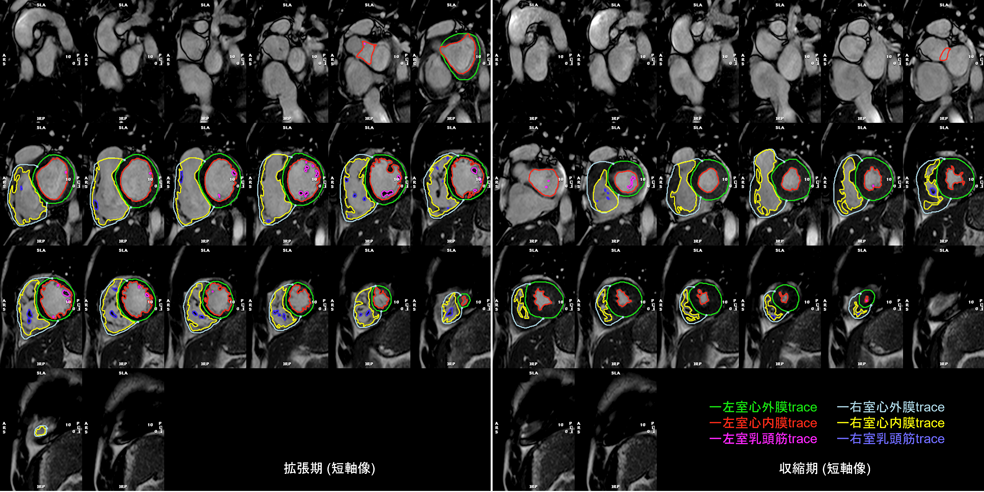
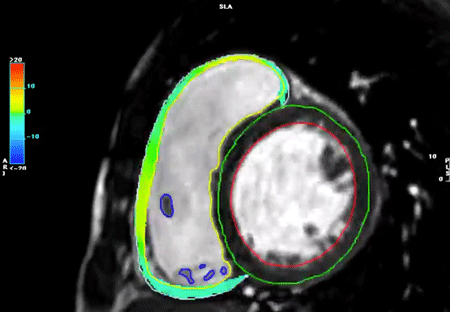
心室全体をカバーする単軸像すべてに対して,心外膜と心内膜の輪郭をトレースすることで,内腔容積を算出する.短軸像を積み重ねることで心室全体の容積が算出できる.拡張末期と収縮末期の両時相において内腔容積を計測することで,拍出量や駆出率などが算出される(Fig. 8).
左室拡張末期の画像の選択には,全時相の画像を評価して,左室内腔血液容積が最も大きい時相を肉眼的に選択する.選択したある一つの時相の短軸像シリーズ全体(心基部から心尖部にかけて)を拡張末期として適応する.僧帽弁が閉鎖する時相や,大動脈弁の開口直前の時相が左室拡張末期を同定するための参考にもなる.
同様に,左室収縮末期の画像シリーズを左室内腔血液容積が一番少なくなる時相で選択する.また,右室と左室で拡張末期や収縮末期がずれていることがしばしば認められる.その際は左室・右室独立して,それぞれ別の時相での計測をすればよい(機能的・解剖学単心室の場合の取り扱いは後に述べる).
なお,心臓内のスライス位置によって収縮末期がずれることもある.例えば,心基部と心尖部では収縮末期が1時相ずれていることがあり,その際は両時相で左室内腔血液容積を計測し,より小さい容積となる時相を収縮末期と決定する.拡張末期においても同様である.左室同期不全(LV dyssynchrony)においても同様の方法で収縮・拡張末期を決定する.
なお,心内膜だけをトレースすれば心筋重量以外の測定項目(EFなど)をすべて計測でき,解析結果を急ぐ場合には心内膜だけのトレースでもすむが,疾患によっては心筋重量は重要な要素となる.また,本稿後半で触れるようにstrain計測を行うにはきれいな心外膜のトレースが必須である.なお,心外膜のトレースは,画像のコントラストを調整することで周囲組織との境界が明瞭になりトレースが容易となる.
心外膜付近でchemical shiftアーチファクトを認めた際には,chemical shiftアーチファクト中間部分で心外膜のトレースを行う.chemical shiftアーチファクトとは,臓器の辺縁や脂肪が多く含まれる組織と水が多く含まれる組織との境界面でよくみられるものである.脂肪と水のMRI信号のわずかなズレにより,画像上で位置情報がずれてしまうアーチファクト9)で,心外膜が本来よりも厚く見えてしまう.
乳頭筋の取り扱い
乳頭筋や肉柱は心筋組織であり,理想的には心内膜をトレースする際に心筋に含むべきである.以下に述べる心筋重量の計測を考慮すると,特に左室肥大をきたす疾患の場合には心筋に含むことが重要となる.
しかしながら,解析用アプリケーションによっては乳頭筋を心筋に含むために手動トレースが必要となる背景があり,乳頭筋を左室内腔容積に含むことも許容されている(内腔容積の正確性は低下するが).関連して重要なことは2点あり,乳頭筋を内腔容積に含んでいるとレポートに記載することと,経時的に繰り返し撮影する場合には同じ方法で計測し経時的な評価を行うことである.
左室心基部の下降運動
収縮期に僧帽弁が心尖部に向かう動きがあるので,最も心基部寄りの1~2スライスのトレースには注意を要する.拡張期には左室内腔だったスライスにおいて,収縮期には左室内腔を含まず左房を含んでいる可能性があるからである.
単軸像と同時に長軸像を表示させ参照すると房室弁輪の下降運動がわかりやすい.また左房は壁厚増加や内腔を追跡することで識別可能となる.壁厚増加がある場合や収縮期に内腔が収縮する場合,それは左室腔内であることを示す.心室とは反対に,収縮期に内腔が拡大するのが心房である.そのほか,血液を左室心筋が50%以上取り囲む場合を,左室基部として定義する方法もある.
左室流出路
左室流出路は左室内腔の一部として含む.大動脈弁尖端が心基部スライスにみられる場合は,トレースは流出路を含み大動脈弁尖端まで行う.
左室心筋重量
心外膜で囲われた容積と心内膜で囲われた容積の差分から心筋の容積が算出される.この容積に心筋密度1.05 g/mLをかけて重量を算出する.なお,最も基部のスライスにおいても,小さな三日月状の基部側壁の心筋と左房のみを認め,左室内腔を認めないことがある.また,最も心尖部にあたるスライスでは心筋のみしか認めないこともある.これらのスライスでも,左室心筋重量測定には含む.
基本的には上記の左室計測と同様である.
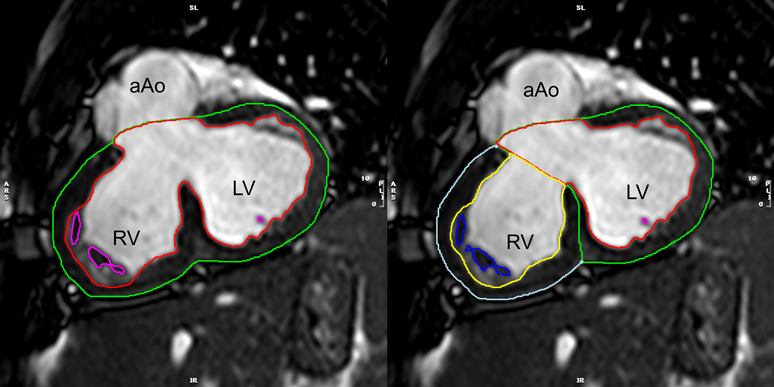
左右心室の拡張末期・収縮末期のタイミングが一致している場合は,左室の計測を行った後に同じ時相(画像)で右室の心内膜・心外膜トレースを行うことができ,心室中隔部分のトレースを省けるため簡便である(心室中隔は左室に含まれる)(Fig. 8).
右室流出路
左室流出路と同様に,右室流出路も右室内腔の一部として含む.肺動脈弁が描出されていればわかりやすく,その直前まで右室内腔として扱い,それより上方は含まない(肺動脈である).鑑別の方法としては,収縮期に拡張するのが肺動脈,収縮するのは右室とする方法もある.ただし,右室流出路再建術後などで右室流出路に瘤形成を伴っていることもあり,その場合はこの鑑別法は使えないため,症例ごとに慎重に判断する必要がある.
索状組織や乳頭筋の取り扱い
左心室解析と同様に,これらは心筋に含むように解析することで,より正確な右心室容積の計測ができる.しかし,解析アプリケーションによってはそれが難しいこともあり,索状組織や乳頭筋を心腔内として扱って解析することも一般的に許容されている.なお,右室内の索状組織や乳頭筋を右室容積に含めず,心筋として扱える解析アプリケーションは増えてきている.
右室心筋重量
心室壁が薄く,心外膜のトレースが難しいために通常のルーチン評価では計測しないこともある.ただし,肺高血圧症や修正大血管転位症の一部など,右室圧が上昇し心筋肥厚が見られる患者さんでは,右室心筋重量を計測することが望ましい.なお,右室の心外膜トレースも,左室同様に画像のコントラストを調整することで周囲との境界が明瞭になりトレースが容易となる.
心室機能に関する正常値の報告を引用しておく.成人10–14),小児15–17).なお日本人の正常値データは石川ら18)から報告されている.
a.Ebstein病
シネMRIの撮影の項でも記載したが,右室容積計測には,右室全体を含む体軸横断像のシネMRIを代替的に用いることも可能である.これはエコーにおける四腔像に相当し,特にEbstein病の患者さんで,三尖弁前尖,中隔尖の形状,右房や心房化右室の大きさの評価に有用である(Fig. 9).
b.単心室症例
単心室症例には,解剖学的単心室症例(左右心室のいずれかが低形成・瘢痕的)と機能的単心室症例(左右心室いずれも容積はしっかりある)とがあるが,いずれの場合にも血行動態的には単心室として機能している.このため,駆出率などの計測をする際には,左心室・右心室をあわせて1つの心室としてトレースするのがよい(Fig. 10)19).ただし,二心室修復可能かどうかの評価目的などで,左心室・右心室それぞれの拡張末期容積や駆出率が必要な場合は,術後の中隔線をイメージしながら仮想的に心室中隔を設定して左右心室を分けてトレースをすればよい(Fig. 10).
(1)strain(Figs. 11–13, Movies 2–5)
strain計測法の歴史
EFよりも心室の収縮能を鋭敏に反映するとされているstrainをCMRで計測可能である.左室だけでなく右室のstrainも計測可能で,最近は心房strainについての報告も出てきている.臨床的な意義についても報告が出てきており,その重要性が注目されている19).またdyssynchronyの検出にstrainを応用する試みも報告されている20).
strainは元来エコーで発展した指標で,CMRでstrainを計測するには,以前は心筋組織にtagを付けて撮影するtaggingという撮影を追加で行う必要があり,手間や時間がかかった.しかし,(撮影機器と)解析アプリケーションの発展に伴い,ルーチンで撮影するシネMRI画像から,feature trackingという方法を用いて後方視的にstrainが計測できるようになった21).feature tracking法はMRIの磁場などとは関係ない,ピュアな画像処理技術に基づいている.不規則性も含めたその画像上の心筋の特徴をとらえることで,細かく分けた心筋1箇所1箇所が心収縮期の中でどのように移動(収縮・拡張)するかを追跡することが可能になったのである.移動速度を計測することでstrainが算出される.feature tracking法という技術革新により,前方視的な研究だけでなく,過去に撮影した症例のシネMRIからstrainを振り返って解析できるようになることも特徴である.時間分解能(1心拍をエコーは60フレーム以上程度,CMRは20~30フレーム程度で撮影)や空間分解能(画像のslice厚)においてCMRはエコーに劣るが,これまで臨床的な意義がはっきりしていなかったstrainの様々なエビデンスがfeature tracking法により集まってきており,今後のさらなる発展が期待される.なお,解像度が悪く,追加撮影も要するtagging撮影は行われなくなった.
strainの解析結果・方法
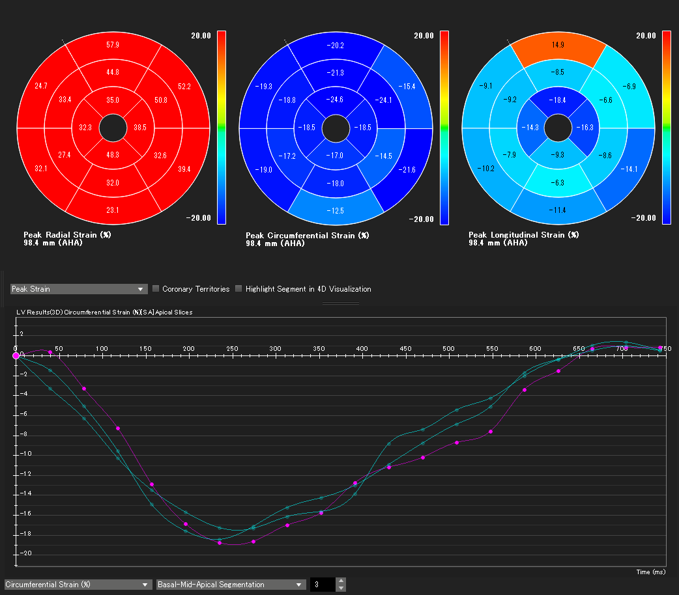
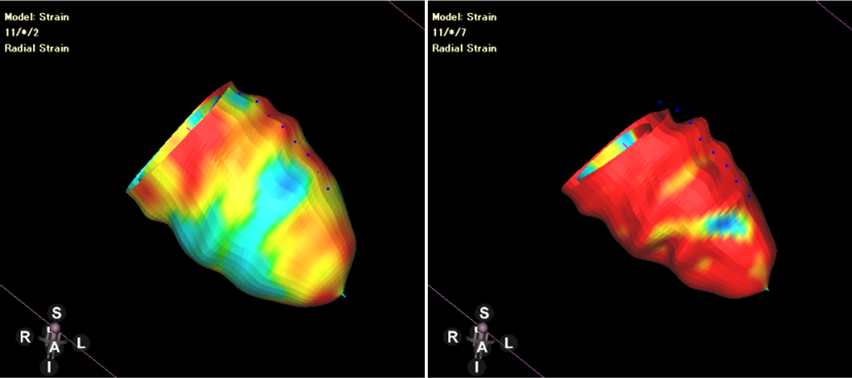
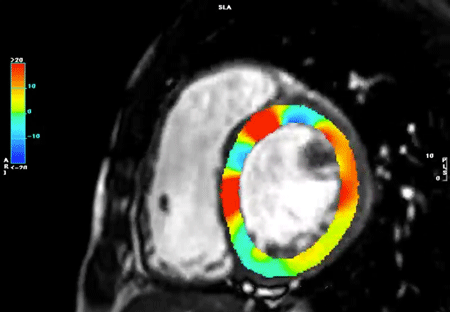
左室全体としての心筋ストレインをglobal strainといい,それぞれの方向でglobal circumferential strain(GCS),global radial strain(GRS),global longitudinal strain(GLS)と呼ばれる.四空長軸像や左室二腔像,短軸像などの断面像を用いて以下の方法に則って心室strainの解析を行うと,GCS,GRS,GLSがそれぞれ算出される.また,これらの断面を複数組み合わせて同時に解析を行うことで3Dでのstrain解析を行うことが可能となり,AHA 16 segment modelでの結果表示や,心室3Dモデルにカラーを載せて結果を表示することも可能となる.一例として,解析アプリケーション“CVI42”(Circle Cardiovascular Imaging, Calgary, Canada)を用いた解析結果を示す(Figs. 12, 13, Movies 2–5).
一心周期内の任意の一時相で心内膜・心外膜をトレースするだけで,あとはアプリケーションが自動的に心筋の収縮・拡張を心周期全体で追跡し,strainが算出される.
この解析に際してのコツは2つあり,トレースの仕方と解析結果の確認である.
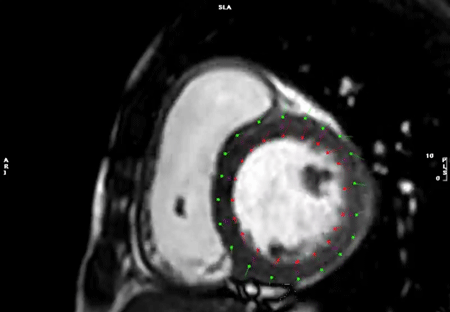
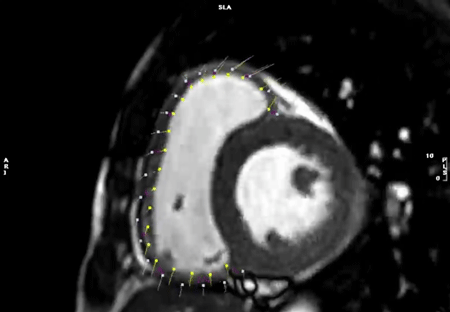
まず,心内膜・心外膜のトレース線は駆出率を算出した際のトレース線をそのまま用いることも可能である.しかし,乳頭筋や右室の索状組織などを心筋に含んだトレース線のままでは,心内膜線が複雑な凹凸を示すため,うまく心筋の収縮を追跡できないことが多い.このため,strainの計測をする際には心内膜のトレース線を,乳頭筋や右室の索状組織などを含ない凹凸のないシンプルな曲線(心腔容積計測では推奨されないトレース線)として描くことがコツである(Fig. 11).
次に,アプリケーションが心筋の収縮を正確に追跡できているか,全スライス・全時相で確認する必要がある.うまく追跡できていない場合には,心筋の動きをしっかり追跡できるように,最初に設定した任意の一時相におけるトレース線に戻って,少しずつ修正して,正確に追跡できるか確認するという作業を繰り返す必要がある.
単心室系での心筋strain計測は,駆出率などを計測した際と同様に2つの心室を1つの心室として扱って行う19).
CMR strainのエビデンスが蓄積中であり,今後の発展が期待される.
(2)撮像時間短縮技術
CMRの問題点は少ないが,その1つに検査に長時間を要する点が挙げられる.また,検査中に息止めを何度も要することもあり,患者さんへの負担は無視できない.このため,撮影にかかる時間を短縮化する研究が進んでいる.
その1つに圧縮センシング(compressed sensing: CS)という技術がある.これはデータ撮影をランダムに間引いて撮影することで撮影時間を短縮化する方法である.取得するデータ数が減少するため,そのままでは画質が低下してしまうが,撮影後に数学的にアーチファクトを消すなどの補正をかけることで,従来に近い画質のシネMRIが撮影できるようになってきている.撮影時間については,従来の1/5程度など,大幅に短縮できる可能性もある.
またCSには撮影時間短縮以外のメリットも考えられる.従来のシネMRI撮影法は複数心拍のデータを用いてretrospectiveに画像を再構成するため,不整脈例や息止め不良例では心拍ごとの収縮率・収縮パターンが変化してしまうため,でき上がりの画質が劣化するという問題点があった.一方でCSではリアルタイムcine撮影となり,1心拍で1断面を撮影することが可能となるため,上記の問題点の改善策となりうるという良い側面もある22).
その他の技術革新としては,motion correctionをCSに併用した呼吸同期撮像という方法も出てきている.この撮像法は息止めをせずに,自由呼吸下でCSシネを12心拍連続撮像し,呼吸の動きが少ないデータのみを自動的に選択し,さらに呼吸に伴う動きの補正をかけて画像を再構成するという方法である23).撮像時間の大幅な短縮には繋がっていないが,息止めが不要となる点は,息止めができない小児に応用できる可能性がある.
これら撮像法の今後のさらなる発展が期待される.
日本では海外に比してCMRの普及が遅れている.CHD領域においてCMRはとても有用なツールと考えられるが,普及の妨げになっているのは撮影の技術的な難しさだけでなく,撮影後の読影・解析の煩雑さがあると考える.撮影後の解析については,他施設との画像の共有が容易になってきて,他施設と相談しながら解析を行うことも可能になっており,安心して取り組める状況になってきていると考えられる.本稿がCMRの基礎知識の整理になり,日本でのCMR普及に貢献できれば幸いである.
利益相反
本論文について,開示すべき利益相反(COI)はない.
著者の役割
白神一博:論文の構想,執筆
石川友一:批判的推敲に関与
引用文献References
1) Kramer CM, Barkhausen J, Bucciarelli-Ducci C, et al: Standardized cardiovascular magnetic resonance imaging (CMR) protocols: 2020 update. J Cardiovasc Magn Reson 2020; 22: 17
2) Schulz-Menger J, Bluemke DA, Bremerich J, et al: Standardized image interpretation and post-processing in cardiovascular magnetic resonance — 2020 update: Society for Cardiovascular Magnetic Resonance (SCMR): Board of Trustees Task Force on Standardized Post-Processing. J Cardiovasc Magn Reson 2020; 22: 19
3) Mark AF, Shaftkat A, Craig B, et al: Society for Cardiovascular Magnetic Resonance/European Society of Cardiovascular Imaging/American Society of Echocardiography/Society for Pediatric Radiology/North American Society for Cardiovascular Imaging Guidelines for the use of cardiovascular magnetic resonance in pediatric congenital and acquired heart disease. Circ Cardiovasc Imaging 2022; 15: e014415
4) 押尾晃一:GRE法.日磁気共鳴医学誌2022; 42: 79–86
5) Allen DE: Questions and Answers in Magnetic Resonance Imaging. U.S.A., Mosby, 2000
6) 石本 剛,谷口泰代:心臓—3T-MRIによる心臓MRI検査の光と影—.INNERVISION 2010; 25(9): 13–16
7) Selvadurai BSN, Puntmann VO, Bluemke DA, et al: Definition of left ventricular segments for cardiac magnetic resonance imaging. JACC Cardiovasc Imaging 2018; 11: 926–928
8) Iwamoto Y, Inage A, Tomlinson G, et al: Direct measurement of aortic regurgitation with phase-contrast magnetic resonance is inaccurate: Proposal of an alternative method of quantification. Pediatr Radiol 2014; 44: 1358–1369
9) Quick H: MRIで生じるアーチファクト.https://radiology.bayer.jp/sites/g/files/vrxlpx8716/files/2023-02/mri-artifact.pdf
10) Maceira AM, Prasad SK, Khan M, et al: Normalized left ventricular systolic and diastolic function by steady state free precession cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2006; 8: 417–426
11) Hudsmith LE, Petersen SE, Francis JM, et al: Normal human left and right ventricular and left atrial dimensions using steady state free precession magnetic resonance imaging. J Cardiovasc Magn Reson 2005; 7: 775–782
12) Natori S, Lai S, Finn JP, et al: Cardiovascular function in multi-ethnic study of atherosclerosis: Normal values by age, sex, and ethnicity. AJR Am J Roentgenol 2006; 186 Suppl 2: S357–S365
13) Raisi-Estabragh Z, Kenawy AAM, Aung N, et al: Variation in left ventricular cardiac magnetic resonance normal reference ranges: Systematic review and meta-analysis. Eur Heart J Cardiovasc Imaging 2021; 22: 494–504
14) Wang TKM, Kwon DH, Griffin BP, et al: Defining the reference range for left ventricular strain in healthy patients by cardiac MRI measurement techniques: Systematic review and meta-analysis. AJR Am J Roentgenol 2021; 217: 569–583
15) Buechel EV, Kaiser T, Jackson C, et al: Normal right- and left ventricular volumes and myocardial mass in children measured by steady state free precession cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2009; 11: 19
16) Olivieri LJ, Jiang J, Hamann K, et al: Normal right and left ventricular volumes prospectively obtained from cardiovascular magnetic resonance in awake, healthy, 0- 12 year old children. J Cardiovasc Magn Reson 2020; 22: 11
17) van der Ven JPG, Sadighy Z, Valsangiacomo Buechel ER, et al: Multicentre reference values for cardiac magnetic resonance imaging derived ventricular size and function for children aged 0-18 years. Eur Heart J Cardiovasc Imaging 2020; 21: 102–113
18) Ishikawa Y, Urabe H, Yamada Y, et al: Normal ventricular and regional blood flow volumes and native T1 values in healthy Japanese children obtained from comprehensive cardiovascular magnetic resonance imaging. Int Heart J 2023; 64: 663–671
19) Shiraga K, Ozcelik N, Harris M, et al: Imposition of Fontan physiology: Effects on strain and global measures of ventricular function. J Thorac Cardiovasc Surg 2021; 162: 1813–1822.e3
20) Prati G, Vitrella G, Allocca G, et al: Right ventricular strain and dyssynchrony assessment in arrhythmogenic right ventricular cardiomyopathy. Circ Cardiovasc Imaging 2015; 8: e003647
21) Pedrizzetti G, Claus P, Kilner PJ, et al: Principles of cardiovascular magnetic resonance feature tracking and echocardiographic speckle tracking for informed clinical use. J Cardiovasc Magn Reson 2016; 18: 51–62
22) Kido T, Kido T, Nakamura M, et al: Assessment of left ventricular function and mass on free-breathing compressed sensing real-time cine imaging. Circ J 2017; 81: 1463–1468
23) Takakado M, Kido T, Ogawa R, et al: Free-breathing cardiovascular cine magnetic resonance imaging using compressed-sensing and retrospective motion correction: Accurate assessment of biventricular volume at 3T. Jpn J Radiol 2023; 41: 142–152