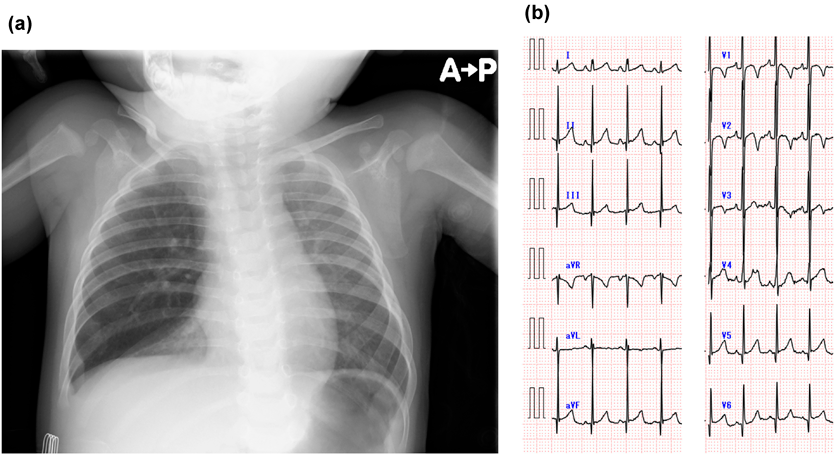
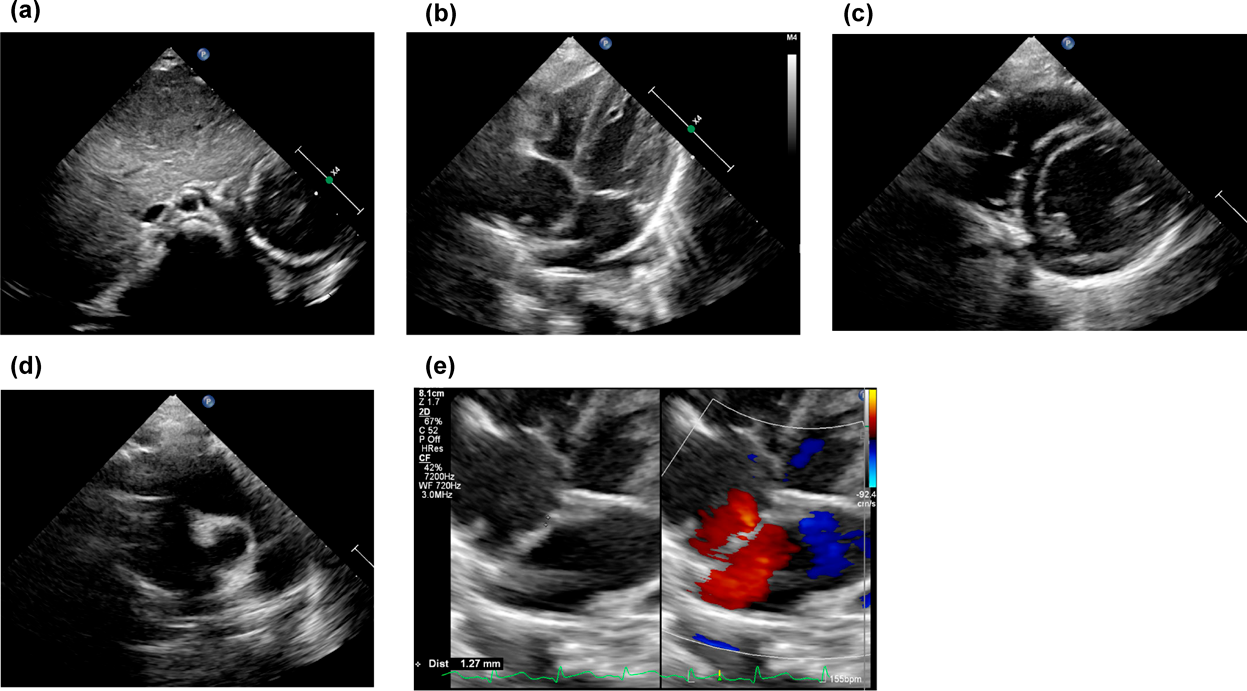
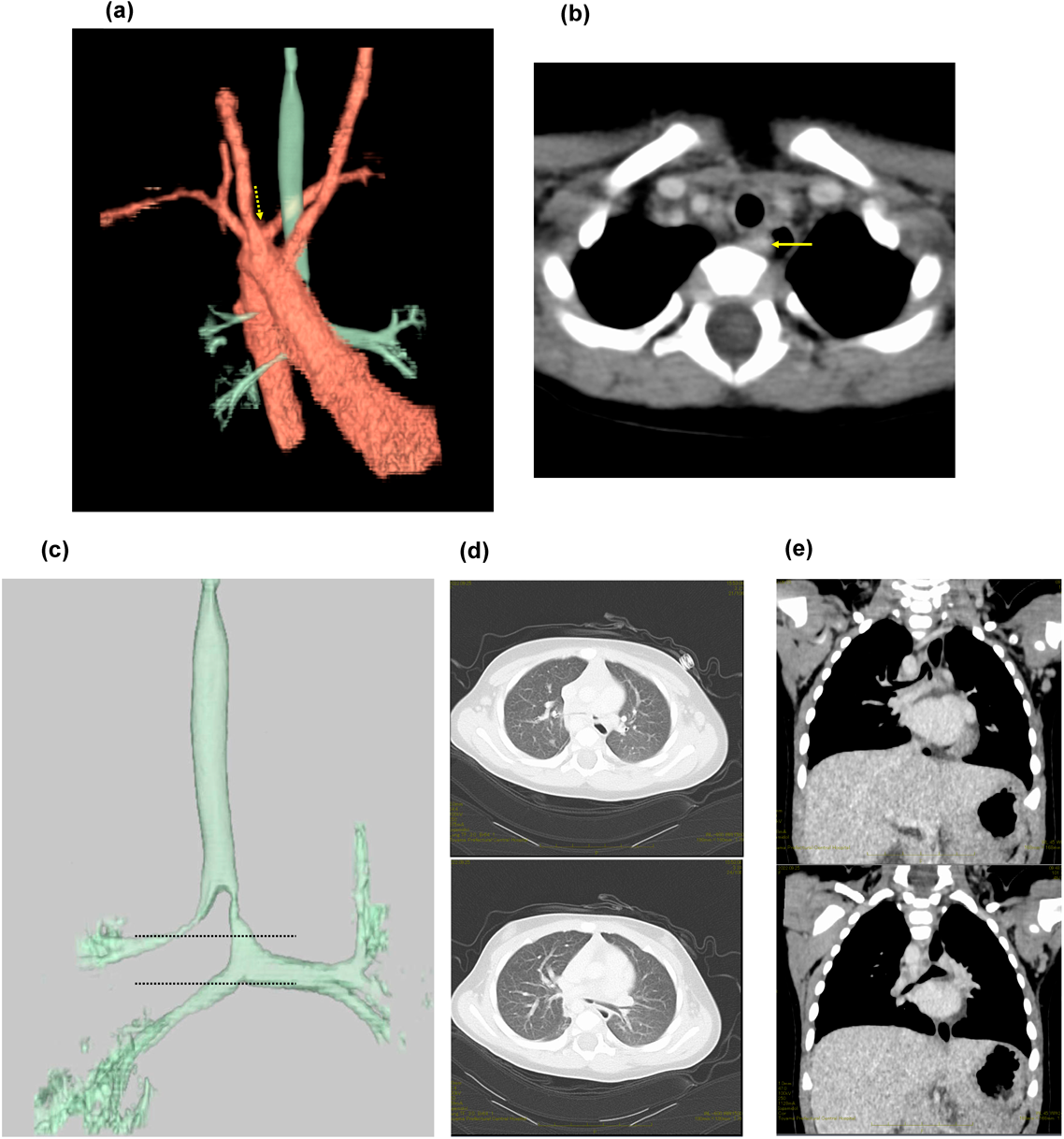
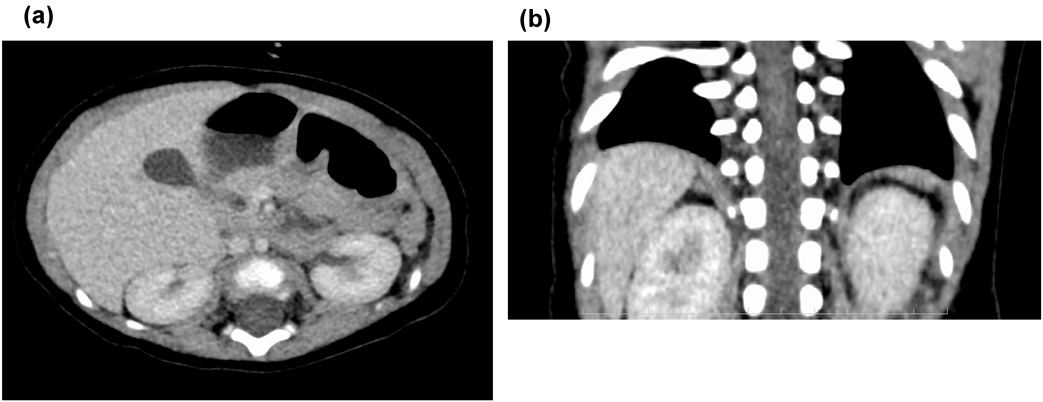
複雑な先天性心疾患を伴わない無脾症候群の7か月女児例A 7-Month-Old Girl with Asplenia without Complex Congenital Heart Disease
谷内 裕輔1,本多 真梨子1,竹田 義克1,作村 直人1,上野 和之1,宮下 健悟1,藤田 修平1,廣野 恵一2Yusuke Yachi1, Mariko Honda1, Yoshikatsu Takeda1, Naoto Sakumura1, Kazuyuki Ueno1, Kengo Miyashita1, Shuhei Fujita1, Keiichi Hirono2
1 富山県立中央病院 小児科Department of Pediatrics, Toyama Prefectural Central Hospital ◇ Toyama, Japan
2 富山大学医学部 小児科Department of Pediatrics Faculty of Medicine University of Toyama ◇ Toyama, Japan
受付日:2024年4月1日Received: April 1, 2024
受理日:2024年6月10日Accepted: June 10, 2024
発行日:2024年8月1日Published: August 1, 2024