病歴
症例は日齢0日の女児.児の母親は自然妊娠成立後,一絨毛膜三羊膜品胎(MT品胎)と診断され,前医で妊娠管理を行った.在胎28週の胎児心エコーで下心臓型TAPVCを疑われた.切迫早産に対する緊急帝王切開により,児は在胎32週5日,身長36.5 cm(−2.5SD, 0.7%tile),体重1,284 g(−2.0SD, 2.3%tile),頭囲28.7 cm(−0.6SD, 27.5%tile),胸囲23.7 cm,MT品胎の第2子として出生した.Apgarスコアは出生1分後,5分後ともに7点だった.出生後の心エコーで同診断とされ,加療目的に当院に緊急搬送された.
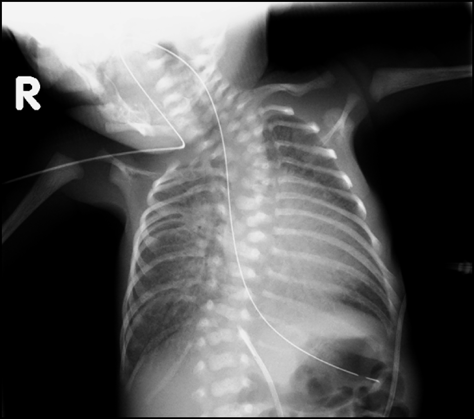
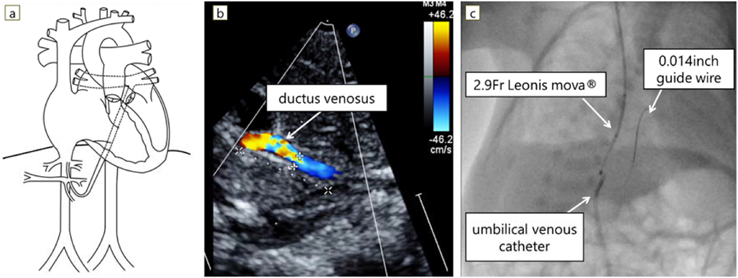
入院時,心拍数156回/分,血圧66/23 mmHg,呼吸回数46回/分で経皮的酸素飽和度86%(経鼻的持続陽圧呼吸療法PEEP 5 mmHg,FiO2 0.21),胸部聴診で肺雑音なし,心音整,心雑音は聴取しなかった.胸部X線で心胸郭比57%,両側肺血管陰影の増強を認めた(Fig. 1).血液検査で特記すべき異常なし.心臓超音波検査では右房,右室の拡大を認め,左室拡張末期径10.3 mm(正常期待値の76%),左室駆出率68%,心房中隔欠損4.9 mm,圧較差なく右左短絡,左右肺静脈が合流して共通肺静脈腔を形成し,共通肺静脈腔から垂直静脈が左門脈へ還流していた.垂直静脈(vertical vein: VV)は横隔膜を貫通する部位では狭窄なく,垂直静脈の左門脈合流部から静脈管(ductus venosus: DV)にかけてU字型に走行しており(Fig. 2a),同部位で狭窄があり,PVOを認めた(Fig. 2b).血流波形は連続性であり,最大流速1.6 m/s,平均圧較差7 mmHgであった.動脈管は両方向短絡だった.心外疾患として,椎体・右胸郭形成不全,右内反足・右膝拘縮,右腎低形成と診断された.遺伝染色体疾患の精査のため,術後に遺伝染色体科へのコンサルトを行い,染色体検査が行われたが正常核型であり,VACTERL連合と診断された.
当院循環器科,心臓血管外科,新生児科,麻酔科で協議し,早産児期の開心術は合併症のリスクが高く,PVOに対してカテーテル治療を先行し,待機的に修復術を行う方針とした.VVへのステント留置は適応外使用であるが,垂直静脈を含めた肺静脈へのステント留置術として事前に当院の倫理委員会で審査,承認を受けていた.ご両親へ治療方針を説明し同意を得た.
カテーテル治療① アプローチおよびバルーンによる前拡張
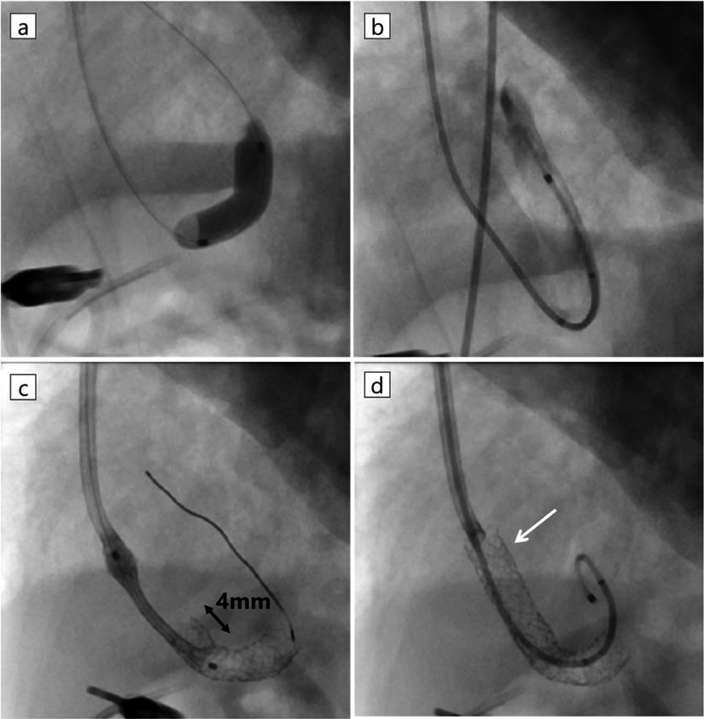
日齢4(修正33週2日,体重1,109 g),ミダゾラム,フェンタニル,ロクロニウムを用いた静脈麻酔薬による全身麻酔下で経皮的バルーン形成術,血管内ステント留置術を行った.肺出血の懸念があるためヘパリンは使用しなかった.臍静脈からアプロ—チした際,DV, IVCへカテーテルは挿入できるが,VVへの挿入は困難と考え,頸部からアプローチすることにした.右内頸静脈に6 Fr Merit Prelude IDealシース(Merit Medical, South Jordan, UT, USA)を留置し,4 Frマルチパーパスカテーテル(フォルテ グロウ メディカル株式会社,栃木,日本),先端転向型マイクロカテーテルである,2.9 Frレオニスムーバ®(SBカワスミ株式会社,神奈川,日本)を用いて,臍静脈カテーテルを目印にすることで0.014インチGTワイヤー®アングル(テルモ株式会社,東京,日本)をVVへ挿入できた(Fig. 2c).ガイドワイヤーの挿入が困難な場合は臍静脈カテーテルから血管造影し,臍静脈からスネアを挿入し内頸静脈から挿入したガイドワイヤーを把持して静脈管を通過させる予定であった.2.9 Frレオニスムーバ®はVVとDVがU字型に吻合している部位を通過しなかったため,1.9 Fr Carnelian® MARVEL(東海メディカルプロダクツ株式会社,愛知,日本)を使用することで,2.9 Frレオニスムーバを挿入できた.PVO解除前のカテーテル挿入,血管造影はPVO悪化による肺出血の懸念があったため,圧測定と血管造影は行わず直ちに経皮的バルーン形成術を行った.0.014インチBalance®ガイドワイヤー(Abbott, Pylmouth, MN, USA)を左肺静脈へ挿入後,血管拡張用バルーンTrek®(Abbott, Pylmouth, MN, USA)3 mm×15 mm, 4 mm×15 mmでVV,VVとDVの吻合部,DVの3か所をいずれも16気圧で前拡張した.血管拡張用バルーンSterling®(Boston Scientific, Marlborough, MA, USA)5 mm×20 mmを用い,10気圧で拡張した(Fig. 3a).VVで造影し,最狭窄部径4.7 mmと狭窄が残存していたため,ステント留置術の方針とした(Fig. 3b).
血管内ステント留置術
まずはじめに,U字型に屈曲した血管経路に対応するため,柔軟性の高い自己拡張型ステントWallstent®(Boston Scientific, Marlborough, MA, USA)6 mm×24 mmを選択した.しかし,狭窄部をデリバリーカテーテルが通過しなかったため,バルーン拡張型ステントの中でも比較的柔軟で細経であるExpress SD®(Boston Scientific, Marlborough, MA, USA)5 mm×19 mmへ変更した.6 Fr Bright-tip®ガイディングカテーテル(Cordis, Miami Lakes, FL, USA)を用い,狭窄部の通過を試みたが困難であった,そのため,NC Emerge®(Boston Scientific, Marlborough, MA, USA)5.0×15 mmを先進させ,狭窄部位を拡張しつつ,減圧と同時に同ガイディングカテーテルを追従させて狭窄部位を通過させて通過に成功した.Express SD®の遠位端がVV内,かつU字型の狭窄部分をカバーするように留置した.同規格のExpress SD® 5 mm×19 mmを先に留置したステントと4 mmオーバーラップする形でタンデムに留置した(Fig. 3c).近位側はDV全体を覆う必要があり,右房内へ突出する形態となった(Fig. 3d).2.9 Frレオニスムーバ®を用いて計測したVV内の平均圧は15 mmHgであった.手技を終了し,NICUへ挿管のまま帰室した.手技に伴う頭蓋内出血,気道出血はなかった.術後の心臓超音波検査ではステント内の血流は連続性血流だが,最大流速1.2 m/s,平均圧較差3 mmHgへ改善していた.
カテーテル治療②
PDAが左右短絡となったため,日齢7にイブプロフェンを投与し閉鎖.日齢11に抜管した.日齢25,心臓超音波検査でステント内血流が連続性パターン,平均圧較差が11 mmHgへ増大した.胸部X線で両肺野の透過性低下があり,ステント内狭窄に対して再介入する方針とした.
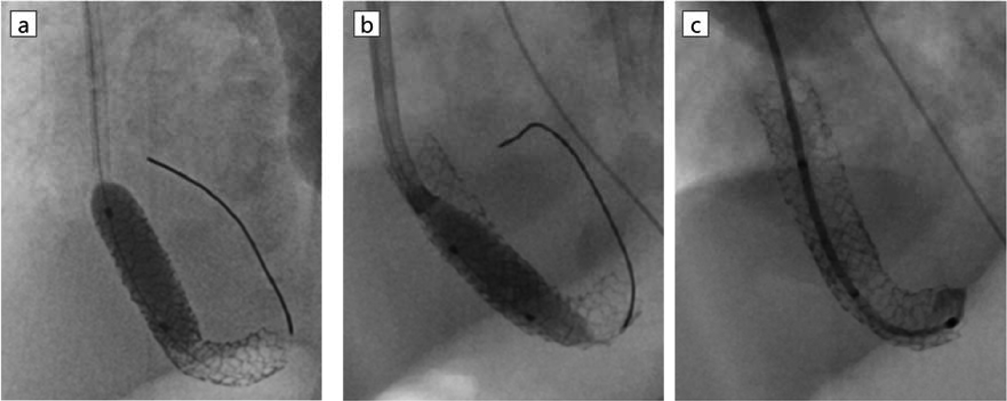
日齢29(修正36週6日,体重1,393 g),静脈麻酔薬による全身麻酔下でステント内再拡張を行った.右内頸静脈に5 Fr Merit Prelude IDealシースを留置し,2.9 Frレオニスムーバ®,0.016インチGTワイヤー®アングルを用いて2.9 Frレオニスムーバ®をVV内へ挿入した.計測したVV内の平均圧は30 mmHgであった.0.014インチFlexi wire(Abbott, Pylmouth, MN, USA)を挿入し,Sterling® 6 mm×20 mmで狭窄部位を10気圧で拡張した(Fig. 4a).VV内の平均圧は18 mmHgへ低下した.手技を終了し,NICUへ挿管のまま帰室した.手技に伴う頭蓋内出血,気道出血はなかった.術後の心臓超音波検査でステント内血流は連続性,最大流速1.4 m/s,平均圧較差6 mmHgであった.
カテーテル治療③
治療②ではステント全体への高圧拡張が行えず,術後計測したVV圧が高いためステント内狭窄が残存していると考え予定的に2度目の再拡張を施行し,狭窄が十分に解除できなければ心内修復術を行う方針とした.
日齢38(修正38週1日,体重1,514 g),右内頸静脈に6 Fr Prelude idealシースを留置し,6 Fr Bright-tip®ガイディングカテーテルで狭窄部位を通過させ,NC Emerge® 6 mm×12 mmを用いて20気圧で拡張した(Fig. 4b, c).VV内の平均圧は16から10 mmHgへ低下した.十分な拡張が得られたと判断し手技を終了した.手技に伴う頭蓋内出血,気道出血はなかった.術後の心臓超音波検査でステント内血流は最大流速1.8 m/s,平均圧較差10 mmHgであった.
TAPVC修復術
日齢57(修正40週6日,体重1,849 g),TAPVC修復術を行った.開胸直後に肺高血圧発作を起こしたため一酸化窒素による吸入療法を行った.心停止下で右房切開し,右房内に突出したステントを肝静脈と静脈管の合流部まで除去,VVを同定し結紮した.左房と切開した共通肺静脈腔周囲の背側心膜と左心房壁を7-0 polypropylene糸で連続縫合した.心房中隔欠損孔,右房を閉鎖後,人工心肺から離脱.胸骨閉鎖し手術を終了した.人工心肺使用時間は177分,大動脈遮断時間は79分であった.
術後経過
肺高血圧発作の回避のため,筋弛緩薬を用いて深鎮静で管理した.術後2日目に筋弛緩薬を中止した.術後5日目に一時的な乳び胸を認めたが,術後8日目に人工呼吸器から離脱した.術後15日目に酸素投与を終了,自律哺乳で体重増加が得られ,術後46日目(日齢103,修正47週3日,体重2,505 g)に自宅退院した.心エコーでは術直後から退院1か月後の再診時まで,共通肺静脈腔から左心房への十分な吻合口があり,分枝の狭窄や肺高血圧所見なく経過している.
早産児に対する開心術のリスク
早産児は正期産児と比較しCHDの合併が多く,正期産児では1,000出生あたり5.1人だが,早産児では12.5人でCHDを合併する1).手術時体重が2.5 kg未満の群は2.5 kg以上の群と比較し,早期死亡率が高かった(10.9% vs 4.8%).さらに,多変量解析の結果,早産が早期死亡のリスク因子であった2).また,手術時体重が2.5 kg以下では一期的根治術と姑息術のいずれでも死亡率が増加した3).
早産児において,人工心肺を使用した開心術は頭蓋内出血をはじめとする合併症の可能性があるため,当院では修正35週以降を適応としている.当院で修正37週未満に人工心肺を使用した開心術を行った症例を示す(Table 1).14例中9例が死亡し,術後30日以内の早期死亡は6例であった.手術時修正週数が35週以下の7例中,2例で頭蓋内出血を合併し,特に症例1では重篤な神経学的後遺症を残した.てんかん,乳児スパズムを発症した症例が1例ずつあった.修正36週台では頭蓋内出血を合併した症例はなく,1例でPVLを合併した.早産児に対する開心術は死亡率高く,合併症のリスクも高いため,本症例のように可能な限り待機し患児の成熟を促すのが好ましいと考えられた.
Table 1 Clinical course of premature neonates with the use of cardiopulmonary bypass| Case | Sex | Diagnosis | Operation | Gestational age | Birth weight (g) | Age at operation (day) | Corrected age at operation | IVH | Neurological disease | Others | Prognosis |
|---|
| 1 | F | TGA | Norwood | 31w4d | 1566 | 5 | 32w2d | + | epilepsy | Hydrocephalus | Survival |
| 2 | M | PA/IVS | Valvectomy | 34w1d | 2193 | 1 | 34w2d | − | — | Autism | Survival |
| 3 | F | HLHS | bPAB | 33w0d | 1351 | 11 | 34w4d | + | — | — | Death POD13 |
| 4 | F | HLHS | Norwood | 34w2d | 1400 | 2 | 34w4d | − | — | — | Death POD7 |
| 5 | F | CoA | EAA | 35w1d | 1332 | 2 | 35w3d | − | — | — | Death POD47 |
| 6 | M | TAPVC | ICR | 33w0d | 1176 | 18 | 35w4d | − | Infantile spasm | Hypoxic encephalopathy | Survival |
| 7 | F | AR | AVP | 35w4d | 2448 | 1 | 35w5d | − | — | — | Death POD10 |
| 8 | M | Ebstein | Starnes | 35w4d | 1666 | 4 | 36w1d | − | PVL | — | Death POD3 |
| 9 | M | AS | bPAB | 36w2d | 2172 | 0 | 36w2d | − | — | Tracheostomy | Death 2y2m |
| 10 | F | HLHS | bPAB | 36w3d | 2142 | 0 | 36w3d | − | — | — | Death POD1 |
| 11 | F | HLHS | bPAB | 36w4d | 2411 | 0 | 36w4d | − | — | — | Death POD5 |
| 12 | F | HLHS | bPAB | 36w5d | 2254 | 0 | 36w5d | − | — | Tracheostomy | Death 1y0m |
| 13 | F | TAPVC | ICR | 36w3d | 2288 | 2 | 36w5d | − | — | — | Survival |
| 14 | F | TAC | ICR | 36w0d | 2502 | 6 | 36w6d | − | — | — | Survival |
| AR, Aortic valve regurgitation; AS, aortic valve stenosis; AVP, Aortic valvuloplasty; bPAB, Bilateral pulmonary artery banding; CoA, Coarctation of Aorta; EAA, end-to-end aortic arch anastomosis; HLHS, Hypoplastic left heart syndrome; ICR, intra cardiac repair; IVH, Intraventricular hemorrhage; POD, post operative day; PVL, periventricular leukomalacia; TAC, truncus arteriosus; TAPVC, Total anomalous pulmonary venous connection; TGA, Transposition of Great Arteries |
シースの選択
3回のカテーテル治療のいずれでもMerit Prelude IDealシースを用いた.シースの厚みが薄いため,同規格のシースと比較し内径が大きく,外径が小さい.そのため,血管に対する侵襲を抑え,かつバルーンやステントの選択肢を広げることができる.早産,低出生体重児のカテーテル治療にあたってはより安全かつ有用と考えられる.
アプローチの選択
これまでに報告されている下心臓型TAPVCに合併したPVOへの先行カテーテル治療では,臍静脈6),右内頸静脈7),肝臓8)が選択されていた.
経臍静脈を選択した症例は狭窄部が静脈管のみであり,本症例のように左門脈から静脈管にかけての狭窄ではなかった.さらに,出生後間もなく診断され,臍静脈が閉鎖してなかった.診断まで時間を要し,臍静脈が閉鎖していた症例では他部位のアプローチを選択していた.狭窄が静脈管のみ,かつ臍静脈の確保が可能な症例では臍静脈アプローチは可能である.
右内頸静脈からのアプローチでは,静脈管への角度が直線的になるため,カテーテルを挿入しやすい.しかし,静脈管が高度に狭窄している場合はガイドワイヤーの挿入に難渋することが予想される.本症例では,入院後に臍静脈カテーテルを確保し,初回カテーテル治療時にメルクマールとした.ガイドワイヤーの挿入が困難な場合は臍静脈カテーテルから血管造影し,臍静脈からスネアを挿入し内頸静脈から挿入したガイドワイヤーを把持して静脈管を通過させる予定であった.
経肝臓アプローチは経臍静脈や経内頚静脈のいずれも難しい場合に選択された.
ステントの選択と拡張径の選択,再拡張のタイミング
本症例では左門脈から静脈管にかけて狭窄しており,血管はU字型に走行していた.そのため,柔軟性を優先し自己拡張型ステントであるWallstent 6 mm×24 mmの留置を試みたが,狭窄部を通過しなかったためバルーン拡張型ステントのExpress SD 5 mm×19 mmを留置した.冠動脈に関して,自己拡張型ステントはバルーン拡張型ステントに比べて再狭窄率が高い9)とされるが,本症例のような屈曲した静脈に関しては不明であxる.冠動脈用薬剤溶出性ステントは内膜増生を抑制することでステント内狭窄を生じにくくする可能性がある.しかし,本症例では最大拡張できる径が4~5 mm程度に限られるため同ステントは選択しなかった.
ステント径は,術前の心臓超音波検査でVVの最大径が6.1 mmのため,5 mm径を選択し,最終的に6 mm径のバルーンで再拡張した.5 mm未満のステントでは圧着が不十分になりmigrationする可能性があり,またステント内狭窄を生じやすくなる可能性があり,アプローチが許す限り大きい径を確保する方針とした.下心臓型TAPVCの早産低出生体重児へのカテーテル治療の既報をTable 2に示す.ステント内狭窄は必発であり,2~3週間ごとの再拡張を想定していた.また,内膜肥厚や屈曲による絶対的な狭小化だけでなく,適切にステントが留置されることにより肺血管抵抗は低下し,病変部における過大な血流量による相対的な狭窄や,高肺血流低心拍出性心不全の進行が予測される.ステント径を大きくすることで再介入までの期間を長くできる可能性があるが,本症例では3回目のカテーテル治療時に十分な拡張が得られており,追加のカテーテル治療は内科的管理の限界と考えた.当院で早産児に対してTAPVC修復術を行ったのは6例あり,2例が極低出生体重児であった(Table 3).在胎27週,1,176 gで出生した1例が遠隔期に死亡し,残り5例は生存している.本症例より低体重である1,700 gで出生した症例が生存しているため修復術が可能であると判断した.
Table 2 Summary of previous reports of stenting for infracardiac total anomalous pulmonary venous connection| Case | Diagnosis | Gestational age | Birth weight (g) | Age at 1st intervention | Body weight at 1st intervention | Method of 1st intervention |
|---|
| 16) | 4 (1a+3) | 32w | 1700 | d2 | — | Stenting to DV 4*20 mm coronary stent |
| 26) | 3 | 30w | 1500 | d13 | — | Stenting to DV 3.5*13 mm coronary stent |
| 36) | 3 | — | 3200 | d2 | — | Stenting to DV 4*24 mm coronary stent |
| 47) | 3 | 38w | 1270 | d16 | — | Stenting to DV 4.5*9 mm coronary stent |
| 58) | 3 | 31w | — | 3w | 1775 g | Stenting to DV 4*16 mm renal artery stent |
| Case | Age at 2nd intervention | Method of 2nd intervention | Age at 3rd intervention | Method of 3rd intervention | Age atoperation | Body weight at operation | Prognosis |
|---|
| 16) | d16 | intravenous urokinase | — | — | 3w | — | Death 2m |
| 26) | — | — | — | — | 5w | — | Survival |
| 36) | — | — | — | — | d4 | — | Survival |
| 47) | 2m | Redilation 5 mm balloon | — | — | 3m | 2 kg | Survival |
| 58) | 5w | Redilation 6 mm balloon | 7w | re-stenting 6×12 mm renal artery stent | — | — | Death |
*Diagnosis is based on Darling’s classification.
DV, ductus venosus. |
Table 3 Clinical course of premature neonates with total anomalous pulmonary venous connection in our instuitution| Case | Sex | Diagnosis | Gestational age | Birth weight (g) | Age at operation | Corrected age at operation | Body weight at operaion (g) | IVH | Neurological disease | Others | Prognosis |
|---|
| 1 | M | 3 | 33w0d | 1176 | d18 | 35w4d | 1105 | − | Infantile spasm | Hypoxic encephalopathy | Survival |
| 2 | F | 1b | 27w6d | 1378 | 2m6d | 36w5d | 1340 | − | — | — | Death 1y3m |
| 3 | F | 1a | 33w4d | 1606 | 1m3d | 38w0d | 1700 | − | — | — | Survival |
| 4 | F | 3 | 36w3d | 2288 | d2 | 36w5d | 2288 | − | — | — | Survival |
| 5 | M | 4 (1b+2b) | 32w6d | 1505 | 3m3d | 45w2d | 2780 | − | — | — | Survival |
| 6 | M | 3 | 36w6d | 2744 | 1m6d | 41w5d | 3700 | − | — | — | Survival |
| *No cases of catheterization before TAPVC repair. *Diagnosis is based on Darling’s classification. |
このような治療計画を遂行する上で,過去の報告,治療経験や,新生児科,麻酔科,心臓血管外科,小児循環器科,および多職種チームにおける十分な協議が重要と思われた.