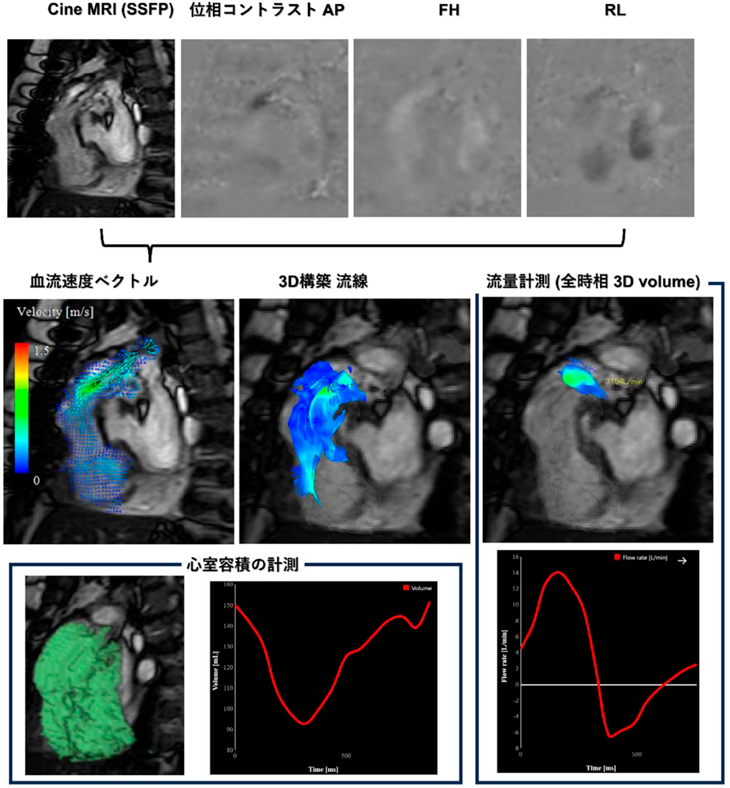
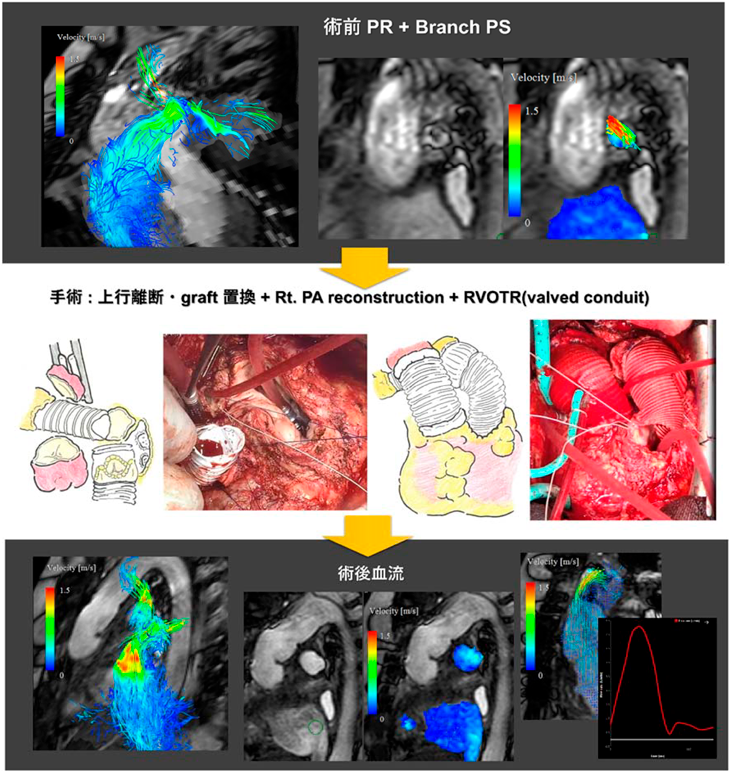
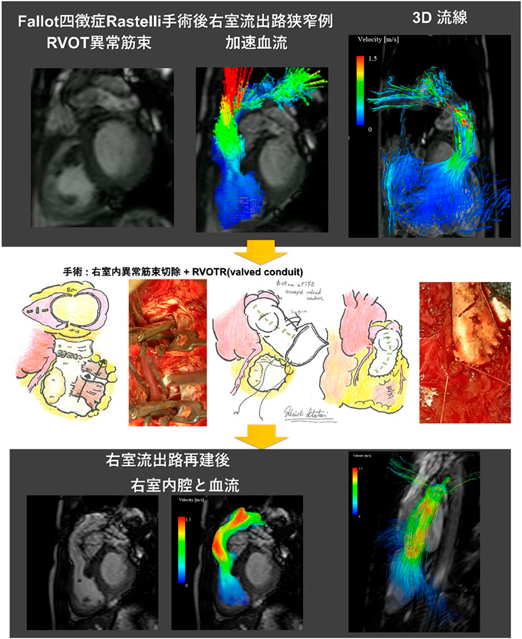
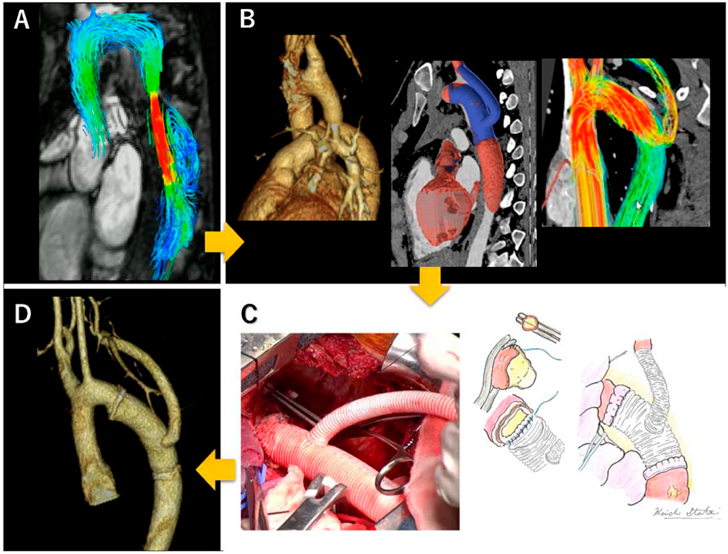
4D flow MRIと外科手術戦略Four-Dimensional Flow Magnetic Resonance Imaging (MRI), Surgical Design, and Treatment Strategy for Congenital Heart Disease
1 名古屋市立大学 心臓血管外科Department of Cardiovascular Surgery, Nagoya City University, Graduate School of Medical Sciences ◇ Aichi, Japan
2 株式会社Cardio Flow DesignCardio Flow Design Inc. ◇ Tokyo, Japan