小児の肺高血圧は,その病態の多様性故に成人のそれとは少し異なる視点を持つ必要がある.小児肺高血圧の病因で最多となる先天性心疾患の関与は,肺循環駆動圧や肺血流量の可変性をもたらす一方,胎生期から生後にかけての肺循環の大きな変化は,血管緊張度(トーヌス)低下により肺血管抵抗を劇的に低下させるため,解剖学的要因のみならず時間的要因の影響を受けることが小児肺高血圧の特徴とも言える.体循環と肺循環の相違をTable 1に示す.体循環は,それに連結する多数の臓器や骨格筋により構成される高い血管抵抗に抗うのに十分な駆動圧が必要となるのに対し,肺循環は,非常に低い肺血管抵抗と高い循環許容量(キャパシタンス)のため著しい低圧循環として挙動する.実際,運動時に循環血流量が5~6倍に増加しても肺動脈圧はほとんど変化しないことが知られている1).小児循環器診療ではこの体肺循環双方を把握することが基本となるが,肺循環は心室機能のみならず,年齢,先天性心疾患による肺血流多寡,外呼吸の状態による肺胞低酸素,肺血管閉塞性病変および肺血管床成長等の因子に修飾されるため,それらの因子がどのように肺高血圧に寄与しているかを適正に診断することが重要となる.
Table 1 体循環と肺循環の相違 | 体循環 | 肺循環 |
|---|
| 解剖学的特徴 | 血管壁・平滑筋層 厚い | 血管壁・平滑筋層 薄い |
| 多くの血管は組織の内部に存在 | 肺胞気圧の影響をうける |
| 筋組織内の血管が抵抗の主成分 | 吸気により血管径が拡大 |
| 血液量 | 全血液量の約90% | 全血液量の約10% |
| 心拍出量 | 4~5 L/分/m2 | 4~5 L/分/m2 |
| 血圧 | 高圧:平均圧90 mmHg | 低圧:平均圧8~15 mmHg |
| 還流圧:80~90 mmHg | 還流圧:10 mmHg |
| 血管抵抗 | 高:10~20 Wood unit・m−2 | 低:1.5~2.5 Wood unit・m−2 |
| 循環調節 | 自律神経による各臓器の血管収縮 | 低酸素による血管収縮 |
| レニン・アンギオテンシン系 | エンドセリンなど血管作動物質 |
| 低O2血症 | 血管拡張 | 血管収縮 |
| 高CO2血症 | 血管拡張 | 血管収縮 |
肺高血圧の病態診断を深めるために,心エコー図,心臓カテーテル検査,心臓MRI検査,CT検査等の画像および機能診断が行われる.しかし,これら様々な診断方法の進歩によってもなお,侵襲的右心カテーテル検査が肺循環評価の主軸であり,肺動脈圧と肺血流量の実測により間接的に肺血管の状態を知り,それらの各循環因子に基づいた治療方針を展開することが望まれる.本稿では,肺高血圧に関わる各循環因子の評価を実際どのように行い,臨床に還元してゆくかを解説したい.
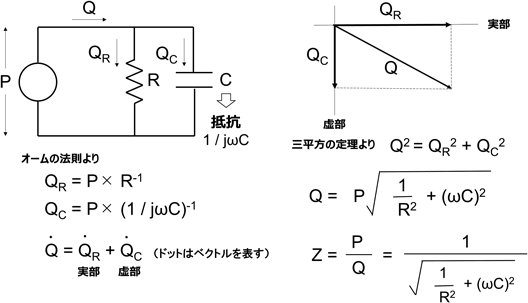
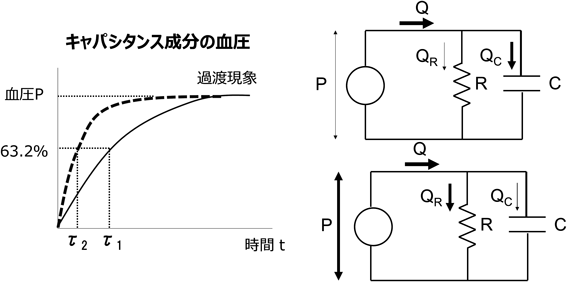
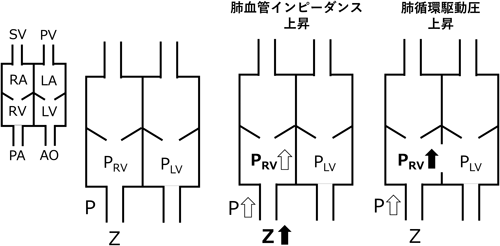
循環の基本3要素である肺動脈圧(肺循環駆動圧)(P),肺血流量(Q),肺血管抵抗(R)はOhmの法則に従い以下の平衡関係を維持する. 先天性心疾患による短絡や狭窄の存在はPを変化させ,Rが不変ならば,それに応じてQもまた変化する.各因子において,P(肺動脈平均圧として)<20 mmHg, Q≒4~5 L/分/m2,R<3 Wood unit・m2が正常範囲であると考えられる2).また定常流において,QはPoiseuilleの法則から以下のようにも表される. ここでrは血管径,ηは血液粘性,lは血管長を表す.式1と2より となり,血管抵抗は単純にその循環を担う血管径と長さに依存することになる.肺循環の抵抗成分を担う径200 µm以下の血管は生後10日前後で中膜平滑筋層が急速に弛緩し,以後生後3か月頃まで緩徐にこの反応は続く.従って生後2か月までは急速な肺動脈径の拡大がみられ,これは4歳頃まで続くとされる3).血管径が大きくなれば指数関数的にRは減少するため,胎生期から生後に生じる肺血管の成熟と血管径の増加はRを大きく低下させる.しかしながら,前述の通り肺循環は非常に高い循環許容量を持つため,肺血管キャパシタンス(C)の因子を看過できない.Cは一般的に以下の式で表される. ここでSV(stroke volume)は肺一回拍出量,PP(pulse pressure)は肺動脈の脈圧(収縮期圧と拡張期圧の差)を表す.Cの正常値は健常成人においては3.2±0.9 mL/mmHg/m2とされる4).小児の正常値に関しての報告はないが乳児心室中隔欠損における検討では2.7(2.2~3.3) mL/mmHg/m2であり,成人のそれよりも若干低値であると考えられる5).そこで肺循環を,脈圧を加味した交流RC並列回路と捉え,肺循環インピーダンス(Z)(交流回路の抵抗=拍動抵抗)を知る必要がある(Fig. 1).抵抗成分を流れる血流をQRとし,キャパシタンス成分を流れる血流をQCとしたならば,抵抗成分とキャパシタンス成分にかかるPは等しいため以下のようになる. ここでjは虚数,ωは振動角(=心周期)を表し,キャパシタンス成分にかかる抵抗は1/jωCとなる.Qは実部QRベクトルと虚部Qcベクトルの合成ベクトルとして示されるため三平方の定理より以下のようになる. したがってZはPをQで除した値であるので,以下のように表される. 式6からR上昇やC低下が循環抵抗を上昇させるためP上昇すなわち肺高血圧をもたらす.このように肺循環の真の循環抵抗を知るためにはRとCの両者を評価することが必要である.
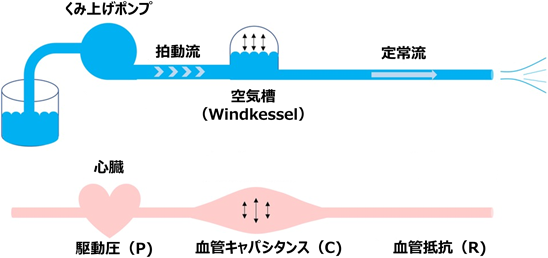
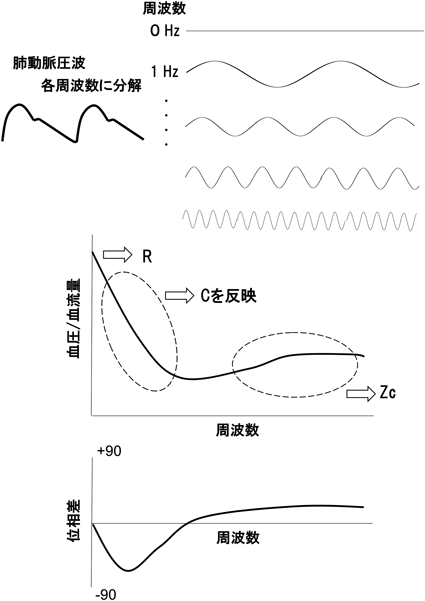
古典的Windkesselモデルは,動脈血管の進展性が第二のポンプとして作用するという概念のもとに,心臓から収縮期に供給されたエネルギーを血管壁の弾性エネルギーとして一時的に蓄え,拡張期にそれを放出することで拍動血流を緩衝させる血流成分を生み出すという循環モデルである6)(Fig. 2).本来,肺動脈圧波は無数の三角関数の合成波であると捉えることができるため,肺動脈圧波を各周波数の正余弦波に分解すると(Fourier変換),横軸にその波の周波数,縦軸にその周波数における血圧/血流量比(抵抗に相当)を取った場合に,周波数0では直線の肺動脈圧波,即ち肺動脈平均圧となり,これをQで除したものはRを表すこととなる.中間の周波数(具体的には振動角が負となる周波数)における血圧/血流量比はCを反映し,更に高い周波数における血圧/血流量比は固有インピーダンス(Zc)と呼ばれる(Fig. 3).このZcは反射波の影響を受けるため局所的血管形状の影響を受けやすくなり,このZcを加味したモデルは3因子Windkesselモデルとも呼ばれる7).
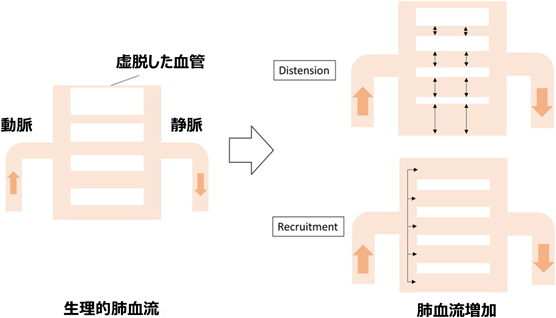
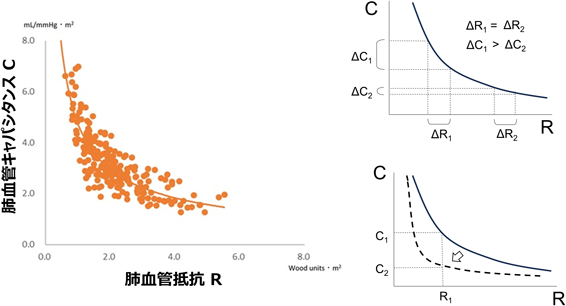
肺血管キャパシタンス(C)を表すいくつかの指標が知られている8)(Table 2).厳密には「コンプライアンス」は圧力変化に応じた血管径変化を表し,「キャパシタンス」は圧力変化に応じた血流量変化を表す.「コンプライアンス」と「キャパシタンス」のいずれも圧力に対する容積変化を反映するため,ほぼ同義としてよい.臨床において,Cは2つの要素,すなわち肺血管の伸展(distension)と再開通(recruitment)によって構成される9).血流の増加に応じて既存の血管が拡張する能力,つまり血管弾性の大きさがdistensionとなり,血管の組織学的変性がこのdistensionを消失させる一因となる.一方,平時には全ての肺血管床に血流が分布しているわけではなく一部の血管は虚脱しており,血流増加に応じてこの虚脱した血管へ血流が再分布することをrecruitmentと言い,血管床の豊かさを反映する10)(Fig. 4).Langlebenらは動物実験で肺血流量を増加させた場合,生理的血流量の範囲では主としてrecruitmentを介して血流増加に対応し,より高流量となった場合に漸増的なdistensionを生じることを明らかにした11).実際,主肺動脈や左右肺動脈近位部のdistensionはC全体の10~15%を占めるのみであり,Cの挙動は他の成分が担うことが知られている12).したがって,このrecruitmentは肺循環におけるC決定の主要な役割を担っていると考えられる.高いrecruitment効果を実現するためには十分な肺血管床が必要であり,肺血管床の発育不全や先天性心疾患に伴う(先天的あるいは外科的な)肺血管床喪失はCを大きく低下させる.
Table 2 肺血管キャパシタンスを反映する各種パラメータ| パラメータ | 単位 | 計算式 | 定義 |
|---|
| Compliance | mm2/mmHg | (maxA−minA)/PP | 圧力変化に応じた血管径変化 |
| Capacitance | mm3/mmHg | SV/PP | 圧力変化に応じた血液容量変化 |
| Pulsatility | % | [(maxA−minA)/minA]×100 | 心拍動中の血管径の相対的変化率 |
| Distensibility | %/mmHg | [(maxA−minA)/PP×minA]×100 | 圧力変化に応じた血管径の相対的変化率 |
| Elastic modulus | mmHg | PP×minA/(maxA−minA) | 圧変化により生じる血管径の相対的変化 |
| Stiffness index β | | Ln(sPAP/dPAP)/[(maxA−minA)/minA] | 圧量変化と血管径変化の回帰直線の傾き |
| A: 血管断面積,SV: 一回拍出量,PP: 脈圧,sPAP: 肺動脈収縮期圧,dPAP: 肺動脈拡張期圧 |
これまでの報告によると,様々な病態に起因する肺高血圧症においてC低下は予後不良因子の一つと考えられている.特発性肺動脈性肺高血圧症の成人および小児のいずれにおいてもC低値は独立した予後不良因子であり,Cは脳性ナトリウム利尿ペプチド値やNYHA機能分類と逆相関すると報告されている13–16).また先天性心疾患に関連した肺高血圧(CHD-PH)においても同様で,Chengらは,Eisenmenger症候群患者48人を含む111人の成人CHD-PH患者において,心拍数,R,C,6分間歩行試験結果の中でC低下は独立した予後不良因子であったと報告している17).このように様々な病態に起因する肺高血圧において,R高値よりもむしろC低値が予後不良を反映するため,肺循環評価においてCを評価することの重要性が高まると考えられる.
RとCは先述のように互いに独立した変数ではなく相互に影響し合う.このRC連関は反比例関係となるため,その積は一定となり,以下の関係となる. ここでτは時定数となる.これは以下のように説明される.時間tにおける肺血管キャパシタンスの成分にかかる血圧P(t)は以下のように示される(Fig. 5). つまり,t=τ=R×Cの時,キャパシタンス成分にかかる血圧が全体の1−e−1=63.2%となることを表すのでτが時定数とされる.肺高血圧のない健常者でのτ平均値は0.35secとされる18).例えば肺高血圧を合併した心室中隔欠損症患者の肺動脈圧波を観察すると,同じ肺動脈収縮期圧あってもその脈圧が大きい場合と小さい場合が観察され,結果として肺動脈平均圧が異なることがある.脈圧の大きいほど肺動脈圧が収縮期圧の63.2%に低下するまでに時間がかかることになるため,τが大きいことを反映する.このτは肺血管のキャパシタンス成分が飽和される過渡現象までの時間の目安となる19–21).したがって左右短絡があり肺血流が増加した場合,τが小さいとより早期にキャパシタンス成分は過渡現象に至り,血流はより抵抗成分へ流れていくこととなり(QR増加からQR×R=Pの増加を招き),結果として循環全体の駆動圧増加を生じる(Fig. 5).
実際に心臓カテーテル検査によって求めたRとCをプロットするとFig. 6のように反比例関係となる9, 22).このRC連関双曲線の形状を決定する因子であるτがキャパシタンス成分の過渡現象までの時間を反映し,肺血管床の特性を反映すると言える.従来,τは個体間で不変と考えられていたが,実際は年齢,心拍数や左房圧などによって変化することが知られており,加齢,心拍数増加,左房圧上昇によりτはやや低下する4, 21, 23–25).また双曲線の性質上,R値が高い場合はτが変化してもC値はほとんど変化しないものの,R値が正常に近い場合はτの変化によりC値が鋭敏に変化するため,実臨床においてはC値の変化に注視することがより鋭敏に肺血管の特性を観察できると考えられる22).しかしながら同一個体内ではτはほぼ一定のため,治療介入を加えた場合,RとCの値はこの曲線上を動くことになると考えられている26).
実際の臨床では,理学所見より呼吸状態の観察やII音肺動脈成分の亢進の程度と分裂幅を覚知し,心尖部や胸骨左縁下部での拡張期ランブルの存在を注意深く聴取することが最も重要であることは言うまでもないが,様々な画像および機能診断を併用することで病態への理解を更に深めてゆく必要がある.そもそも肺高血圧は肺循環駆動圧(P)上昇と肺循環インピーダンス(Z)上昇の二つの機序によって生じ(Fig. 7),それには以下の病態が交絡している.
先天性心疾患による左右短絡
三尖弁以後の短絡(心室中隔欠損など)による肺循環駆動圧(P)の上昇は式5の均衡を維持すべくQ増加をもたらす.つまり短絡の存在そのものがPすなわち肺動脈圧の規定因子となる(Fig. 7).しかしC値低下のためキャパシタンスが早期に過渡現象を迎えてしまうとキャパシタンス成分への血流QCは頭打ちとなり,より抵抗成分へ血流QRが増加してしまうため,短絡が生じる肺循環駆動圧(P)上昇以上に,P上昇が生じる可能性もある(QCは過渡期を迎えるとP上昇によっても変化しないため).一方,三尖弁以前の短絡(心房中隔欠損症など)は拡張期短絡となるために実質的に肺循環駆動圧(P)上昇は生じずにQのみ増加する.この場合,キャパシタンス成分が過渡現象に至らなければ,式5においてQC成分が増加するのみで,QR成分の増加は生じない.そのためPは一定に維持される.つまりCが正常範囲であれば血流量増加は相殺され肺高血圧は生じない(Fig. 5).しかしながら三尖弁以前の短絡と言えどもQC低下に際しては早期にキャパシタンス成分の血流QCが過渡現象となり,抵抗成分へ血流QRが増加し,結果としてP上昇を招くこととなる.実際,重症肺高血圧合併心房中隔欠損症の乳児において,R上昇よりもC低値を伴っている場合の方が予後不良であった27).いずれも短絡を外科的に修復することでPやQを是正することができるが,すでにZ上昇(R上昇やC低下)が生じていた場合は正常Qとした場合もP上昇が生じることとなる.そのため術前にR上昇のみならず,C低下に焦点を当てることで術後肺高血圧の検出が可能となる5)(Table 3).
Table 3 肺高血圧を合併した心室中隔欠損3例の修復術前後における肺血行動態の比較 | 症例1
生後1か月 | 症例2
生後3か月 | 症例3
生後2か月 |
|---|
| 術前 | | | |
| 肺体血流比 | 3.27 | 2.57 | 2.47 |
| 肺動脈圧,mmHg | 69/30(47) | 68/32(49) | 75/26(49) |
| 肺体血圧比 | 0.78 | 0.86 | 0.80 |
| R, WU m2 | 3.09 | 3.94 | 2.45 |
| C, mL/mmHg m2 | 2.07 | 1.97 | 1.82 |
| τ, sec | 0.38 | 0.46 | 0.27 |
| 術後 | | | |
| 肺動脈圧,mmHg | 23/7(12) | 28/10(17) | 40/12(24) |
| 肺体血圧比 | 0.21 | 0.27 | 0.33 |
| R, WU m2 | 1.96 | 3.08 | 3.15 |
| C, mL/mmHg m2 | 2.41 | 1.85 | 1.68 |
| τ, sec | 0.28 | 0.34 | 0.31 |
| R: 肺血管抵抗係数,C: 肺血管キャパシタンス,τ: 時定数,肺動脈圧は収縮期圧/拡張期圧(平均圧)を示す.3症例とも術前ほぼ同じ肺動脈平均圧を呈した心室中隔欠損症の症例の肺血行動態指標を示す.症例1は最も典型的な症例で,術前R値とC値はほぼ正常範囲に留まり(生後1か月のためR値が若干高値だが),修復術後の肺動脈圧は正常に回復する.症例2は術前R値が軽度上昇しているが,R値に対するC値はそれほど低値ではないためτは維持される.このような症例では術後の肺動脈圧は正常に回復する.症例3では術前R値は正常範囲であるが,R値に対するC値が低値であるためτが低下している.このような症例では術後肺動脈圧上昇が遷延する. |
左室狭窄病変あるいは左室拡張不全
左心狭窄病変あるいは左室不全は肺毛細血管相後肺高血圧(post-capillary pulmonary hypertension)とされ,肺静脈圧あるいは左房圧上昇の分だけ肺動脈圧上昇が生じてPが上昇する.しかし左房圧上昇は先述のように時定数τを低下させるため,式8に見られる変時的血管キャパシタンスの低下を招きPは上昇する.故に単純な左房圧あるいは肺静脈圧上昇によるP上昇の成分と二次的に生じた肺血管病変によって生じた肺循環インピーダンスの上昇によるP上昇の成分の関与を鑑別する必要がある.つまりR値は正常であってもC値低下の有無を見極めることでτの変化を推察できる.
肺胞低酸素
酸素は肺血管トーヌスを決定する重要な要素である.小児肺高血圧においては先天的な気道の解剖学的要因を合併していることが多く,例えば上気道の脆弱性や,先天性心疾患による心血管の圧迫および肺疾患等がこの病態にあたる.慢性閉塞性肺疾患の患者においてC値低下は右心不全の前兆とされ,肺胞低酸素によって生じるC値低下は重症度を反映すると報告される28).これらは低酸素による肺血管攣縮そのものや肺血管硬度上昇がR上昇やC低下を引き起こすと推察されている28).酸素治療や呼吸補助療法が奏功することが多いため,まず肺胞低酸素状態を是正後にP変化やRC連関をみてゆくことが妥当であろう.
肺血管閉塞性病変
肺動脈は内膜,中膜,外膜の三層構造からなるが,肺動脈圧上昇を伴う肺血流増加が加わった場合,つまりradial forceとshear stressの両者が増加した場合,病初期は圧上昇に対する中膜平滑筋層肥厚が生じるものの,その作用が長期にわたると平滑筋細胞の形質転換を生じ増殖反応へ向かう.そして一部内膜へ遊走した細胞が内膜増殖性変化を生じさせ,閉塞性肺動脈病変となり不可逆性となる.肺動脈内腔径減少は急激なR上昇とC低下を伴うため,Zは著しく上昇する(式6より).肺生検を実施したCHD-PH患者27例の先行研究では,何らかの肺血管病変を合併した症例では有意にC値が低値であり,C<1.22 mL/mHg/m2であると感度94%,特異度64%で肺血管病変の存在を予測できた29).また,これまでCHD-PHの関連した肺血管拡張薬の効果を検討する数多くの研究がなされてきたが,P低下やR低下をアウトカムとする研究が多く,いずれも期待される結果が示せていない30–33).先述の通りC低下は鋭敏な予後不良因子と示されているため,今後はC改善をアウトカムとした研究が望まれる.特に肺血管拡張薬の適正使用において,臨床症状の改善はもちろんのこと,客観的指標としてC上昇を目標とした治療も期待されるのではないだろうか.
肺血管床低形成
肺の発生は腺様期(妊娠5~15週)から管状期(妊娠16~26週),終末嚢期(妊娠27~38週)を経て肺胞期(妊娠24~38週)となり完成されるが,肺血管の発生は,鰓弓動脈より発生した肺動脈主幹部が肺と連続し,静脈叢が左房と連続する妊娠34日目頃より肺内の間葉系毛細血管叢が形成されてゆくことで始まる34).主肺動脈から分岐後15~17回の分岐を繰り返しながら約30 mm径の肺門部肺動脈から1.5~2.5 mm径の肺小動脈となり,10~15 µm径の肺胞毛細血管相へ移行してゆくが35),生後から成人期に至るまでに,肺胞面積は20倍,毛細血管叢は35倍に拡大するとされる34).肺血管床の60~70%が失われるまで肺動脈圧は上昇しないが36),左右短絡の存在は肺動脈圧の上昇を助長すると予想される.Aggarwalらは肺血管床低形成を伴う横隔膜ヘルニアの患者においてCが予後を予測するのに有用であると報告しており37),肺血管床自体の低形成がCに影響することが示唆され,この病態においてもCを評価することの重要性が高まる.しかしながら実際は,肺血管床低形成は肺血管閉塞性病変との鑑別が難しく,造影CTやMRI検査などの画像診断を駆使して血管数や容積を計測することが一助となるだろう.MRIによる評価では正常肺血管容積は50~60 mL/m2と報告されている38).
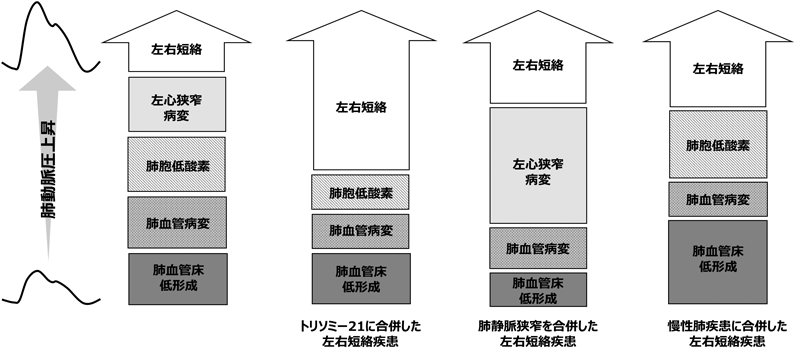
実際の臨床では,これら5つの病態がどの程度その肺高血圧へ寄与しているかが問題となる(Fig. 8).いくつかの具体的な事例を考えてみたい.トリソミー21に合併した左右短絡先天性心疾患(三尖弁以降の短絡)の場合,短絡による駆動圧Pの上昇があるのは確かであるが,肺血管閉塞病変,肺胞低換気,肺血管低形成のいずれの病態もP上昇に関与している可能性がある.そのため酸素負荷試験などで肺胞低換気の病態を除去し,さらにRC連関を見る必要があり,τ低下があれば血管閉塞性病変の進行が背景にある可能性がある.一酸化窒素吸入などをして更なる変化をみるのもよいだろう.実際,トリソミー21患者においては,R上昇よりもC低下がより術後の肺高血圧を反映する39, 40).次に,単心室,肺動脈狭窄,総肺静脈還流異常を合併した症例を考えてみたい.垂直静脈狭窄合併例では肺静脈圧が上昇し,組織学的肺動脈病変の混在も危惧されるが,RとCの両者を評価することで肺循環の状態が見えてくる.Table 4に単心室・肺動脈狭窄・総肺静脈還流異常の2例における心臓カテーテル検査を示す.症例4のように,R値が上昇していたとしてもτ低下がなければ,術後の肺動脈圧は低下する.しかし症例5のように,R値が低値であってもτ低下を生じている場合は予期せぬ経過を辿ることもあるため注意が必要である.最後に慢性肺疾患に合併した左右短絡先天性心疾患を考えた場合,慢性肺疾患は肺血管床低形成のため著しいC低下を合併している(Table 5).この状態において先天性心疾患による駆動圧P上昇や肺血管閉塞性病変による更なるC低下を合併するが,C低下が複合的に生じているため全体の病像を把握しにくい.酸素投与による肺胞低酸素の要素を改善後にRC連関をつぶさに観察する必要がある.実際,肺疾患合併がなくとも早期産児では正期産児よりもC値が低値であることから25),肺血管床の成熟は肺循環において重要な役割を担うと考えられる.このように,各病態因子を修飾しつつPの変化やRC連関を確認することが肺高血圧の適正診断の一助となるであろう.
Table 4 単心室・肺動脈狭窄・総肺静脈還流異常の2例(症例4: 垂直静脈狭窄あり,症例5: 垂直静脈狭窄なし)における肺血行動態の比較 | 症例4
生後11日 | 症例4
生後4か月 | 症例5
生後1か月 |
|---|
| 肺動脈圧,mmHg | 43/25(32) | 18/6(10) | 31/7(18) |
| 肺静脈圧,mmHg | 15 | 4 | 6 |
| 肺体血圧比 | 0.71 | 0.20 | 0.40 |
| R, WU m2 | 4.08 | 0.98 | 1.36 |
| C, mL/mmHg m2 | 1.65 | 6.91 | 2.57 |
| τ, sec | 0.40 | 0.40 | 0.20 |
| R: 肺血管抵抗係数,C: 肺血管キャパシタンス,τ: 時定数,肺動脈圧は収縮期圧/拡張期圧(平均圧)を示す.症例4は垂直静脈狭窄に対してステント留置後,生後3か月で肺静脈修復を行った.生後11日の肺血管動態評価ではR上昇がみられるもののτは維持されており,肺血管自体に障害がないことが予想された.実際,肺静脈修復術後は許容される肺循環状態となった.その後Glenn術を実施し経過は良好である.症例5は肺循環垂直静脈狭窄の合併はなかったもののτが比較的低値であった.この後Glenn術を行ったものの循環不全があり経過中死亡した. |
Table 5 慢性肺疾患に関連した肺高血圧の2症例 | 症例1
慢性肺疾患 PDA | 症例2
慢性肺疾患 CHDなし |
|---|
| 介入前 | 生後7か月 | 生後7か月 |
| 肺体血流比 | 1.05 | - |
| 肺動脈圧,mmHg | 70/35(49) | 60/27(42) |
| 肺体血圧比 | 0.94 | 0.66 |
| R, WU m2 | 11.46 | 12.94 |
| C, mL/mmHg m2 | 0.90 | 0.44 |
| τ, sec | 0.61 | 0.34 |
| 介入後 | 生後21か月 | 生後12か月 |
| 肺動脈圧,mmHg | 41/15(25) | 46/22(33) |
| 肺体血圧比 | 0.36 | 0.40 |
| R, WU m2 | 3.63 | 6.34 |
| C, mL/mmHg m2 | 1.47 | 1.35 |
| τ, sec | 0.32 | 0.51 |
| R: 肺血管抵抗係数,C: 肺血管キャパシタンス,τ: 時定数,PDA: 動脈管開存症,CHD: 先天性心疾患,肺動脈圧は収縮期圧/拡張期圧(平均圧)を示す.慢性肺疾患の例ではRの上昇とともにCが著しく低値となっている.症例1は早期産(32週)および超低出生体重児(998 g)でPDA(径2.4 mm)を合併例.R上昇とC低下があるがτは比較的高いため回復が見込めるとし,経皮的動脈管閉鎖術後に肺血管拡張薬の投与による治療を行った.治療後14か月には軽度肺高血圧が残るものの許容される血行動態となった.症例2は早期産(在胎24週)および超低出生体重児(826 g)で重症肺高血圧合併例(CHD合併なし).τは比較的維持されていたので,在宅酸素治療に加え肺血管拡張薬導入を行った.治療によりRは約50%減少し,Cは約200%増加しており,τの改善がみられた.Cは治療効果をより鋭敏に反映する可能性が示唆された. |
高い循環許容量を有する肺循環では肺血管抵抗(R)と肺血管キャパシタンス(C)の両者を評価して,合成抵抗として肺循環インピーダンス(Z)を考えることが重要である.小児の肺高血圧の特徴は,短絡の存在による肺駆動圧(P)上昇と肺血管特性変化によるZ値上昇に集約される.また,RとCは反比例関係にあり,その積である時定数τは肺血管特性を反映するが,Rが正常に近い場合はτの変化はよりCの変化として現れやすいため,実臨床においてはCの変化に注目する必要があり,C低下はP上昇を招きやすい.適正な肺高血圧の評価のためには,実際の右心カテーテル検査より得られた肺動脈圧と肺血流量からRとCの両者を算出して吟味することが勧められる.