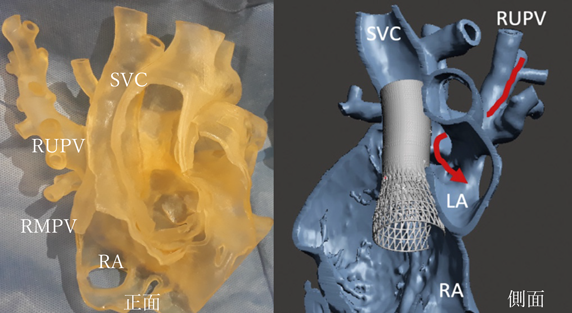
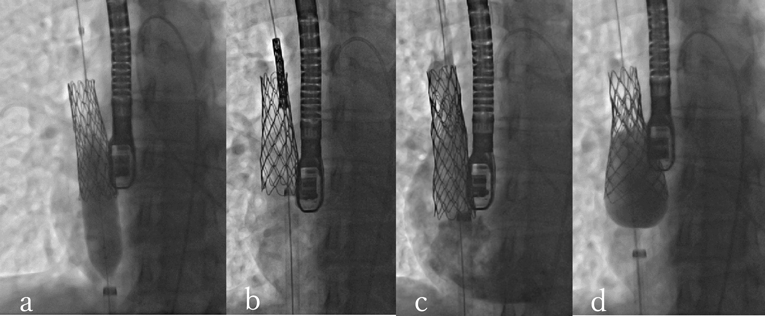
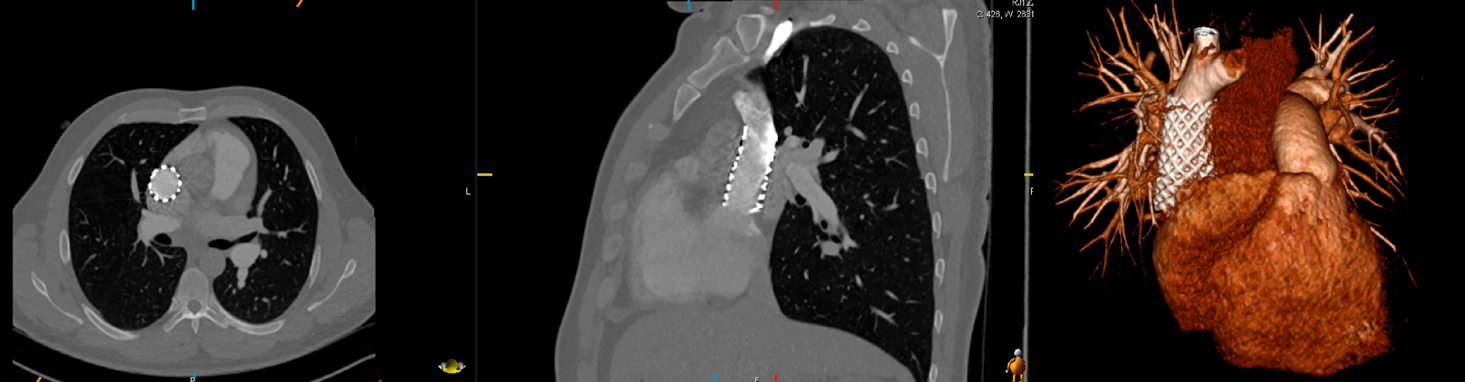
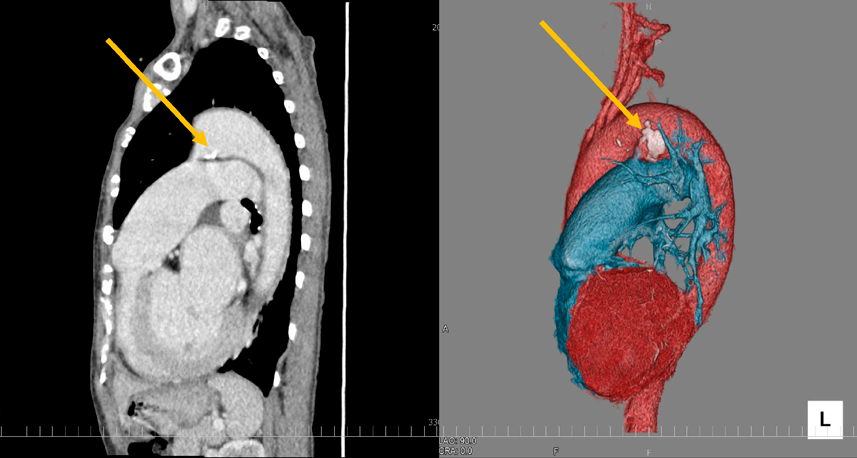
ACHDのカテーテル治療:現在まで,そして未来へCatheter Intervention for Adult Congenital Heart Disease: Present and Toward the Future
1 東京女子医科大学 循環器内科Department of Cardiology, Tokyo Women’s Medical University ◇ Tokyo, Japan
2 東京女子医科大学 循環器小児科・成人先天性心疾患科Department of Pediatric Cardiology and Adult Congenital Cardiology, Tokyo Women’s Medical University ◇ Tokyo, Japan