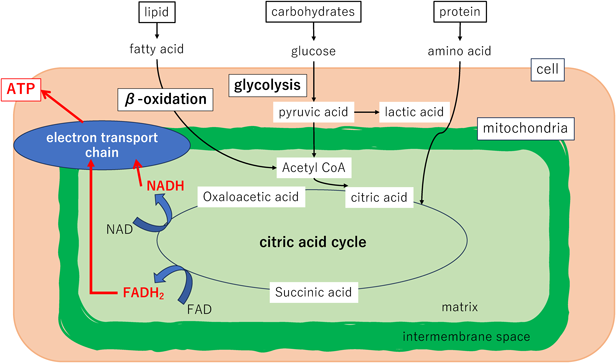
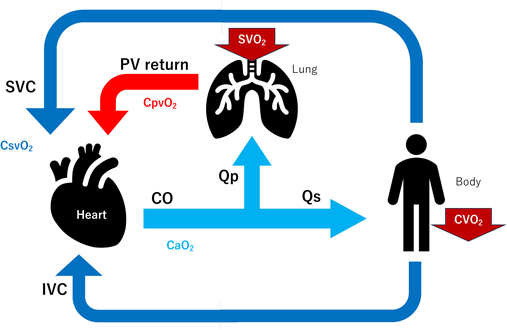
細胞内代謝(組織細胞内での酸素の利用oxygen use)(Fig. 1)
生命活動のエネルギー源は,アデノシン三リン酸(adenosine triphosphate: ATP)であり,解糖系からTCA回路・電子伝達系への流れで,1分子のブドウ糖(C6H12O6)から,36分子のATPを合成する.特にミトコンドリア(mitochondria: Mt)内でのH+の酸化過程でATPが産生される(酸化的リン酸化). との反応がMtで生じるが,ここに酸素が欠かせない.このATPがアデノシン二リン酸(adenosine diphosphate: ADP)へ変換される際に,約7 kcal(≒29300 J)のエネルギーを産生する5).
心筋細胞には筋原繊維の束が無数に存在し,基本単位である筋節(sarcomere)の中にアクチンとミオシンの2種類のフィラメントがある.両者はクロスブリッジで結ばれ,それが動くことで心収縮が生じる.ミオシン頭部を動かすのに,ATPが必要で,1回のクロスブリッジサイクルに1分子のATPが消費される.心筋は絶え間なく収縮と弛緩を繰り返しているため,膨大なATPが必要となる.また心筋必要エネルギーの60~70%の栄養素を脂肪酸のβ酸化に依存し6),その過程でカルニチンが必要であり,遊離カルニチン20 µmol/L未満は補充が必要である.不全心ではより必要エネルギーが増えるため,心筋細胞への酸素供給・栄養補給に関する意識が欠かせない.
循環管理の目的は,酸素を供給し,膨大なATPを産生し続けることと言い換えられる.
酸素解離曲線(oxygen dissociation curve: ODC)
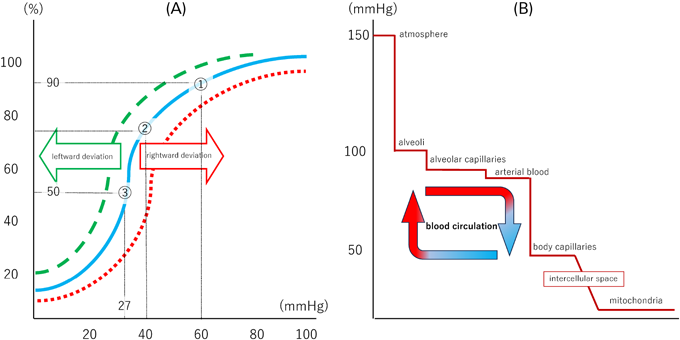
ODCは,酸素分圧と酸素飽和度の関係を示すS字曲線であり,縦軸にヘモグロビン(Hb)と結合している動脈血酸素飽和度(SaO2)を,横軸に動脈血酸素分圧(PaO2)を示す(Fig. 2A).このODCは,運動やCO2増加,アシドーシス進行,体温上昇,2,3-DPG(2,3-diphosphoglycerate)増加によって,右方偏位する(Bohr効果).これは細胞内の酸素需要が高い状況で,酸素分圧の低い末梢組織に,より酸素を切り離しやすくなる防御機構となっている.チアノーゼ性心疾患では右方偏位が強く,SpO2が低い状態でも,末梢組織へ酸素を効率よく受け渡す.ODCの偏位を意識すると,目標SaO2を想定しやすい.
酸素瀑布(oxygen cascade)
大気から酸素を摂取し,Mtの電子伝達系まで運搬する経路に酸素分圧の低下を示したものを酸素瀑布(oxygen cascade)と呼ぶ.Fig. 2Bは健常者が大気から酸素を取り込み,100 mmHgの酸素分圧の動脈血が細胞間質に酸素を受け渡し,最終的にMtへ酸素を送り込む様子を示す.細胞間質の酸素分圧は5~40 mmHgと幅があるが7),これは組織内の酸素分圧は不均一なため8),組織深部での酸素分圧に余裕を持たせているからである.最終過程の酸化的リン酸化(式1)が行われるMt内酸素分圧はたった1 mmHgで十分とされている.このoxygen cascadeを理解していると,吸入酸素濃度だけでなく様々なレベルで如何に介入して酸素分圧を上げるかを考えることができる.高濃度酸素には酸素毒性や吸収性無気肺,体血管収縮作用など多くの弊害もあり,適切な酸素投与を意識したい.
酸素含有量(CaO2)
ここまでは酸素分圧の観点で考えてきたが,酸素は主に血液中のHbによって運搬されるため,血液中に含まれる量,酸素含有量(CaO2)を考える必要がある.これは血液100 mL(1 dL)内に含まれる酸素量で示され,以下の式で求められる. CaO2を増やすためにはSaO2(酸素飽和度),Hb, PaO2(酸素分圧)を増加させればよいとわかる.Hb=7 g/dL, SaO2=97%(PaO2=100 mmHg)の患者Aと,Hb=14 g/dL, SaO2=90%(PaO2=60 mmHg)の患者Bを考えてみると,患者AにおけるCaO2は約9.5 mL/dL,患者BにおけるCaO2は約17 mL/dLである.SaO2は低いがHbが高い患者Bのほうが酸素含有量は多いのである.
酸素運搬量(oxygen delivery: ḊO2)
ある瞬間を考えた時には,ODCや酸素瀑布の原理に基づいて,毛細血管内酸素濃度を維持することがMtへの酸素運搬に重要である.しかし血液は常に動いており,毛細血管内酸素飽和度を維持するためには,Hbに乗せて酸素を運搬し続けなくてはいけない.そのような循環“動態”を解釈するために時間の概念を加える必要がある.これが1分間に末梢組織に運搬される酸素量を示す酸素運搬量(ḊO2)であり,酸素含有量(CaO2)と心拍出量(cardiac output: CO)の積で表される. これに式2を合わせると,以下のようになる. 0.003×PaO2は非常に小さく,式3-2は以下のように簡略化できる. COは1回拍出量(stroke volume: SV)と心拍数(heart rate: HR)の積であり,式3-3は以下のように変換できる. SaO2が低くても,ḊO2はSVやHR,Hbの増加によって代償できるが,個々のパラメーターには至適な範囲があり,無限に大きくできるわけはない.これについては後述する.
圧容量曲線(Pressure-Volume loop: PV loop)
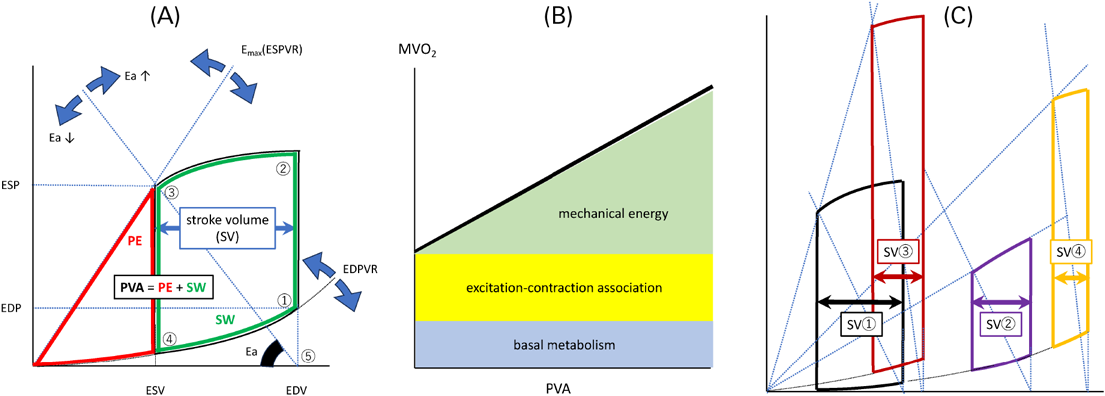
SVは,拡張末期容量(end diastolic volume: EDV)と収縮末期容量(end systolic volume: ESV)の差である(SV=EDV−ESV).このSVを他のパラメータとともに把握するツールとして,PV loopがある(Fig. 3A).拡張末期①→収縮早期②→収縮末期③→拡張早期④と変化させることで,loopが完成し,その横幅が,SVになる.ここで輸液などにより前負荷を変化させて様々なPV loopを作り,それらの複数の①をつなぐと,拡張能を示す曲線(end-diastolic pressure-volume relationship: EDPVR)が現れる.複数の③を繋いだ線が,収縮能を反映し,EmaxやESPVR(end-systolic pressure-volume relationship)と呼ばれる.さらに拡張末期容量(⑤)と③を結んだ線の傾きは後負荷(Ea)を表す.いかにSVを増やすかをこのPV loop上で考えてみると,Emaxを上げてEaを小さくすればよいことがわかる.ここでEDVを更に大きくすれば,SVをより大きくできるはずだが,それが最善の策だろうか?
このPV loopは,心筋酸素消費量も間接的に示す.Fig. 3Aにおける赤枠内(potential energy: PE)と緑枠内(stroke work: SW)の和を圧容量面積(pressure-volume area: PVA)と呼び,これは心筋酸素消費と比例する(Fig. 3B)9).SW/PVA比は,心臓の仕事効率を示す.例えば,Fig. 3Cにおける不全心のPV loopでは,SW/PVA比が小さく,非効率な心拍出と言える.Fig. 3CにおけるSV③はsevere ASのPV loopである.後負荷が著しく高いので,ESPが高く,SVの幅は狭い.SW/PVA比が小さく,またPVAも大きいので,酸素消費が多く,かつその効率が悪いことがわかる.また,VA-ECMO(veno-arterial extracorporeal membrane oxygenation)患者でもPV loopやPVAを考えることも可能である(Fig. 3C SV④)10).急性心筋炎患者に対してVA-ECMOを導入した直後を考えるとわかりやすい.脈圧が一桁で,血圧は高いが心臓は大きい状態で,PVAが大きく,心筋酸素消費が多い.この状態では十分なcardiac restとは言えず,LV unloading(LV ventなど)をして心筋酸素消費を小さくしなくてはいけない.近年,成人などで用いられるImpella+VA-ECMOは,PVAを小さくし,心筋酸素消費を抑える11).
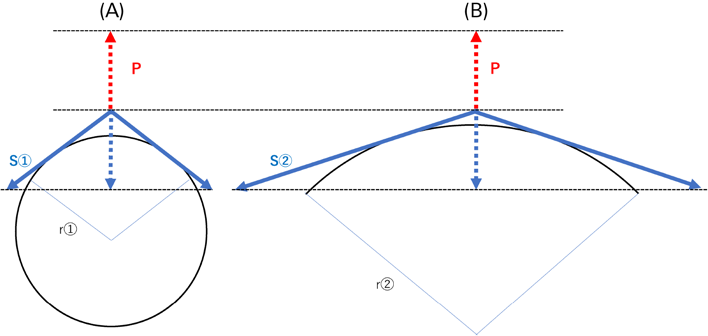
さて,生理学における前負荷の正確な定義は,「拡張末期における壁応力」である.Laplaceの法則(Fig. 4)では,中空の球体における壁張力(T)と内圧(P),球体の半径(r)の関係は と表される.壁張力(T)は,wall stress(S)と壁厚(w)の積であるが,このSこそが心筋への負荷であり,式4-1は以下に変換できる. つまりwall stressは内圧と半径に比例し,壁厚に反比例する.心不全で心臓が拡張した状態では,半径が増大して,圧発生の効率は低下する.これはPV loopがFig. 3Cのように変化することを意味し,またSW/PVA比が小さくて効率が悪く,心負荷が大きいことと合致する.この状態で健常な心臓と同じ圧を発生させるためには,より高い壁張力を必要として酸素消費が増える.心不全で心臓が拡大している場合,利尿剤投与によって心室内圧の上昇効率を改善する12)のはこのためである.闇雲にEDVを増やすのではなく,心筋酸素需要や効率とのバランスを考慮することが重要である.
静脈還流(venous return: VR)について
ここまで心拍出(≒心臓から送り出される血流)に着目して,循環を概観した.しかし,全血液量の約60~70%は静脈系にプールされ13),循環血液量の変化に対応している.ここから静脈還流(VR)にも目を向けてみる.
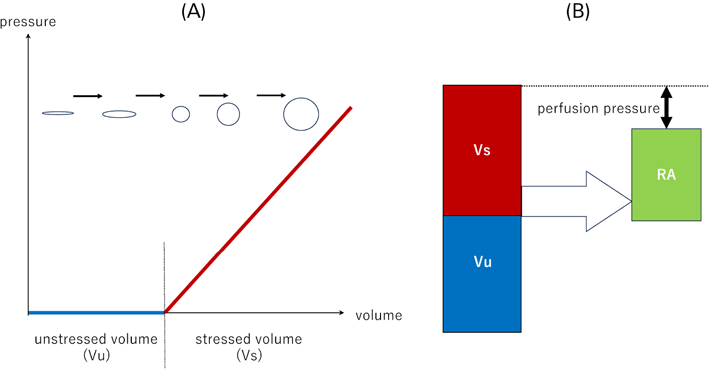
VRは循環に寄与している血液量=stressed volume(Vs)とそれ以外の血液量=unstressed volume(Vu)に分けて考える(Fig. 5).VsとVuの和を総血液量(total volume: Vt)と呼び,Vsは静脈圧に寄与しVtの20~30%を占める.Vuは血液のリザーバーであり,交感神経賦活化により,VuからVsへのシフトをする代償機構を持つ.大量出血時には内因性カテコラミンによりVuからVsへシフトし,循環血液量を保つ.
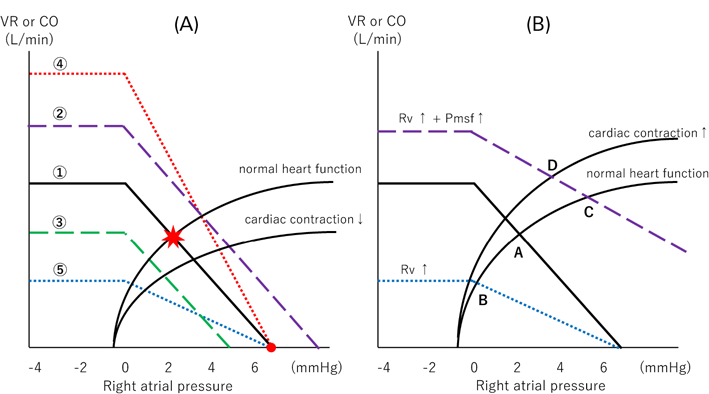
VRにおける重要な概念として,GuytonのVR曲線がある(Fig. 6A)14, 15).横軸に右房圧,縦軸にVRを置き,VR=0になったときの圧を,平均体血管充満圧(mean systemic filling pressure: Pmsf)と定義する.これはFig. 6Aの赤丸で示される.Pmsfは循環停止下の血管内圧が一定になった時の圧で,通常は7~8 mmHg程である.血管コンプライアンス(C)は血管内圧変化ΔPに対する血管内容量変化(Vt−Vu=Vs)であり,Vu分は圧変化に寄与しないので,C=Vs/ΔPが成り立つ.Pra=0 mmHgからの変化は,ΔP=Pmsfと代用でき,Pmsf=Vs/Cとなる.血管が収縮するとVuからVsへシフトし,またCも低下するので,Pmsfは増加する.ここで静脈圧と心拍出量の関係を示す,Frank–Starlingの法則によるCO曲線を見てみると,VR曲線と同じ変数を扱っていることに気づく16).よって,これら2つの曲線を同一平面上に記載すると,Guytonの平衡図となる.この交点(Fig. 6Aにおける星印)を循環平衡と呼び,実際の心拍出量を示す.様々な病態や,薬剤の使用で,このGuytonの平衡図は様々な変化を示す14, 15).Noradrenalin使用によりGuytonの平衡図が変化をするのかをFig. 6Bに提示する.血管収縮作用と心収縮亢進作用により,なぜCOが増えるのかがわかる.restrictive RV physiologyを呈する術後症例にNoradrenalinを投与し,VuからVsにshiftさせることが有効であったと思われる実例をFig. 7に示す.同様にFontan手術周術期やfailed Fontan患者の循環不全に対して,Vs(≒循環血液量)の増加を企図してNoradrenalinを使用することは生理学的に理にかなう.また心機能が低下すれば,右房圧が上昇し,前負荷が増加することもVR曲線の変化からわかる.PV loopにおいて,Emax低下時に輸液負荷をしていないにもかかわらず,loop全体が右方へ偏位することと一致する(Fig. 3CにおけるSV①→SV②の変化).
酸素消費量(oxygen consumption: V̇O2)
ここで視点を変えて,実際に細胞がどれほどの酸素を必要としているのか,考えてみたい.Mt内酸素分圧は1 mmHgで十分だが直接モニタリングできない.それを評価するためにはどれだけの酸素を心臓から送り込む必要があるのかを知る必要があるが,これは末梢組織で酸素をどれだけ消費したのか,を評価することが最適である.これが酸素消費量(oxygen consumption: V̇O2)であり,以下のように計算される. となる.CvO2は混合静脈血酸素含有量であり,ベッドサイドではSVC血で代用できる.SvO2を混合静脈血酸素飽和度として,式5-1は以下のように変換できる. このV̇O2は安静時から運動時にかけて大きく変化する7).そのV̇O2の増加に対して,換気量とCOの増加で対応するが,換気量の増加に対するCOの増加の影響は少なく17),COを増やすことは容易ではない.V̇O2は痙攣・シバリング・発熱・交感神経興奮・カテコラミン投与などで増大する18)ので,これらの増大因子を減ずることが急性期には重要である.
V̇O2=ḊO2で十分か
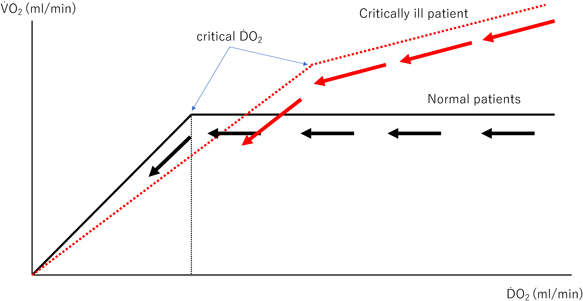
では,ḊO2はV̇O2とイコールになる程度に維持されれば十分だろうか?まず,供給された酸素の内,どれくらいが消費されたのかを示す酸素抽出量(oxygen extraction ratio: O2ER)について知る必要がある.O2ERは以下の式で求められる. 酸素供給(ḊO2)に対して,末梢で酸素をどれくらい消費したのか(V̇O2),の割合を示し,通常は20~25%程度である.これは健常者において,SvO2が75%ほどが正常値であることと同義である.安静時のV̇O2は大きく変化しないなかで,ḊO2を減らしていくと,Fig. 8のような変化を辿る19).平時はある程度までḊO2が減っても,V̇O2は維持されるが,臨界点=critical ḊO2を超えると,V̇O2も減少し始める.O2ERが代償されるのは40~60%ほどまでであり,ḊO2は最低でもV̇O2の2倍以上は維持しないといけない.また,病態によっては,V̇O2がḊO2に比例するように変化するcritical ḊO2の位置は変化する18, 20).特に敗血症性ショックの患者では,ḊO2が正常域にあると思われても,V̇O2が増減する可能性が指摘されており21),critical ḊO2を推定するには,SvO2の変化・推移を追うことが有用である.チアノーゼ性心疾患ではODCが右方偏位して,O2ERの代償機転が働き,SvO2が50~60%でも乳酸アシドーシスには進行しにくい.SaO2が70%前後でも,乳酸アシドーシスにならないlow flowのBTシャント患者を考えれば,納得だろう.
ミクロ循環(microcirculation)
末梢組織への酸素の拡散・抽出の場として,ミクロ循環という概念がある22).径100 µm未満の細動脈・毛細血管・細静脈から構成され,それらは血管抵抗を規定する「抵抗血管」である小動脈や細動脈より細い18).敗血症などの重症患者ではこのミクロ循環を対象にした研究が多く存在し,循環器集中治療の現場でも近年注目されている.新生児の開心術後に心臓は過収縮なほどよく動いているにもかかわらず,末梢循環が悪く乳酸値が下がらないことをしばしば経験するが,この病態はミクロ循環の概念で説明可能である.
ミクロ循環は,diffusive component(毛細血管密度capillary density)とconvective component(流量flow)の2つの概念で構成される.安静時には全ての毛細血管が開存しているわけではなく,終末細動脈の収縮・弛緩で調整され,酸素需要が増加した時に毛細血管への血流が増加する(毛細血管密度の変化).また,毛細血管における血液流量の低下は,末梢組織への酸素供給の減少に直結する.Poiseuilleの法則で考えると,毛細血管血流量(F)は以下のようになる(r:毛細血管径,ΔP:駆動圧,L:毛細血管長,η:血液粘度). 毛細血管径や長さを変化させることは難しいが,臨床医が容易にコントロールできるのは,毛細血管にかかる駆動圧と血液粘度である.駆動圧は,体血圧と静脈圧の差で規定され,血液粘度は,主にHb値で考えることができる.
このようなミクロ循環をターゲットとした様々な治療方法(β刺激薬23)や血管拡張薬24),輸液25)など)が模索されているが,いずれも現時点での推奨レベルは高くない.
Perfusionと潅流圧について
ミクロ循環は,組織潅流(perfusion)と同義であり,末梢細胞へ酸素を送り込む原動力である.その血流量はPoiseuilleの法則(式7)に基づくが,ミクロ循環を構成する毛細血管は5~100 µmほどで,r4は小さくなるため,perfusionはほぼΔPに規定される.このΔPは体血圧と静脈圧の差であり,perfusionには体血圧維持が必須である.最低限の体血圧(critical closing pressure: Pcc)は,臓器ごとに異なるが,平均体血圧は,新生児で35~45 mmHg,乳児で40~45 mmHg,幼児で45~55 mmHg,学童で50~65 mmHgを目安とする26).臨床ではこれらの数値を目安にCOを保ちつつ,血管収縮/拡張薬での調整をすることになる.perfusionの判断には尿量のモニタリングが簡便であり,最低でも0.5 mL/kg/hの尿量を維持したい.
治療効果判定としての乳酸
循環評価の一つとして,乳酸(Lactate: Lac)を用いることが多い.嫌気的解糖の亢進で増えると思われているが,実際にはかなり複雑で,「体内におけるLacの産生と代謝・排泄のバランス」によって決まる.頻繁に遭遇するLac上昇の原因としては,ショック・低灌流・重度低酸素・β2受容体刺激・シアンなどがある.しかし,低酸素血症が単独でLacを上昇させるには,PaO2<35 mmHg(SaO2 67%ほど)と言われており27),極端なチアノーゼ以外では低潅流など他の原因を探る必要がある.また代謝・排泄には肝臓と腎臓が関与しており,臓器障害の結果を見ていることもある.
ここまでの循環生理の知識を,臨床の現場に落とし込んでみたい.我々が扱う疾患は,単純な二心室疾患ばかりではないが,可能な限り普遍的な話を進めていく.
低心拍出症候群(low cardiac output syndrome: LCOS)について
LCOSの明確な定義は定まっていない28)ものの,「心臓のポンプ機能の低下による酸素供給量の低下・組織低酸素」というのが一般的な定義である.これに対応するため「ḊO2/V̇O2>2とperfusionを維持し続けながら,心筋のwall stressを可能な限り減らすこと」が本稿を踏まえたLCOS管理の肝となる.
まずḊO2をいかに増やすかを考えると,式3-3からHb・SaO2・SV・HRを増やせばよいことがわかる.このなかでもSVを増やすことが重要であり,PV loopで考えるとEmaxを上げ,Eaを下げることが有効である.EDVを大きくすることもSV増加には寄与するが,同時にPVAも大きくなり心筋酸素消費を増やすため注意が必要である.また拡張能が低下している症例では,EDPVRが急峻になっており,EDVを増やすとEDPが想定以上に上昇する.左房圧上昇,肺鬱血の進行から肺出血を来すこともあるため,EDVを増やす介入は適応・輸液投与量を慎重に判断しなくてはいけない.ḊO2をいかに増やすかを意識するがあまり極端に高いHb値を時に見かけるが,粘性が高くなるためミクロ循環の血流量を考えると,デメリットが大きい.また,HRを上げることはḊO2を増やすことに直結するが,不全心では早い心拍数に心機能が追従せず,SVが低下してSV×HRの積がむしろ小さくなる場合もある.僧帽弁狭窄でもHRが早すぎると,拡張時間を確保できずSVが小さくなる.逆に,拡張末期容積が小さい症例では,HRを早くすることで小さいSVを補うことも必要になる.このように至適なHRは症例ごと,状況ごとに異なる.またatrial kickは心房から心室への血流の20~30%に影響するため29),HRだけでなく心房-心室連関を意識することも重要である.
次に,V̇O2をいかに減らすかという観点から,体温・鎮静鎮痛・人工呼吸・栄養などを考える.人の体温は1°C上昇するごとに,酸素消費量が13%増加するため30),適度な体温管理はLCOS治療として有用である31).鎮静・鎮痛管理も酸素消費量を抑えるため,同様にLCOS治療に有用である.人工呼吸管理に関しては,心不全患者では呼吸仕事量が増加し全酸素消費量の10~20%を占めており,人工呼吸管理によりV̇O2を減少させることができる.さらに陽圧換気により胸腔内圧が上昇して,心室後負荷を減ずる効果もある.これはHFNCでもその効果が時に認められる.また,栄養管理,腸管血流・腸管でのV̇O2への配慮も欠かせない.ミルク注入後などにSVR低下から血圧低下や低酸素血症を来すこともあり,必要に応じて絶食に切り替え,中心静脈栄養も考慮する.忘れがちだがadrenaline投与でも組織のV̇O2が上昇する32).CO維持を意識するあまりに,過剰なadrenaline投与によって酸素需給バランスを崩していないだろうか? 過剰なadrenalineを減量することで,Lacが低下することも時に経験する.
LCOSは治療と並行して,その原因を考える必要がある.PICUで主に扱うのは周術期のLCOSだが,それ以外の急性LCOSでは治療しうる疾患や特異的治療方法が存在する疾患が隠れている場合がある33)ため,原因検索も重要である.
単心室循環について(Fig. 9)
単心室疾患(チアノーゼ性心疾患)であっても,基本概念は同じである.大きく異なるのは,体血流(systemic blood flow: Qs)と肺血流(pulmonary blood flow: Qp)のバランスで,血行動態が大きく変わることであり,低いSaO2で,酸素需給バランスを維持する必要がある.これが単心室診療の肝であり,以下に詳細を紐解く34).
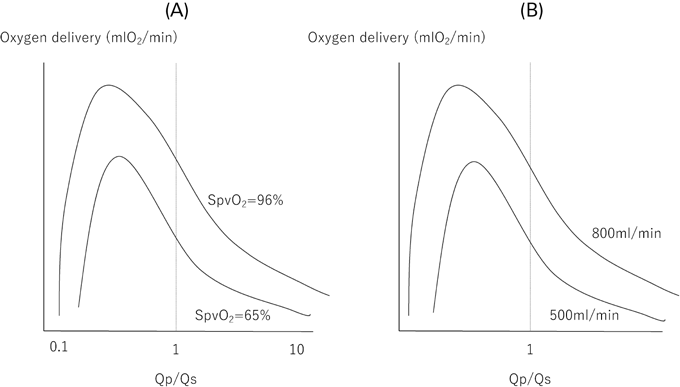
まず,体循環で考えると,酸素供給と酸素消費の差は,体静脈血酸素含有量(CsvO2)とQsの積に等しくなる. また肺循環で考えると,肺へ送られた血液に,酸素が取り込まれて,肺静脈血になるので,以下の式が成り立つ. さらに, でもあり,安静時には酸素摂取と酸素消費は同じになるので, もまた成り立つ.式8-1~8-4までを合わせてCaO2×Qs(=ḊO2)を考えると, となり,ḊO2はQp/QsとCO, CVO2, CpvO2の変数によって規定されることがわかる.Qp/QsとCVO2は小さいほうが,COとCpvO2は大きいほうがḊO2を増やす,という直感的に当たり前だと感じることが論理的に示される.
BarneaらはḊO2を最大化するために,どうすべきかとシュミレーションして,Fig. 10のような結果を示した34).これによると,Qp/Qs<1のときにḊO2は最大化するが,COが多ければQp/Qsはより小さくてもよい.つまり最大ḊO2を獲得するにはQpは少ないほうがよい.しかし,SaO2が低くなりすぎても,好気性代謝を維持できなくなる可能性があるので注意が必要である.
Qp/Qsは体血管抵抗(systemic resistance: Rs)と肺血管抵抗(pulmonary resistance: Rp)のバランスで変化する.Rpを上げるにはCO2↑やアシドーシス,低酸素換気療法(窒素(N2)),Rpを下げるには酸素や一酸化窒素(NO)の吸入,CO2↓,肺血管拡張薬などが有効である35).特にRpを変化させる医療ガス(NOやN2)の使用方法は熟知しておくべきである.N2に関しては,低酸素によるQp/Qsの低下が生じれば心負荷軽減になるが,同時にCaO2の低下により,酸素需給バランスを安定化させられない可能性ある36).さらには,DobutamineはRsを低下させると言われているが,Qp/Qsを増加させて,ḊO2を減少させる報告もある37).臨床現場ではRsのコントロールが有効なことのほうが多く,Rpのみにこだわるのではなく体血管拡張/収縮薬を有効に使いたい.
実際には多くのパラメータが複雑に絡み合ってSaO2やQp/Qsが変化する.房室弁逆流や心収縮力,心拍数によりḊO2も変化する.心内でのミキシング具合によっては,非効率な血流になることもある.複雑な症例では目先のSaO2や血圧などだけで判断しがちだが,LacやSvO2・尿量の経時変化が重要である.生理学的に正しい治療・介入をしていれば「この後良くなるはず」と静観することもできる.また,肺血流過多への意識が強すぎるあまり,体血流が十分かどうか,の意識が弱くなっていないだろうか? 単心室循環においてもḊO2が十分か,の視点が重要である.時に意図して肺血流を多めにする治療戦略になることもあるが,その場合には高肺血流を許容しつつ,ḊO2が十分かどうか,心筋酸素消費やwall stressは許容されうるかを考えてほしい.
引用文献References
1) 大崎真樹:小児の急性期循環管理.Intensivist 2012; 4: 499–510
2) 大崎真樹:心疾患患児の急性期循環管理.日小児循環器会誌2019; 35: 153–163
3) 大崎真樹:循環生理を踏まえた呼吸管理,呼吸生理を踏まえた循環管理.日小児循環器会誌2020; 36: 178–185
4) 斎木宏文:循環生理をわかって評価と治療—循環不全の管理—.日小児循環器会誌2020; 36: 192–201
5) 上代淑人:イラストレイテッド ハーパー生化学27版.丸善
6) Vusse GJ, Glatz JF, Stam HC, et al: Fatty acid homeostasis in the normoxic and ischemic heart. Physiol Rev 1992; 72: 881–940
7) Hall JE: Guyton and Hall Textbook of Medical Physiology. 12th ed. Philadelphia, Saunders Elsevier, 2010
8) Ince C, Mik EG: Microcirculatory and mitochondrial hypoxia in sepsis, shock, and resuscitation. J Appl Physiol 2016; 120: 226–235
9) Suga H: Total mechanical energy of a ventricle model and cardiac oxygen consumption. Am J Physiol 1917; 236: 498–505
10) Rao P, Khalpey Z, Smith R, et al: Venoarterial extracorporeal membrane oxygenation for cardiogenic shock and cardiac arrest. Circ Heart Fail 2018; 11: e004905
11) Zein R, Patel C, Mercado-Alamo A, et al: A review of the impella devices. Interv Cardiol 2022; 17: e05
12) 岡田隆夫:心臓・循環の生理学.メディカル・サイエンス・インターナショナル
13) Levick JR: An Introduction to Cardiovascular Physiology. 5th ed. London, Hodder Arnord, 2010
14) Funk DJ, Jacobsohn E, Kumar A: The role of venous return in critical illness and shock—part I: Physiology. Crit Care Med 2013; 41: 255–262
15) Funk DJ, Jacobsohn E, Kumar A: The role of venous return in critical illness and shock—part II: Shock and mechanical ventilation. Crit Care Med 2013; 41: 573–579
16) Uemura K, Kawada T, Kamiya A, et al: Prediction of circulatory equilibrium in response to changes in stressed blood volume. Am J Physiol Heart Circ Physiol 2005; 289: H301–H307
17) West JB: Respiratory Physiology: The Essentials. 8th ed. Philadelphia, Lippincott Williams & Wilkins, 2008
18) Leach RM, Treacher DF: The pulmonary physician in critical care・2: Oxygen delivery and consumption in the critically ill. Thorax 2002; 57: 170–177
19) Lookinland S, Shoemaker WC: Comparison of cardiorespiratory response to sudden progressive hypoxia in an animal model with and without respiratory failure. Crit Care Med 1990; 18: 989–994
20) Vincent J-L, De Backer D: Oxygen transport: The oxygen delivery controversy. Intensive Care Med 2004; 30: 1990–1996
21) Suetrong B, Walley KR: Lactic acidosis in sepsis: It’s not all anaerobic: Implications for diagnosis and management. Chest 2016; 149: 252–261
22) 古川 拓:ミクロ循環の生理学.INTENSIVIST 生理学2020; 45: 131–140
23) Secchi A, Wellmann R, Martin E, et al: Dobutamine maintains intestinal villus blood flow during normotensive endotoxemia: An intravital microscopic study in the rat. J Crit Care 1997; 12: 137–141
24) De Backer D, Creteur J, Preiser J-C, et al: Microvascular blood flow is altered in patients with sepsis. Am J Respir Crit Care Med 2002; 166: 98–104
25) Ospina-Tascon G, Neves AP, Occhipinti G, et al: Effects of fluids on microvascular perfusion in patients with severe sepsis. Intensive Care Med 2010; 36: 949–955
26) Muñoz RA, Morell VO, da Cruz EM, et al (eds): Critical Care of Children with Heart Disease: Basic Medical and Surgical Concepts, Springer, 2021
27) Hobler KE, Carey LC: Effect of acute progressive hypoxemia on cardiac output and plasma excess lactate. Ann Surg 1973; 177: 199–202
28) Schoonen A, van Klei WA, van Wolfswinkel L, et al: Definitions of low cardiac output syndrome after cardiac surgery and their effect on the incidence of intraoperative LCOS: A literature review and cohort study. Front Cardiovasc Med 2022; 9: 926957
29) Namana V, Gupta SS, Sabharwal N, et al: Clinical significance of atrial kick. QJM 2018; 111: 569–570
30) Shapiro H, Stoner EK: Body temperature and oxygen uptake in man. Rheumatology (Oxford) 1966; 8: 250–255
31) Dalrymple-Hay MJ, Deakin CD, Knight H, et al: Induced hypothermia as salvage treatment for refractory cardiac failure following paediatric cardiac surgery. Eur J Cardiothorac Surg 1999; 15: 515–518
32) Ensinger H, Weichel T, Lindner KH, et al: Are the effects of noradrenaline, adrenaline and dopamine infusions on VO2 and metabolism transient? Intensive Care Med 1995; 21: 50–56
33) Allen HD, Shaddy RE, Penny DJ, et al: Moss and Adams’ Heart Disease in Infants, Children, and Adolescents: Including the Fetus and Young Adults, 9th ed., Wolters Kluwer, 2016
34) Barnea O, Austin EH, Richman B, et al: Balancing the Circulation: Theoretic optimization of pulmonary/systemic flow ratio in hypoplastic left heart syndrome. J Am Coll Cardiol 1994; 24: 1376–1381
35) Burrows FA, Klinck JR, Rabinovitch M, et al: Pulmonary hypertension in children: Perioperative management. Can Anaesth Soc J 1986; 33: 606–628
36) Tabbut S, Ramamoorthy C, Montenegro LM, et al: Impact of inspired gas mixtures on preoperative infants with hypoplastic left heart syndrome during controlled ventilation. Circulation 2001; 104 Suppl 1: 1159–1164
37) Riordan CJ, Randsbaek F, Storey JH, et al: Inotropes in the hypoplastic left heart syndrome: Effects in an animal model. Ann Thorac Surg 1996; 62: 83–90
38) Tabbutt S, Ghanayem N, Almodovar MC, et al: Training fellows and residents in paediatric cardiac critical care. Cardiol Young 2016; 26: 1531–1536
39) Auriemma CL, Van den Berghe G, Halpern SD: Less is more in critical care is supported by evidence-based medicine. Intensive Care Med 2019; 45: 1806–1809