Ablation治療Ablation Therapy
大阪母子医療センター 小児循環器科Department of Pediatric Cardiology, Osaka Women’s and Children’s Hospital ◇ Osaka, Japan
成人の不整脈治療の進歩とともに小児・先天性心疾患の不整脈治療の進歩には目を見張るものがある.Wolff–Parkinson–White syndrome(WPW症候群)に対しては小児においても安全にアブレーションが行えるようになってきている.また重症の先天性心疾患患者が成人期まで生存するようになり,不整脈,あるいは突然死を起こすことが問題となっている.近年フォンタン手術後の不整脈に対して導管を穿刺してアブレーションする方法が開発された.それに伴い治療成績の改善が得られている.
Accompanying advances in the treatment of arrhythmias in adults, there have been remarkable advances in the treatment of arrhythmias in children and congenital heart disease. Wolff–Parkinson–White syndrome can now be safely ablated in children. Patients with severe congenital heart disease also are now surviving into adulthood, leading to new problems of arrhythmias and sudden death. Recently, a conduit puncture and ablation technique was developed for treating arrhythmias after Fontan surgery that has resulted in improved outcomes.
Key words: children; congenital heart disease; catheter ablation; Wolff–Parkinson–White syndrome; Fontan operation; conduit puncture
© 2024 特定非営利活動法人日本小児循環器学会© 2024 Japanese Society of Pediatric Cardiology and Cardiac Surgery
成人の不整脈治療の進歩とともに小児・先天性心疾患の不整脈治療も目を見張るものがある.特にカテーテルアブレーションでは3Dマッピングシステムの進歩に伴い,成績の向上がみられている.Wolff–Parkinson–White syndrome(WPW症候群)に対しては小児においても安全にアブレーションが行えるようになってきている.また重症の先天性心疾患患者が成人期まで生存するようになり,不整脈,あるいは突然死を起こすことが問題となっている.近年フォンタン手術後の不整脈に対して導管を穿刺してアブレーションする方法が開発された.それに伴い治療成績の改善が得られている.本稿では小児・先天性心疾患に対する経皮的カテーテルアブレーションについて概説する.
先天性心疾患や心筋症などの基礎心疾患に合併する不整脈と基礎心疾患を有しないものに大別できる.特に特殊な刺激伝導系や,基礎心疾患に特有の不整脈(Ebstein病,フォンタン手術後)に注意すべきである.心筋症では一般的な肥大型心筋症など以外にDanon病,Histiocytoid cardiomyopathy1)がある.不整脈の分類(上室性,心室性)は基本的には成人と同様であるが,permanent form of junctional reciprocating tachycardia(PJRT)や接合部頻拍など小児で頻度が高いものや,先天性心疾患特有のtwin atrioventricular nodes(AVNs)に関連する頻拍などがある(Table 1).
| 上室性 | 心室性 |
| 心房頻拍 | 心室期外収縮 |
| 異所性心房頻拍 | 心室頻拍 |
| 心房粗動 | 先天性心疾患関連 |
| 心房内リエントリー頻拍 | 心筋症関連 |
| WPW症候群 | 虚血性 |
| 房室結節リエントリー頻拍 | 特発性心室頻拍 |
| 接合部頻拍 | (ベラパミル感受性心室頻拍) |
| twin AVNsが関連する頻拍 |
小児・先天性心疾患に対するアブレーションを施行している単施設の報告を示す2).WPW症候群が一番多く,房室結節リエントリ頻拍(atrioventricular nodal reentrant tachycardia: AVNRT),心室期外収縮・心室頻拍(premature ventricular contraction: PVC; ventricular tachycardia: VT)が続く.成人で多くを占める心房細動はわずかである.
Indications for pediatric and congenital ablation in 877 patients. In contrast to adult patients, Wolff–Parkinson–White (WPW) pattern was the most frequent diagnosis. AF, atrial fibrillation; AP, accessory pathway; AT, atrial tachycardia; AV, atrioventricular; AVNRT, atrioventricular nodal reentrant tachycardia; AVRT, atrioventricular reentrant tachycardia; IART, intra-atrial reentrant tachycardia; JET, junctional ectopic tachycardia; NSVT, nonsustained ventricular tachycardia; PVC, premature ventricular contraction; VT, ventricular tachycardia. 文献2より引用
体重が3 kg程度から成人の体格までと扱う体格は幅広い.特に体格が小さい患者を対象にする場合はシースの太さ,本数,使用できる3D mapping systemを考慮する必要がある.重症の先天性心疾患ではその後もカテーテル検査,治療を繰り返し行うことが多く,その後の血管の開存は重要である.使用するシース,1本の血管に入れるシースの目安を示す(Fig. 2).本数は1本の血管に複数本のシースを入れる場合の最大本数(シースの太さにもよる).通常1本のシースから1本の電極カテーテルを挿入するが,5 Fr,10 Frに3本の電極カテーテルを挿入できるシースがある.可変シースの内径は8.5 Frだが,外径は11 Fr程度になる.
シースのサイズはFr. FV, femoral vein; FA, femoral artery; DS, deflectable sheath. 文献3より改変
新生児,乳児期のアブレーションではアクセスが限られる.基本的に血管1本にシース1本となる.上記に記載したように5 Frシースに2 Frの電極カテーテルを3本挿入できるシース(MPX:日本ライフライン)が有用である.また食道誘導も有用である.経食道用のgeneratorがあれば食道電極カテーテルからのペーシングも可能である.動脈からの逆行性アプローチも可能だが,乳児期では静脈からのアプローチが優先される.そのため左側副伝導路では卵円孔が開存しているか事前にチェックが必要である.
先天性心疾患では,血管閉塞やフォンタン手術後で心臓へのアクセスが制限されることがある.経肝静脈,外科とのハイブリッド,マグネティックナビゲーションシステムなど工夫しながら治療することになる.個々の症例で十分な準備を行い手技に臨む必要がある.
発生の過程で二つの房室結節があるが,通常は前方結節は消失し後方結節が残る.房室結節はKochの三角(三尖弁輪,Todaro索,冠静脈洞で形成)の上端に位置し膜性中隔の下縁を走行し,左脚,右脚に分かれる.房室中隔欠損症では流入部型の心室中隔欠損症(ventricular septal defect: VSD)があるため房室結節の位置は後方に偏位する.心房正位[S, L, L]の修正大血管転位では前方房室結節のみでヒス束は肺動脈の前方を迂回してVSDの前上方を走行する.修正大血管転位や右側相同心ではtwin AVNsがみられることがある.右側相同心,単心室での房室結節は心室中隔の心基部側(真上)に位置することが多い.
本稿では紙面が限られるため,頻度の高いWPW症候群と近年トピックであるフォンタン手術後の不整脈に対するアブレーションについて述べる.
Wolff,Parkinson,Whiteらは1930年に発作性頻拍を起こしやすい健康な若年者にみられるPR短縮を伴う脚ブロックの症例を報告した.これは後にWPW症候群と呼ばれることになる.房室副伝導路の病理所見は,1943年にWood,Wolferth,Gecklerらが右側副伝導路を4),1944年にÖhnell5)が左側副伝導路を報告した.ケント束と一般的に呼ばれているが,正確には通常の房室副伝導路はKentらが報告したものとは異なる6).副伝導路には房室副伝導路,Mahaim束,束枝心室副伝導路,結節心室などがあるが,本稿では頻度が高い房室副伝導路について限って述べる.房室副伝導路には部位,減衰伝導特性の有無,基礎心疾患(Ebstein病,修正大血管転位,心筋症など)で分類される.
小児期から学童期で診断される契機として動悸や学校検診での心電図異常(デルタ波)が多い.胎児頻拍,新生児期の頻拍,心筋症疑い,合併する先天性心疾患の経過中に診断されることもある.房室副伝導路の心電図分類として以下がある(Fig. 3).顕性はデルタ波が常にある,間欠性はデルタ波が間欠性にみられるもの,潜在性はデルタ波がなく副伝導路の逆行性伝導のみがあるものである.潜伏性は聞きなじみがないと思うが,順行性伝導があるがデルタ波がほとんどみえず,頻拍発作や偽性心室頻拍,上室期外収縮時のデルタ波の顕在化やQRS, T波異常を契機に診断される7).
2018年の日本循環器学会ガイドラインに適応基準の記載がある(Table 2)8).基本的な考え方として体重15 kgまではできるだけ薬物治療で,それ以降はアブレーションを考慮する.学校心臓検診で見つかるWPW症候群では,動悸の有無,突然死のリスク,心機能を評価したうえで経過観察あるいはアブレーションを考慮する.無症候性WPW症候群での心臓突然死発生率は年間0.05~0.2%と報告されており,日本循環器学会ガイドラインではアブレーションの適応はClass IIbと位置づけられている.成人に比べ小児,男性では致死性イベント率は高いと報告されている9).我々の施設では,突然死のリスクを考慮して無症候性WPW症候群に対しても積極的に評価,治療を行っている.
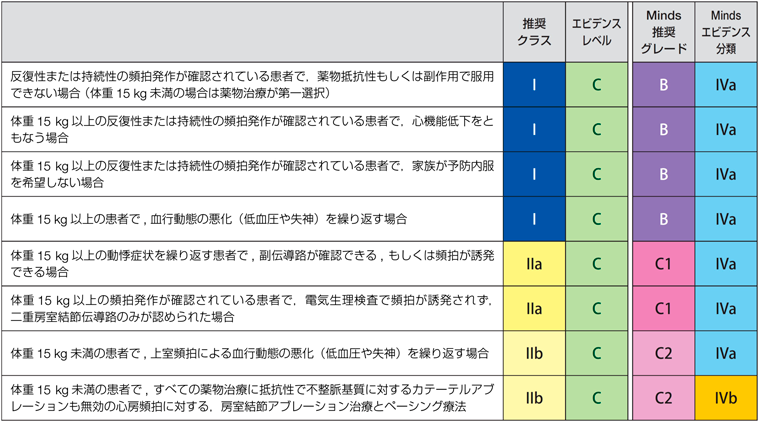 |
| (日本循環器学会/日本不整脈心電学会.不整脈非薬物治療ガイドライン(2018年改訂版).https://www.j-circ.or.jp/cms/wp-content/uploads/2018/07/JCS2018_kurita_nogami.pdf,2023年11月閲覧) |
アブレーション前に副伝導路の位置を推定することが準備,合併症予測の点から重要である.一般的にはArruda分類が使用される(Fig. 4)10).デルタ波の開始点の20 ms先行した点での極性を評価する.左側であれば中隔穿刺あるいは動脈穿刺が必要,中隔であれば房室ブロックのリスクを,右側であれば左側副伝導路より成功率,再発率の点で成績が悪いなどを事前に考えておく.複数副伝導路の場合はQRS波形の変化がみられる場合がある.
小児では全身麻酔下で施行することが多い.
電極カテーテルの留置:成人の体格であれば左大腿静脈に3本,右内頸静脈に1本のシースを留置し,それぞれから高位右心房(HRA),ヒス束(His),右室心尖部(RVA),冠静脈(CS)に4本留置する.体重が20 kg台までであれば左大腿静脈からのシースはHis,RVAの2本とし,EPSのときには右大腿静脈から挿入したアブレーションカテーテルをHRAに留置して検査している(Fig. 5).
房室副伝導路のEPSで評価する項目は以下である.
心房頻回刺激260 pacing/minute (ppm)では副伝導路を介して心房・心室が1 : 1伝導であるが,270 ppmでは2 : 1伝導となっている.副伝導路不応期は260 ppm (cycle length 230 ms)と250 ms以下であり突然死のリスクがあると判断される.
A)心室期外刺激法での逆伝導路の鑑別(副伝導路)心室期外刺激で期外刺激を短縮してもVA時間(心室-心房)は延長しない.図ではS1S1 800 msの時にVA 55 ms, S1S2 300 msでVA 55 ms. 房室結節を介する室房伝導の場合はVAが延長する.延長しないのは副伝導路を介する室房伝導を示唆する.B)心房頻回刺激による頻拍発作の誘発心房頻回刺激(270 ppm)中に頻拍発作が誘発された.S2はデルタ波を形成しているが,S3ではデルタ波はない.His電位がみえておりS3は房室結節を順伝導することでQRSを形成している.そのあと心房波(A)が記録されており,これは副伝導路を室房伝導している.CS1-2の心房波のタイミングが早く(最早期心房興奮部位),つづいてCS9-10, HIS1-2, HRA1-2の順となっている.そのあと頻拍が持続している.CS1-2は左房側壁,CS9-10は冠静脈洞入口部に位置することから,副伝導路は左房側壁に位置する.C)房室リエントリ性頻拍の診断;頻拍発作中のヒス不応期での単発心室期外刺激ヒス不応期に単発心室期外刺激をいれることで心房リセット現象を認める(PVC scan). これは房室リエントリ性頻拍の証明となる.頻拍(CL 306 ms)中に単発の心室期外刺激(S)をいれることでCS1-2のVVが306 msから293 msに短縮.ひきつづきAAが297 msに短縮している.また心室期外刺激時のVAは延長していない.左側側壁の副伝導路で右室心尖からのペーシングでは心房リセットがみられないことはよくある.
左側副伝導路へのアプローチとして施行する.まず手技前に卵円孔の有無を確認しておくことが重要である.体重が10 kgを超えれば成人と同じシステム(8 Frロングシース,RF needle)で行うことができる.体重が5 kg以下の場合は,RF wireを用いた穿通が勧められる.体重10 kg未満では6 Frのブロッケンブロー針のシステムも使用できる.1歳未満であればロングシースとワイヤーだけで心房中隔を通過することもある.モニタリングとして成人では心腔内エコーを使用するが,体格が小さい場合は,経食道エコーを使用する.体重が30 kg未満でCARTO®SOUNDSTAR®を用いて3Dマッピングの構築を行いたい場合は,血管内ではなく食道に留置してモニタリングが可能である(食道留置は適応外使用).合併症として,左房後壁あるいは天井を穿刺,あるいは心房中隔の間をワイヤーが抜けていくことによる心穿孔に注意する必要がある.体重15 kg未満の中隔穿刺10例中1例に治療を要さない程度の心嚢液貯留を認めたと報告されている11).
焼灼のターゲットは副伝導路であるが,細かくは副伝導路と心房あるいは心室の接合部,副伝導路中央となる.
当院では,副伝導路を介する室房伝導がある場合はまず心室ペーシング中に最早期心房興奮部位をマッピングしている.順伝導がない場合はその部位で焼灼,順伝導がある(デルタ波がある)場合は洞調律中の最早期心室興奮部位も確認している.ただ頻拍中ではない心室ペーシング中の房室伝導は純粋な副伝導路の逆伝導だけではなく房室結節の逆伝導を含む可能性がある.その場合房室伝導の逆行性伝導が速い症例が多く,左側副伝導路であっても最早期心房興奮部位が前中隔になることがある.その際はペーシングレートを上げる,あるいは頻拍発作中にマッピングする.順伝導のみの場合は洞調律中の最早期心室興奮部位をマッピングする.副伝導路電位が疑われる場合は,心房・心室からの期外刺激法で心房・心室電位でないことを確認することが望ましいが,刺激の影響で機械的に副伝導路が途絶してしまう可能性があるため行っていない.アブレーションカテーテルの電位は双極誘導,単極誘導で観察できるが,単極誘導は最早期興奮部位を同定するためには非常に有用である(Fig. 8A, 8B).ただ単極誘導は様々なノイズが入りやすく不関電極の使用やカテーテル検査室の環境整備が重要である12).
A)副伝導路のマッピング心室ペーシング中に最早期心房興奮部位をマッピング中の心内心電図である.ABL1-2, ABL uni1がそれぞれアブレーションカテーテルの双極誘導,単極誘導である.1番目の電極がカテーテルの先端電極である.CS1-2カテーテルの心房波のところ(点線)がCSカテーテルの最早期心房興奮部位である.2拍目のABL1-2の心房波は点線に一致しており,ABL uni1の矢印の点では陰性成分のみ(QSパターン)である.単極誘導でのQSパターンは興奮の起源を示すことから,この部位が副伝導路から心房に接合する部位と判断できる.矢印のVとAの間の周波数の高い電位は副伝導路電位を疑う.一方1拍目をみてみると,ABL1-2の心房波は点線よりすこし後ろにあり,ABL uni1でも点線から陽性→陰性(RS)となっている.単極誘導でRの存在は,カテーテル電極から離れたところから電極に向かってきていることを示している.両者の電位から最早期心房興奮部位はこの位置ではないことがわかる.B)マッピング中の心房,心室,副伝導路電位の確認(心房・心室同時ペーシング)2拍目は先ほどの電位と同じで心室ペーシング中の最早期心房興奮部位である.1拍目は心室だけではなく心室,心房両方を同時ペーシングしている.これにより心房波を前にすることで心房波の開始点,心室波の週末部がはっきりする.1拍目をみてみるとdullな(周波数が低い)心室波に引き続き,比較的sharpな(周波数の高い)電位が記録される.この場所で心室期外刺激を行いsharpな電位のみなくなると副伝導路電位と証明できる.本症例ではmechanical bumpを懸念し行っていない.この部位で焼灼後にはこの電位は残存していたため副伝導路と心房端の間で離断できたと考えている.
現在本邦では3種類のマッピングシステムを使用できる.いずれも副伝導路の最早期部位の視覚化ができることでチームで情報が共有できること,放射線被ばくが低減できること,複数副伝導路,心耳が関与する副伝導路,先天性心疾患合併症例では解剖学的な把握ができることから有用である.それぞれシステムの特徴がある.CARTO® system(Biosence Webster Inc., a Johnson & Johnson company, Diamond Bar CA, USA)は位置情報の正確性,もっとも歴史が長いことがあげられるが,専用カテーテルが7 Frと8.5 Frであり体重が6~7 kg以下では使用できない.一方Ensite™ system(Abbott, Chicago, Illinois)は専用カテーテル以外もマッピングで使用でき,5 Frのアブレーションカテーテルが必要な新生児期・乳児期のアブレーションでは有用である.Rhythmia HDx™ mapping system(Boston Scientific, Marlborough, MA)は多極カテーテルでのマッピングの正確性,マッピングスピードに優れている.ただマッピングカテーテルが8.5 Frであり体重20 kgを超えてからの使用がすすめられる.最近では副伝導路のマッピング方法としてopen window mappingが報告されており,大まかな副伝導路の位置の確認,複数副伝導路には有用である13).
基本は高周波を用いた通電である.中隔副伝導路で房室ブロックが懸念される場合や右側副伝導路でカテーテルの固定が不安定な場合に冷凍アブレーションの使用の報告2, 14)があるが,本邦では保険適応ではない.当院では,副伝導路に対してはノンイリゲーションカテーテル(Navistar, Biosence Webster Inc., a Johnson & Johnson company, Diamond Bar CA, USA)を使用している.その理由としては対象の多くが体重15~40 kgであること,イリゲーションカテーテルに比べ柔らかいこと,使い慣れていることがあげられる.通電は温度コントロールで55°C,出力40 Wで行っている.最近ではコンタクトフォース付きのイリゲーションカテーテルを使用している施設も多い.通電部位は,マッピングでターゲットとした部位で通電する.左側副伝導路で順伝導のみの場合は逆行性アプローチで,逆伝導がある場合は経中隔アプローチを行い,心室ペーシングあるいは頻拍中に心房端で通電する.前中隔,中中隔副伝導路の場合は心室ペーシングで心房端をマッピングしても洞調律中あるいは頻拍中に正常房室伝導を確認しながら通電を行う.ヒス束近傍は中心線維体により刺激伝導系が隔離されているため比較的安全に通電を行えるが,中中隔は前中隔より房室ブロックのリスクが高いため,やや心室側での通電を行っている.通電の際にはQRS幅のモニタが重要で,広くなると房室ブロックが疑われるため即座に通電を中止する.右側副伝導路は,カテーテルの固定が難しく成功率,再発率が左側副伝導路より悪い.そのためロングシースの使い方が重要である.また前方の副伝導路の場合は頸部からのアプローチでコンタクトがよくなることがある.三尖弁輪弁下アプローチも有用との報告がある15).最近では低被曝,非透視アブレーションの報告もみられる.“as low as reasonably achievable”という基本精神に則り被ばく線量を制限することは重要である.ただ安全に行うことが最優先であり,必要があれば透視を使用すべきである.
近畿大学心臓小児科での1992~2001年までの10年間のカテーテルアブレーションの長期成績を示す(Table 3).急性成功率は94%であり,再発は13%であった.右側副伝導路で左側にくらべ再発率が高かった.再発のほとんどが,アブレーション後半年までにみられた13).大阪市立総合医療センター小児不整脈科の2006~2018年の13年間では急性成功率は98%,再発11%,2015~2018年ではそれぞれ99.1%,6.9%である2).
| 急性成功率 | ||||||
|---|---|---|---|---|---|---|
| Site of the AP | Total | Prevalence | ||||
| Left | Septum | Right | Multiple | |||
| Success | 93 (97%) | 27 (90%) | 44 (94%) | 9 (82%) | 149 (94%) | p=0.005 L vs R: p=0.003 |
| Success without recurrence | 90 (90%) | 24 (80%) | 32 (68%) | 7 (64%) | 125 (81%) | |
| Recurrence | 7 (7%) | 3 (10%) | 12 (26%) | 2 (18%) | 24 (13%) | |
| Failure | 3 (3%) | 3 (10%) | 3 (6%) | 2 (18%) | 11 (6%) | |
| Total | 96 | 30 | 47 | 11 | 184 | |
| 遠隔期の成功率(追跡期間44か月) | ||||||
| Site of the AP | Total | Prevalence | ||||
| Left | Septum | Right | Multiple | |||
| Success | 96 (100%) | 27 (90%) | 44 (93%) | 10 (91%) | 177 (96%) | N.S. |
| Failure | 0 (0%) | 3 (10%) | 3 (7%) | 1 (9%) | 7 (4%) | |
| Total | 96 | 30 | 47 | 11 | 184 | |
| 再発の時期 | ||||||
| Left | Septum | Right | Multi | Total | ||
| −1 week | 3 | 4 | 9 | 0 | 16 | 53.30% |
| −1 month | 1 | 0 | 4 | 2 | 7 | 23.30% |
| −6 month | 3 | 0 | 1 | 0 | 4 | 13.30% |
| −1 year | 1 | 0 | 0 | 1 | 2 | 6.70% |
| −5 year | 0 | 0 | 0 | 0 | 0 | 0.00% |
| −10 year | 1 | 0 | 0 | 0 | 1 | 3.30% |
| Recurrence | 9 | 4 | 14 | 3 | 30 | |
| 文献12より引用 | ||||||
特に問題となる合併症として,死亡,心穿孔,タンポナーデ,房室ブロック,心筋梗塞などの報告がある.大阪市立総合医療センター小児不整脈科での小児・先天性心疾患に対するアブレーション1,021セッションのうち重大な合併症は5例(0.49%)であった.死亡はなく,心室穿孔,冠動脈狭窄,完全房室ブロック,血管損傷であった2).当院の88例のWPW症候群に対するアブレーションで,重症の合併症はなく,1例のみ右脚ブロックを認めた.
フォンタン手術は,心房肺動脈連結法(APC),側方トンネル法,心外導管を用いた上下大静脈肺動脈吻合術(EC-TCPC)があり,現在はEC-TCPCが主流となっている.APCでは術後30年での上室頻拍累積回避率は30%以下である14).EC-TCPCにおいても房室弁逆流や肺静脈に関する手術既往のある症例などに,術後経過年数とともに上室頻拍の出現率が上昇する16).不整脈の種類としては特に心房内リエントリ性頻拍の頻度が高い.特殊な不整脈としてはtwin AVNsが関連する頻拍がある.本稿では最近主流のEC-TCPCに対するアブレーション17–19)について説明する.
上室頻拍の場合のカテーテルの配置の例を示す(Fig. 9).導管,肺動脈,食道に電極カテーテルを1~2本留置する.マッピング時にリファレンスカテーテルとして動かないことが重要である.大動脈を逆行性に心室,ヒス束に電極カテーテルを留置する.逆行性にアブレーションカテーテルを入れる場合はヒス束のカテーテルを省略する.心房,心室ペーシングができる診断カテーテルは1本ずつ最低必要である.房室結節の位置については,Smith20)や黒澤21)の報告を参照していただきたい.基本的な考え方としては共通房室弁の場合は心室中隔の心基部側(真上),修正大血管転位で前方結節がある場合は後方にある肺動脈弁の前方をまわり心室中隔の前縁を走行する.
ABL, ablation catheter via conduit puncture; C, conduit; V, ventricle
肺静脈心房へのアプローチとして近年,心外導管22)あるいは心外導管と下大静脈との接合部を穿刺する方法が報告されている19).穿刺が難しい要因としてはフォンタンからの期間が長い,石灰化の存在,導管がリング付き人工血管である,導管から肺静脈心房までの距離が遠いなどがある.導管を穿刺する場合は,以前使用していた中隔穿刺を行う金属針(BRK Transseptal Needle; Abbott/St. Jude Medical, Inc., St. Paul, MN, USA)で行う23).導管と下大静脈の接合部を穿刺する場合は高周波ニードルでも可能である.穿刺時に穿刺針が上方にすべる場合はスネアで把持しながら穿刺する方法も有用である22).モニタリングは,透視,心腔内エコー,経食道エコーなどで行う.穿刺後にロングシースを心房に進める際には,導管のバルーン拡張が必要となる22).
通常のアブレーションと基本的に同じだが,いくつか注意する点がある.共通房室弁を旋回する心房内リエントリ性頻拍の場合,房室弁輪から下大静脈から線状焼灼することになるが,下大静脈は離断・縫合されておりその場所ははっきりわからない.そのため電位がない部位まで焼灼することになる.また通常では三尖弁下大静脈線状焼灼の際には冠静脈洞からペーシングを行い,両方向性ブロックラインができたことを確認するがそれもできないため,心房頻拍の非誘発性で成功の確認を行う17).Twin AVNが関与する頻拍については,当院では発作中に逆伝導する房室結節をターゲットとしている.ただ焼灼前には2つの房室結節の機能をチェックしておく.残す予定の房室結節の機能が悪い場合は発作時に順伝導する房室結節を焼灼する(Fig. 10).最後に単心室や修正大血管転位の前方結節での遅伝導路の部位は不明であるため,房室結節リエントリ性頻拍(AVNRT)の焼灼部位の決定は非常に難しい.slow/slow typeであれば最早期心房興奮部位での焼灼が可能だが,房室結節に近いことがある.またslow/fast AVNRTでは遅伝導路の同定ができない24, 25).クライオアブレーションにより治療することもあるが,再発も多いため今後の課題である.
A) 2つの房室結節の存在を証明している.心房の上方,下方からの心房ペーシング(矢印)によりQRS波形が異なる(▼).II誘導が陽性のものは前方の房室結節を主に伝導,rsr’のものは後方の房室結節を主に伝導していることを表す.B)頻拍時の心内心電図を示す.II誘導では陽性波であり,Aの前方の房室結節を通っているQRS波形と同じである.最早期心房興奮部位をマッピングにより逆行性伝導は後方房室結節であった.これらより二つの房室結節を旋回する頻拍と診断できる.C)通電部位を示す.本症例は心外導管を用いたフォンタン手術後であり,導管を穿刺して肺静脈心房に到達.左図のアブレーションカテーテルの位置は前方房室結節,右図は後方房室結節であり,この部位で通電を行い以後頻拍発作は誘発されなくなった.aAVN, anterior AVN; Ap, atrial pacing; AVN, atrioventricular node; pAVN, posterior AVN; RF, radiofrequency; SA, single atrium
WPW症候群とフォンタン手術後の不整脈に対するアブレーションについて述べた.WPW症候群に対しては小児においても安全にアブレーションが行えるようになってきている.中隔副伝導路での安全な焼灼方法はいまだ議論がある.またフォンタン術後の不整脈について,逆行性アプローチに比べ導管穿刺で心房へアプローチすることにより治療成績の改善がみられている.しかし心房頻拍・心房細動,複雑心疾患に合併する房室結節リエントリ性頻拍などのアブレーションは依然難しく今後の課題である.
本稿について申告すべき利益相反はありません.
1) Hirano Y, Aoki H, Ichikawa C, et al: Successful catheter ablation of premature ventricular contractions triggering torsade de pointes in a small infant with histiocytoid cardiomyopathy: A case report. Eur Heart J Case Rep 2019; 3: ytz091
2) Kato Y, Suzuki T, Yoshida Y, et al: Catheter ablation in children and patients with congenital heart disease: Review of 1021 procedures at a high-volume single center in Japan. Heart Rhythm 2020; 17: 49–55
3) 高尾篤良,他:臨床発達心臓病学 改訂第3版.中外医学社,2001
4) Wood FC, Wolferth CC, Geckeler GD: Histologic demonstration of accessory muscular connections between auricle and ventricle in a case of short P-R interval and prolonged QRS complex. Am Heart J 1943; 25: 454–462
5) Öhnell RE: Pre-excitation, cardiac abnormality: Patho-physiological, patho-anatomical and clinical studies of excitatory spread bearing upon the problem of WPW (Wolff–Parkinson–White) electrocardiogram and paroxysmal tachycardia. Acta Med Scand Suppl 1944; 152
6) Janse MJ, Rosen MR: History of Arrhythmias: Basis and Treatment of Cardiac Arrhythmias. Springer Berlin Heidelberg, Berlin, Heidelberg, 2006, pp1-39
7) Aoki H, Nakamura Y: Asymptomatic latent Wolff–Parkinson–White syndrome detected during school heart screening: A case report. Cardiol Young 2022; 32: 1681–1684
8) Nogami A, Kurita T, Abe H, et al: JCS/JHRS Joint Working Group: JCS/JHRS 2019 guideline on non-pharmacotherapy of cardiac arrhythmias. J Arrhythm 2021; 37: 709–870
9) Cohen MI, Triedman JK, Cannon BC, et al: Pediatric and Congenital Electrophysiology Society (PACES); Heart Rhythm Society (HRS); American College of Cardiology Foundation (ACCF); American Heart Association (AHA); American Academy of Pediatrics (AAP); Canadian Heart Rhythm Society (CHRS): PACES/HRS expert consensus statement on the management of the asymptomatic young patient with a Wolff–Parkinson–White (WPW, ventricular preexcitation) electrocardiographic pattern: Developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology Foundation (ACCF), the American Heart Association (AHA), the American Academy of Pediatrics (AAP), and the Canadian Heart Rhythm Society (CHRS). Heart Rhythm 2012; 9: 1006–1024
10) Arruda MS, McClelland JH, Wang X, et al: Development and validation of an ECG algorithm for identifying accessory pathway ablation site in Wolff–Parkinson–White syndrome. J Cardiovasc Electrophysiol 1998; 9: 2–12
11) Yoshida S, Suzuki T, Yoshida Y, et al: Feasibility and safety of transseptal puncture procedures for radiofrequency catheter ablation in small children weighing below 30 kg: Single-centre experience. Europace 2016; 18: 1581–1586
12) Venkatachalam KL, Herbrandson JE, Asirvatham SJ: Signals and signal processing for the electrophysiologist: Part II: Signal processing and artifact. Circ Arrhythm Electrophysiol 2011; 4: 974–981
13) 青木寿明,中村好秀,福原 仁,ほか:小児期WPW症候群に対する経皮的高周波カテーテルアブレーションの長期にわたる治療成績.日小児循環器会誌2013; 29: 331–338
14) Kirsh JA, Gross GJ, O’Connor S, et al: Cryocath International Patient Registry: Transcatheter cryoablation of tachyarrhythmias in children: Initial experience from an international registry. J Am Coll Cardiol 2005; 45: 133–136
15) Poh CL, Zannino D, Weintraub RG, et al: Three decades later: The fate of the population of patients who underwent the Atriopulmonary Fontan procedure. Int J Cardiol 2017; 231: 99–104
16) Miyazaki A, Sakaguchi H, Ohuchi H, et al: The clinical course and incidence of supraventricular tachyarrhythmias after extra-cardiac conduit Fontan procedures in relation to an atrial situs. Circ J 2011; 75: 413–420
17) 青木寿明,中村好秀,武野 亨,ほか:心外導管を用いたFontan術後の頻脈性不整脈に対して経皮的心外導管穿刺でカテーテルアブレーションを行い成功した4例.日小児循環器会誌2014; 30: 592–596
18) Uhm JS, Kim NK, Yu HT, et al: A stepwise approach to conduit puncture for electrophysiological procedures in patients with Fontan circulation. Europace 2018; 20: 1043–1049
19) Moore JP, Gallotti RG, Tran E, et al: Ten-year outcomes of transcaval cardiac puncture for catheter ablation after extracardiac Fontan surgery. Heart Rhythm 2020; 17: 1752–1758
20) Smith A, Ho SY, Anderson RH, et al: The diverse cardiac morphology seen in hearts with isomerism of the atrial appendages with reference to the disposition of the specialised conduction system. Cardiol Young 2006; 16: 437–454
21) 黒澤博身:心臓外科の刺激伝導系.東京,医学書院,2013
22) Aoki H, Nakamura Y, Takeno S, et al: A new procedure for a trans-conduit puncture by grasping the dilator tip with a snare catheter: An alternative access method during catheter ablation of supraventricular tachycardias after an extracardiac Fontan operation. Heart Rhythm 2014; 11: 1492–1494
23) 青木寿明:小児アブレーション TCPCバッフルへ穿刺ができない.東京,Medical View,2017
24) Eisenberger M, Fox DJ, Earley MJ, et al: Atrioventricular node reentrant tachycardia ablation in a patient with congenitally corrected transposition of the great vessels using the CARTO mapping system. J Interv Card Electrophysiol 2007; 19: 129–132
25) Tada H, Nogami A, Naito S, et al: Selected slow pathway ablation in a patient with corrected transposition of the great arteries and atrioventricular nodal reentrant tachycardia. J Cardiovasc Electrophysiol 1998; 9: 436–440
This page was created on 2024-11-14T16:26:30.533+09:00
This page was last modified on 2024-12-20T19:19:55.000+09:00
このサイトは(株)国際文献社によって運用されています。