胎児心機能評価:胎児心不全Evaluation of Fetal Cardiac Function and Dysfunction
順天堂大学産婦人科Department of Obstetrics and Gynecology, Juntendo University Faculty of Medicine ◇ Tokyo, Japan
心不全とは心臓のポンプ機能が低下し,全身の臓器に必要とする酸素が供給できない状態とされる.胎児心不全の場合胎児水腫を認めることが多いが,胎児水腫=胎児心機能低下ではない.胎児の全身状態を評価する際には胎児循環や胎児の生理学的な特性を念頭に置く必要がある.胎児心機能の評価方法はさまざまあり,収縮能や拡張能を交えて総合的に評価するが,その一つにCVPスコアがある.胎児心機能だけでなく,動静脈ドプラを組み合わせていることがその特徴である.また胎児心不全に至った原因により病態生理に合わせた項目を選択し評価する必要がある.例えば高拍出性心不全では心拍出量が鍵となり,エブスタイン病では左室のTei indexや三尖弁逆流の最大血流速度などが重要となる.どの疾患においても胎児水腫が完成する前の娩出が望まれるものの胎児の未熟性との兼ね合いを考慮し,生後の治療を念頭においた総合的な周産期管理が望まれる.
Fetal cardiac dysfunction differs from that in adults. Fetal hydrops is the last stage of fetal cardiac dysfunction; however, cardiac dysfunction does not necessarily occur simultaneously with fetal hydrops. A profound knowledge of fetal circulation and physiology is essential for comprehending the complexities of the fetal condition. Of the several parameters for evaluating fetal systolic, diastolic, and overall cardiac function, cardiovascular profile score (CVPS) is the most prominent. This score includes both arterial and venous Doppler patterns, in addition to fetal cardiac function. Assessment of each condition necessitates consideration of fetal physiology and etiology. In cases of high output status, cardiac output is the key factor, whereas conditions, such as Ebstein’s disease warrant attention to the Tei index and maximum velocity of tricuspid regurgitation. Proactive management of infants before the onset of fetal hydrops is preferable, notwithstanding the simultaneous concern of prematurity.
Key words: fetal cardiac failure; fetal cardiac function; fetal echocardiography
© 2024 特定非営利活動法人日本小児循環器学会© 2024 Japanese Society of Pediatric Cardiology and Cardiac Surgery
胎児循環は胎児期特有の動脈管と卵円孔という生理的シャントをもち,胎盤で酸素化された血液の55%は臍帯静脈から静脈管を経由して下大静脈(inferior vena cava: IVC),卵円孔から左心房を経て左心室,大動脈へと循環する.また酸素化されていない残りの肝静脈からの血流と上半身から戻ってくる上大静脈からの血流は右心房に入り,三尖弁を通って右心室,肺動脈へと循環する.肺へはほとんど血液が流入せずに動脈管を通って下行大動脈へと流入する.結果的に両心室から並行して体循環へと流れていくが,最も酸素濃度が高い血液は脳と冠循環に供給される.右室の下流には胎盤血流があり,左室の下流には胎児の頭部血流があると考えられる.胎児循環の病態生理を考えるうえで前負荷,後負荷,心収縮力,心室の硬さ,心拍数は必要な要素となるため,upstream, downstreamの血管抵抗との関係性を考慮することが必要となる.そのため心臓を中心としたさまざまなレベルでのドプラによる評価は胎児心機能評価の大切な一部を担う.
胎児心不全には,現状で明確な診断基準はない.通常心不全とは心臓のポンプ機能が低下し,全身の臓器に必要とする酸素が供給できない状態とされる.胎児心不全の場合,胎児水腫を認めることが多いが,胎児水腫=胎児心機能低下ではない.胎児水腫は胎児の皮下,胸腔,腹腔,心嚢のいずれか2カ所以上に液体貯留を来す状態であるが,胎児の循環不全を示す.胎児水腫を来す原因は多様であり,心機能が保たれた状態でも胎児水腫を認めることはあり,胎児生理学的な背景が重要となる.羊の実験ではあるが,胎児のリンパ還流は中心静脈圧10 mmHg前後では0.50 mL/minで正常に流れているものの,中心静脈圧11.5±0.6 mmHgまで上昇するとリンパ還流は止まってしまう.中心静脈圧とリンパ還流は負の相関関係にあり,中心静脈圧が1 mmHg上昇するとリンパ還流は12.7%ほど減少する.そのため胎児のリンパ還流は中心静脈圧に敏感で,中心静脈圧の上昇は容易に胎児水腫を来すことにつながる1).
また胎児の心筋は未熟であり,妊娠週数を通して成熟していくといわれている.成人心筋細胞は15~25 micronsであるが,胎児心筋細胞は5~7 micronsと小さな細胞からなり,カルシウムの貯蓄が少ない2).胎児の心筋のエネルギー源はブドウ糖であるが,大人では脂肪酸が主なエネルギーとなる.ただ心筋細胞の配列は粗であるが,2020年京都大学のグループにより心筋の構造や繊維配向は妊娠8週以降には成人のものと同等であることが証明された3).胎児心臓の仕事量増加は細胞数の増加を伴う心筋の過形成につながるが,出生後は細胞サイズの増大や心筋の肥厚が主となる.こうした心筋の違いは胎児の生理的な心機能に影響する.さらに胎児期において前負荷の減少は心拍出量の減少につながるが,心房圧の上昇は心拍出量の増加には至らない.出生後は心房圧の上昇とともに心拍出量の増加を認める.胎児期の後負荷の増大は心収縮力や心拍出量の低下につながる.上限はあるものの,胎児期にもFrank–Starlingの法則が存在する4).
胎児心不全を来す原因はTable 1に示すようにさまざまであるが,原因の鑑別にも胎児の状態の評価にも胎児心機能評価は大きな役割を果たす.ただ原因疾患の背景にある病態生理を考慮し,適する指標を用いることが胎児では重要と考える.本論文ではまず一般的な胎児心機能評価の指標を示し,疾患による評価方法を次に示す.
| 胎児循環の障害 | 先天性心疾患 |
| ・卵円孔閉鎖 | ・重症大動脈弁狭窄 |
| ・動脈管早期閉鎖 | ・Ebstein病 |
| ・静脈管欠損 | ・重症な房室弁逆流 |
| 高拍出性心不全 | ・重症な半月弁機能不全 |
| ・胎児貧血 | ・肺動脈弁欠損を伴うファロー四徴症 |
| ・TTTSの受血児 | ・重度な三尖弁逆流を伴う肺動脈弁閉鎖 |
| ・動静脈奇形 | ・心室機能不全を伴う単心室 |
| ・仙尾部奇形腫 | 胎児不整脈 |
| 心臓の圧迫による | ・頻脈性不整脈(SVT, AF, VTなど) |
| ・CPAM | ・徐脈性不整脈(CAVB) |
| ・CDH | 後負荷の変化 |
| ・心臓腫瘍 | ・胎児発育不全 |
| ・原発性胎児胸水 | ・TTTSの供血児 |
| 原発性心筋の異常 | |
| ・心筋炎 | |
| ・心原性ミオパチー | |
| AF=心房粗動,CAVB=完全房室ブロック,CDH=先天性横隔膜ヘルニア,CPAM=先天性肺気道奇形,SVT=上室性頻拍,TTTS=双胎間輸血症候群,VT=心室頻拍. | |
一番簡易に行えるのが心拡大の評価である.スクリーニングとして使用できるのがTCD(total cardiac dimension; Fig. 1a)である.三尖弁と僧帽弁の付着部位の心外膜外側を直線的に計測する.妊娠22週以降ではほぼ週数mmと考えることができるため簡易に利用される.経時的な心拡大の評価には心胸郭面積比CTAR(cardio-thoracic area ratio; Fig. 1b)が適している.心臓の面積は心外膜のトレースを,胸郭の面積は皮膚や筋肉を含まない肋骨や脊柱を含む部分をトレース(あるいはellipse法)で計測する.正常値は20~35%である.
心室流入/流出路波形:Fig. 2に示すように左心室流入/流出路波形では収縮能と拡張能両方の情報が含まれている.等容収縮時間(isovolumetric contraction time: ICT)は妊娠週数を通して横ばいで正常値27~34 msec,等容拡張時間(isovolumetric relaxation time: IRT)は妊娠後期に向けて軽度上昇するが正常値25~40 msecであり,45 msec以上を示す場合には延長と評価する5).Tei indexあるいはMPI(myocardial performance index)はICTとIRTの両方の要素が入っているため,心室機能の総合的な評価に使用される.心室流入血流の終了から再開までの時間(a)から心室駆出時間(b)を除した値(=a−b)はICTとIRTを合わせたものになる.心室駆出時間に対するICT+IRTがMPIとなる((a−b)/b).右心室のMPIは流入血流と駆出血流を同時計測できないため,aとbを別々に計測して算出する.正常値は0.38~0.45といわれているが,心機能異常により延長する.
E=early diastole, A=atrial contraction, S=ventricular systole. ICT, isovolumic contraction time; IRT, isovolumic relaxation time
心拍出量(combined cardiac output: CCO):胎児の半月弁(大動脈弁,肺動脈弁)の弁輪径(cm)と弁直上の流出路波形のvelocity time index(VTI: cm),胎児心拍数から計測する. で左右のCOを計測し,胎児の推定体重で割った場合には425~433 mL/min/kgと妊娠週数に影響を受けない値とされている6, 7).報告によりばらつきはあるものの,RCO=0.000148×GA4.283034(SD=0.000131×GA4.026209),LCO=0.000514×GA3.790944(SD=0.000169×GA3.815546)で計算される7).胎児期のCOは右室優位とされ,左室の1.4~1.5倍である.VTIは角度に依存するためできるだけ血流とドプラビームの角度を一致させ,角度補正は20°以内とする.
静脈血流:本章の冒頭で中心静脈圧の上昇が胎児循環に与える影響を述べた.中心静脈圧の上昇を直接波形で確認できるのが胎児の静脈波形である.中心静脈圧の上昇により心室拡張末期の心房収縮の際に逆行性血流が生じ,心房波形(a波)の上昇につながる.下大静脈のa波はpreload index(PLI)として用いられており,心室収縮期の流入血流速度(s)に対する心房収縮期の逆流血流速度(a)で算出される(PLI=a/s).PLI>0.50で異常値となる.静脈管の血流ではpulsatility index(PI)の上昇,a波の途絶や逆流と,胎児のwell-beingの悪化との関係性が提示されている.産科領域では頻繁に使われる指標であるが,先天性心疾患においては右室閉塞性疾患の場合,解剖学的な変化が逆流波形につながることもあり,病態を考慮した評価が必要となる.
臍帯静脈血流では通常連続した波形を呈するが,中心静脈圧の上昇により心房収縮に一致するnotchが認められるようになり,pulsationに至る.
動脈血流:直接的な心機能ではないが,胎児の全身状態を評価するにあたり重要な胎児動脈血流にも言及しておく.臍帯動脈(umbilical artery: UA)は胎児の循環不全や胎盤機能不全により,血管抵抗の上昇によるPIの上昇から始まり,拡張期血流の途絶や逆流を認める.中大脳動脈(middle cerebral artery: MCA)の血流では胎児貧血の際に最大血流速度(MCA-PSV)の上昇を認めることで胎児心拡大の原因解明につながることがある.また胎児が低酸素状態になった際には重要な脳を守るように頭部の血管抵抗は低下し,MCA-PIの低下に至る.UAとMCAの血流を比で表したcerebral placental ratio(CPR)で評価されることが多く,CPR=MCA-PI/UA-PI<1.1で,血流の再分配が起こっていることを評価できる.
小児や成人で評価されるその他の心機能マーカーも胎児に応用され,より詳細に胎児心機能を評価するように検討されている.
心室内径短縮率(fractional shortening: FS):胎児心臓の収縮能としてMモードを用いて四腔断面で房室弁付着部直下にカーソルを設定し心室壁の動きを記録し,心室内腔の拡張末期径と収縮末期径の差を拡張末期径で除することで計算される心室内径短縮率(fractional shortening: FS; Fig. 3)がある.正常値は0.28~0.40で,妊娠後期に軽度減少するという報告8)と週数によらず一定であるとする報告9)がある.
Cardiovascular profile score(CVPS; Table 2):Huhtaらが提唱した胎児心不全徴候のある児の予後評価を行うのに使用される指標であり,胎児水腫の有無,心臓のサイズ,心機能評価,静脈血流,動脈血流の項目からなる11).各カテゴリーは2点で10点満点となり,点数が低いほど予後不良とされている.本邦からも先天性心疾患や胎児不整脈の症例において心不全マーカーであるNT-proBNPとCVPSとの相関を示しており,CVPS≤7では臍帯静脈血中のNT-proBNPの有意な上昇を報告している12).
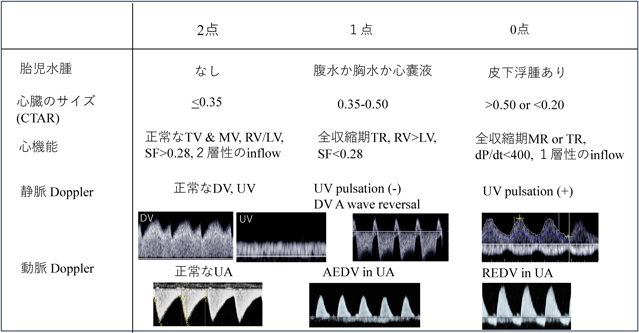 |
| AEDV, absent endo-diastolic velocity; DV, Ductus venosus; LV, left ventricule; MR, mitral regurgitation; MV, mitral valve; REDV, reverse endo-diastolic velocity; RV, right ventricle; SF, systolic fraction; TR, tricuspid regurgitation; TV, tricuspid valve; UA, umbilical artery; UV, umbilical vein Huhta10)より引用. |
組織ドプラ法(tissue Doppler imaging: TDI):組織ドプラ法による拡張早期僧帽弁輪最大移動速度(e′)は左室弛緩能の指標とされている.左室流入血流速波形のE波は左房圧と左室弛緩能の両者の影響を受けて二相性に変化するが,これを左室弛緩能と一方向性に相関するe′で除したE/e′は左房圧と直線的に相関し,平均左房圧の推定に用いられる.ここでは従来法(Fig. 4a)と同時計測法(Fig. 4b)について示す.組織ドプラは角度依存性のため,できるだけドプラビームに心室壁が直線的に入るように画像を記録する.胎児においても多用されており,双胎間輸血症候群の受血児13)や重症な胎児発育不全においてE/e′の上昇が報告されている14).
Speckle tracking(global longitudinal strain, strain rate):壁運動の定量化として成人や小児でも使用され,ストレインは心室の長軸方向の収縮機能指標で,特にGLS(global longitudinal strain)は心室全体の収縮性の指標である(Fig. 5).ストレインレート(global longitudinal strain rate: GLSR)はストレイン指標に時間の概念を加え,心筋の拡張能の指標となる.組織ドプラ法とは異なり,角度依存性がないため,明確な四腔断面の描出により計測が可能な点は優れている.胎児では心拍数が速いため,可能な限り高いframe rateでの撮像が望まれる.正常胎児におけるGLSやGLSRの変化を報告したものは散見されるが,さまざまな要因の影響を受けるために未だ一定の見解は得られていない.週数とともに低下としている研究15, 16)が多く,2022年に報告された124例の胎児の縦断研究では週数とともにGLSは低下し,右GLS=−24.57+0.2074×週数,左GLS=−26.73+0.2024×週数としている15).
房室弁輪収縮期移動距離:三尖弁輪収縮期移動距離(tricuspid annular plane systolic excursion: TAPSE)は,三尖弁輪右室自由壁惻の長軸方向の移動距離をMモード法で計測することで収縮能を評価する.胎児ではカーソル上に平行に三尖弁の移動距離がくるようにして計測する.正常値は21週で4.48 mm,39週で8.9 mmと週数に相関する17).
僧帽弁輪収縮期移動距離(mitral annular plane systolic excursion: MAPSE)も同様にして計測する.正常値はTAPSEと同様,21週で3.17 mm,39週で6.06 mmと週数に相関する17).
胎児の高拍出性心不全の場合,心拡大がきっかけとなって原因となる疾患が診断されることもある.胎児貧血が原因となる場合にはMCA-PSVの上昇を認める.動静脈奇形や血管腫,仙尾部奇形腫などは原因となる部位にカラードプラで豊富な血流を認める.高拍出性の場合には心不全といいながらも胎児心機能自体は保たれていることが多い.そのため代償できている間は心機能の評価項目に変化は認めない.CCOが症状の進行に鋭敏といわれていて,700–800 mL/min/kgを超えてくると胎児水腫のリスクが上昇する18).胎児の全身状態を評価する目的で静脈管のPIの上昇が参考になるという報告もある19).SCTの検討では下大静脈の増大(>6 mm)や600 mL/min/kg以上のCCOの増大が早期での心不全を検出できる可能性がある20). Fig. 6にAltman type IのSCTの症例を提示している.本症例は妊娠19週で腫瘍体積/胎児体重比が0.34(>0.12)であり,予後不良が予測されていた(Fig. 6a).妊娠25週でCTAR=51%, CCO>800 mL/min/kg, IVC=5.9 mm(Fig. 6b, c)であり,左室のMPIをはじめとした心機能や胎児の動静脈血流は保たれていた(Fig. 6d, e)が,ちょうどこの時点から皮下浮腫を認め始め,胎児水腫の傾向を呈した.
TTTSの受血児では供血児からの血液とレニン,アンギオテンシン,アルドステロンなどの血管作動性のホルモン(RAASホルモン)の移行を受けて,前負荷・後負荷が共に増大する.胎盤の吻合血管を遮断することで循環動態を改善させるfetoscopic laser photocoagulation(FLP)による胎児治療で,周産期予後は劇的に改善してきている.TTTSのステージ診断においては羊水量や臍帯動脈や静脈管といった動静脈ドプラ,胎児水腫の有無が評価項目となっているが,治療の前後においても胎児の循環動態は大きく変化するため,胎児の心機能評価は重要となる.特に拡張能の評価が循環動態の改善を鋭敏に捉えることが知られており,受血児でのMPIの上昇やIRTの延長,E/e′の上昇,また静脈管のS波のtime velocity integralの変化21, 22)などが報告されている(Fig. 7).また同時にFLP後のMPIの減少,MAPSEやTAPSEの増大も報告されている23).
頻脈性不整脈の場合,持続的な頻脈は胎児水腫につながる.上室性頻拍の場合は心房と心室が1 : 1で伝導し,心拍数220~240 bpmとなる.心房粗動の場合は心房が300~600 bpmで拍動し,房室間が1 : 2や1 : 3で伝導するため,大体心室220~240 bpmとなる.心機能としては速い心拍数がfilling timeの短縮や拍出時間の短縮となり,心房圧の上昇,心室圧の上昇につながり,energy lossや心機能不全に至る.心房ペーシングを行った動物モデルにおいても,胎児心筋のエネルギー源であるグルコース貯蔵がなくなることによる機能不全を来すことを証明した4).徐脈性不整脈の場合,完全房室ブロック(CAVB)は胎児水腫のハイリスクとなるが,心拍数55 bpmより低下するとそのリスクが高まる.通常1回拍出量を増加させることで心拍出量を代償するが,心拍出量の計算式からもわかるように心拍数自体が一定以上低下すると,1回拍出量の増加だけでは代償できなくなり,胎児水腫に至る.Fig. 8では心室心拍49 bpm,右室のstroke volumeが本来の4倍以上となり,胎児水腫に至った胎児の心拍出量を示した.胎児期では右室優位の循環であり,右室のstroke volumeが左室よりも優位に上昇して徐脈を代償しているのが印象的である.胎児不整脈では,通常の動静脈ドプラや心室流入血流を使用しての心機能評価が難しく,客観的評価が困難であることが多い.
A=心房rate, V=心室rate. LCO, left cardiac output; RCO, right cardiac output; SV, stroke volume
Original graph: Mielke and Benda6)
胎児循環においては流入と流出が少なくとも1本ずつ保たれていれば,いかなる構造異常があっても子宮内で問題となることはない.Table 1に示された疾患群はそのin-outのバランスが崩れることにより心不全を来す.あるいは疾患に伴った心筋の異常を伴うことで機能不全に至る.
Ebstein病は三尖弁の中隔尖の下方付着により,三尖弁逆流に伴う右房拡大や右心負荷が胎児期より問題となり,胎児水腫を来すリスクの高い先天性心疾患(Fig. 9a)である.海外ではNSAIDsを使用した胎児治療も報告されている24)が,本邦では胎児治療の適応に至っていない.胎児治療を検討する可能性のある疾患として,胎児心機能を評価することは重要である.心拡大CTARの評価(Fig. 9b)は言うまでもないが,三尖弁逆流の最大血流速度を計測し,心室圧を推定することで右室の残存する心機能を評価する.dP/dtはCVPSにも使用されているが,収縮能を反映する(Fig. 9c).簡易ベルヌーイの式から算出され,dP/dt=(2.52–0.52)×4/時間(秒)=24/時間(秒)で求めることができる.正常値は800 mmHg/s以上であり,400 mmHg/s以下は重度の収縮不全があると考える25).2023年に本邦からの報告で,dP/dT≧350 mmHgかつ三尖弁逆流最大血流速度≧2.9 m/sでは出生後の両心室修復を予測できるとしている26).また拡大した右房による圧迫で左室機能不全を来すこともあるため,左室のMPIを評価(Fig. 9d)することが有用とする報告もある.Ebstein病の予後予測を評価する報告は散見され,TorigoeらはMPIと三尖弁逆流の最大血流速度を取り入れたTRIPP scoreの有用性も提示している27).また動静脈ドプラ(Fig. 9e)では臍帯動脈の途絶や逆流,臍帯静脈血流の減少は独立した周産期予後に影響を与える因子として提示されている28).
TR=三尖弁逆流.CTAR, cardiothoracic ratio; ICT, isovolumetric contraction time; IRT, isovolumetric relaxation time; MPI, myocardial performance index
重症大動脈弁狭窄(critical aortic stenosis: CAS)は大動脈弁狭窄により,著明な僧帽弁逆流を呈し,左房の拡張を来す.左室の後負荷の上昇により,左室の収縮能と拡張能異常を来し,心不全や胎児水腫に至る可能性の高い疾患(Fig. 10a)である.超音波所見としては著明な心拡大を来し(Fig. 10b),大動脈弁順行性通過血流速度の上昇(Fig. 10c),僧帽弁逆流(mitral regurgitation: MR; Fig. 10d)を認める.MRが3.14 m/s以上であれば,胎児治療の大動脈弁バルーン拡張術を行い生後の2心室循環に移行できる可能性が高いという報告があり29),CASの予後指標の一つである.またMRまたは大動脈流出路最大収縮期圧較差20 mmHg以上が本邦の胎児治療の適応基準にもなっている.拡張障害として,filling timeが短縮するため,症状が進行すると1層性のinflow patternとなる.本症例でCVPSを計算すると,皮下浮腫と心嚢液の貯留による胎児水腫で−2点,CTAR=61.5%で−2点,全収縮期のMRで−2点,静脈管の逆流で−2点,正常な臍帯動脈で2点のため,合計2点であり,予後はかなり厳しいという予測になる(Fig. 10a–f).また肺静脈ドプラーは左房圧を反映していると考えられており,a波の逆流やs波とd波の間のpulsationを考慮すると,左房圧が上昇していることが推測される(Fig. 10g).
重症な先天性横隔膜ヘルニアや先天性肺気道奇形のような心臓を著しく圧排するような病変や心臓腫瘍,原発性胎児胸水のような病態では心臓の直接の圧迫や静脈還流を著しく阻害し,心臓のfilling timeを短縮し,十分な還流ができずに心拍出量が保てなくなり胎児水腫を引き起こす可能性がある.
原発性両側の胎児胸水(Fig. 11a)の場合,心外腔の著しい圧迫によりCTARは縮小する(Fig. 11b).心機能はfilling timeの短縮や循環不全に伴う動静脈ドプラの変化を認める.心機能自体は保たれるものの,胸腔内圧の上昇のためか循環虚脱が引き起こされるといわれており,終末期の現象として臍帯静脈還流量(UV flow volume: UVFV)の著しい減少を認めることがある.UVFVは(臍帯静脈径(cm)/2)2×臍帯静脈最大血流速度(cm/s)×0.5×3.14×60で計測されるが30),推定体重で補正した平均値は週数によらず110 mL/min/kgと報告されている.そして約2.5%centileである50 mL/min/kg以下を低容量流入性の循環虚脱を疑っていき,胎児治療を行っても効果が得られない可能性があるといわれている31).Fig. 11に示した症例は両側胎児胸水を認め,著明な皮下浮腫と腹水を認めており,UAの逆流(Fig. 11c)を認めていたものの心機能は保たれており,Tei indexやfilling patternも2層性で保たれていた(Fig. 11d).UVFVは97 mL/min/kgであり(Fig. 11e),胎児胸腔羊水腔シャントによる胎児治療を施行し,症状が改善した一例である.
胎児心不全は妊娠週数や胎児循環を考慮して,病態を考えながらその病態に見合った評価を行わなければならない.そのため胎児心不全は一言では言い表すことが難しいが,どの疾患においても胎児水腫が完成する前の娩出が望まれるものの胎児の未熟性との兼ね合いを考慮し,生後の治療を念頭においた総合的な周産期管理が望まれる.
本稿に関して開示すべき利益相反はない.
1) Brace RA: Effects of outflow pressure on fetal lymph flow. Am J Obstet Gynecol 1989; 160: 494–497
2) Shapiro LJ: American Pediatric Society John Howland Award 1999: Presentation to Abraham Morris Rudolph, MD(1). Pediatr Res 2001; 49: 11–17
3) Nishitani S, Torii N, Imai H, et al: Development of helical myofiber tracts in the human fetal heart: Analysis of myocardial fiber formation in the left ventricle from the late human embryonic period using diffusion tensor magnetic resonance imaging. J Am Heart Assoc 2020; 9: e016422
4) Huhta JC: Congestive heart failure in the fetus, in Yagel S, Silverman NH, Gembruch U (eds): Fetal Cardiology 2nd Ed. Informa Health Care, New York, pp 561–578
5) Hernandez-Andrade E, Figueroa-Diesel H, Kottman C, et al: Gestational-age-adjusted reference values for the modified myocardial performance index for evaluation of fetal left cardiac function. Ultrasound Obstet Gynecol 2007; 29: 321–325
6) Mielke G, Benda N: Cardiac output and central distribution of blood flow in the human fetus. Circulation 2001; 103: 1662–1668
7) Luewan S, Srisupundit K, Tongprasert F, et al: Z score reference ranges of fetal cardiac output from 12 to 40 weeks of pregnancy. J Ultrasound Med 2020; 39: 515–527
8) Nagasaki S, Nakata M, Takano M, et al: Measurement of fetal automated fractional shortening using two-dimensional tracking in multiple centers. J Med Ultrason 2021; 48: 83–90
9) DeVore GR: Assessing fetal cardiac ventricular function. Semin Fetal Neonatal Med 2005; 10: 515–541
10) Huhta JC: Right ventricular function in the human fetus. J Perinat Med 2001; 29: 381–389
11) Falkensammer CB, Paul J, Huhta JC: Fetal congestive heart failure: Correlation of Tei-index and Cardiovascular-score. J Perinat Med 2001; 29: 390–398
12) Miyoshi T, Umekawa T, Hosoda H, et al: Plasma natriuretic peptide levels in fetuses with congenital heart defect and/or arrhythmia. Ultrasound Obstet Gynecol 2018; 52: 609–616
13) Takano M, Nakata M, Nagasaki S, et al: Asymmetrical hemodynamic influence of twin-twin transfusion syndrome on fetal e/e′ by the dual gate doppler method in recipient twins. Fetal Diagn Ther 2020; 47: 261–267
14) Nestaas E, Bjarkø L, Kiserud T, et al: Heart function by M-mode and tissue Doppler in the early neonatal period in neonates with fetal growth restriction. Early Hum Dev 2023; 183: 105809
15) van Oostrum NHM, de Vet CM, Clur SB, et al: Fetal myocardial deformation measured with two-dimensional speckle-tracking echocardiography: Longitudinal prospective cohort study of 124 healthy fetuses. Ultrasound Obstet Gynecol 2022; 59: 651–659
16) Matsui H, Germanakis I, Kulinskaya E, et al: Temporal and spatial performance of vector velocity imaging in the human fetal heart. Ultrasound Obstet Gynecol 2011; 37: 150–157
17) Lee-Tannock A, Hay K, Gooi A, et al: Longitudinal reference ranges for tricuspid annular plane systolic excursion and mitral annular plane systolic excursion in normally grown fetuses. J Ultrasound Med 2020; 39: 929–937
18) Rychik J: Frontiers in fetal cardiovascular disease. Pediatr Clin North Am 2004; 51: 1489–1502, vii
19) Neubert S, Trautmann K, Tanner B, et al: Sonographic prognostic factors in prenatal diagnosis of SCT. Fetal Diagn Ther 2004; 19: 319–326
20) Wilson RD, Hedrick H, Flake AWJ, et al: Sacrococcygeal teratomas: Prenatal surveillance, growth and pregnancy outcome. Fetal Diagn Ther 2009; 25: 15–20
21) Degenhardt J, Reinold M, Enzensberger C, et al: Short-time impact of laser ablation of placental anastomoses on myocardial function in monochorionic twins with twin-to-twin transfusion syndrome. Ultraschall Med 2017; 38: 403–410
22) Takano M, Nakata M, Nagasaki S, et al: Prediction of twin-to-twin transfusion syndrome using characteristic waveforms of ductus venosus in recipient twins. Twin Res Hum Genet 2020; 23: 292–297
23) Wohlmuth C, Boudreaux D, Moise KJ Jr., et al: Cardiac pathophysiology in twin-twin transfusion syndrome: New insights into its evolution. Ultrasound Obstet Gynecol 2018; 51: 341–348
24) Torigoe T, Mawad W, Seed M, et al: Treatment of fetal circular shunt with non-steroidal anti-inflammatory drugs. Ultrasound Obstet Gynecol 2019; 53: 841–846
25) Huhta JC: Guidelines for the evaluation of heart failure in the fetus with or without hydrops. Pediatr Cardiol 2004; 25: 274–286
26) Ikegawa T, Kim KS, Kawataki M, et al: Late-gestation prediction of outcome in tricuspid valve dysplasia and Ebstein’s anomaly using fetal tricuspid regurgitation waveform analysis. Ultrasound Obstet Gynecol 2023; 61: 593–600
27) Torigoe F, Ishida H, Ishii Y, et al: Fetal echocardiographic prediction score for perinatal mortality in tricuspid valve dysplasia and Ebstein’s anomaly. Ultrasound Obstet Gynecol 2020; 55: 226–232
28) Wang S, Freud LR, Detterich J, et al: Extracardiac Doppler indices predict perinatal mortality in fetuses with Ebstein anomaly and tricuspid valve dysplasia. Prenat Diagn 2021; 41: 332–340
29) Tulzer A, Arzt W, Gitter R, et al: Valvuloplasty in 103 fetuses with critical aortic stenosis: Outcome and new predictors for postnatal circulation. Ultrasound Obstet Gynecol 2022; 59: 633–641
30) Ozawa K, Kanazawa S, Mikami M, et al: Ultrasound measurement of umbilical venous flow volume at the intra-abdominal portion in normal fetuses. J Med Ultrason 2023; 50: 427–432
31) 高橋雄一郎:【胎児診断・治療の最前線】胎児治療 胎児胸水穿刺術・胎児胸腔-羊水腔シャント術(解説).周産期医学2017; 47: 531–534
This page was created on 2024-07-09T18:21:45.833+09:00
This page was last modified on 2024-09-09T13:31:13.000+09:00
このサイトは(株)国際文献社によって運用されています。