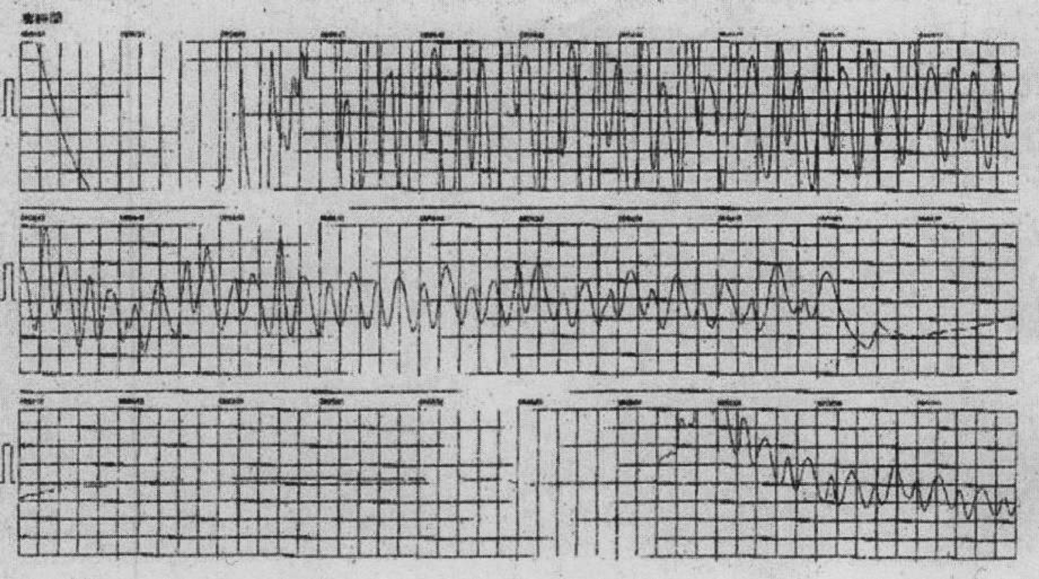
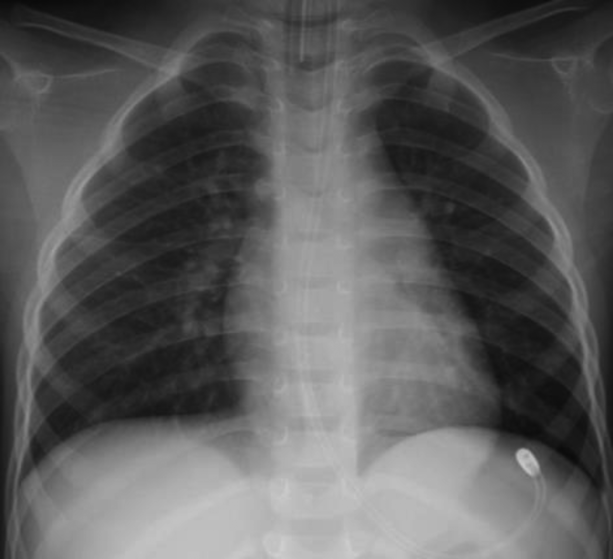
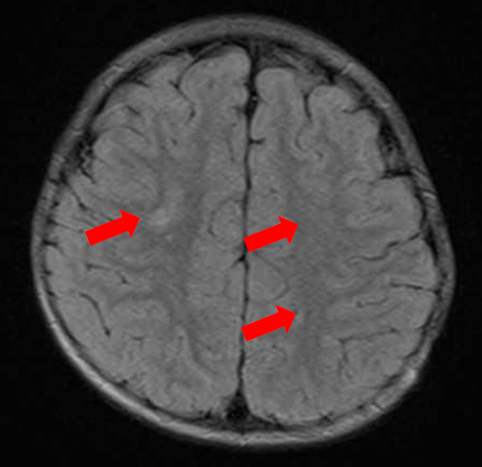
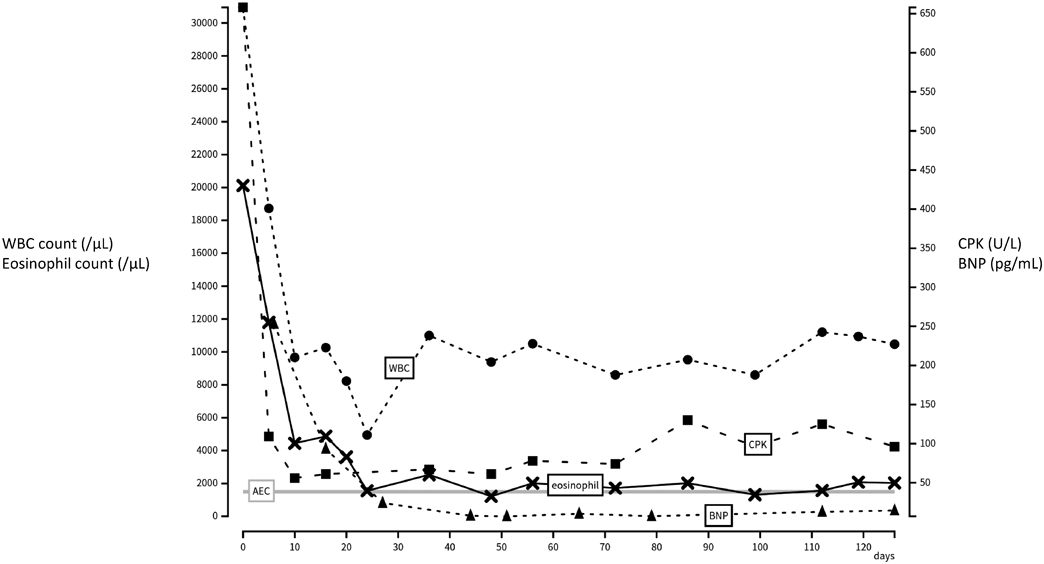
心室細動で発症した好酸球性心筋炎の1歳女児例Eosinophilic Myocarditis Presenting with Ventricular Fibrillation in a 1-Year-Old Girl
1 国立成育医療研究センター 循環器科Division of Cardiology, National Center for Child Health and Development ◇ Tokyo, Japan
2 国立成育医療研究センター 病理診断部病理診断科Division of Pathology, National Center for Child Health and Development ◇ Tokyo, Japan
3 国立成育医療研究センター 総合アレルギー科Division of Allergy, National Center for Child Health and Development ◇ Tokyo, Japan
4 国立成育医療研究センター 小児がんセンターChildren’s Cancer Center, National Center for Child Health and Development ◇ Tokyo, Japan