川崎病は,乳幼児期に好発する血管炎であり,冠動脈瘤(CAA, coronary artery aneurism)を予防するため適切な時期に免疫グロブリン療法(IVIG, intravenous immunoglobulin)を開始することが重要である.当科では川崎病が疑われる全症例に対して定期的な心エコー検査を行い,CAA評価に加えて冠動脈周囲炎,心外膜炎,心筋炎,左心機能および各弁逆流について評価している.冠動脈周囲炎については,冠動脈周囲輝度の上昇を参考とし,心筋炎については,僧帽弁閉鎖不全(MR, mitral regurgitation),左室拡張末期径(LVDd, left ventricular end-diastolic diameter),駆出率(LVEF, left ventricular ejection fraction)および心筋組織のエコー輝度上昇を,心外膜炎の強さについては心嚢液(PE, pericardial effusion)および心外膜組織のエコー輝度上昇を参考として評価している.そのなかで,入院経過中Zスコア(Z)が2.5以上の冠動脈拡張(以下,冠動脈拡張)を来す症例の多くに大動脈弁閉鎖不全(AR, aortic regurgitation)が認められる傾向があった.これまでも,CAA形成症例にARを合併するという報告がされているが1, 2),既報は慢性期症例を対象とした研究が主であり,冠動脈拡張に先行して出現するARについては検討されていなかった.また当院では,LVDd拡大や,MR増悪がみられる症例に対して,心血管系への負荷を軽減する目的で利尿薬を使用し,さらに高血圧を合併する症例に対しては降圧薬を使用している.しかし,容量負荷や高血圧が冠動脈拡張と関連するのか,我々が調べた限り統計学的に検討した研究は行われていなかった.以上を踏まえ,本研究ではルーチンで行われる心エコー所見が冠動脈拡張を予測する指標として活用できるか示唆を得るため,心エコー所見と冠動脈拡張の関連を検討することを目的とした.あわせて,血圧やその他冠動脈拡張リスクと考えられた因子についても冠動脈拡張との関連を検討した.冠動脈拡張リスク因子と示唆された心エコー所見については,その出現時期についても検討を行った.
解析対象
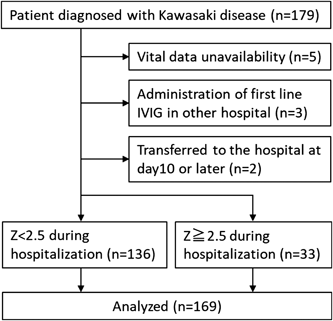
2017年4月から2020年3月までの間に,川崎病診断基準3)に則り,川崎病または不全型川崎病と診断され当院に入院した患者179例のうち,急性期のバイタルサインにおける記録が欠損していた5例,他院において初回IVIG治療を行われた3例,他院において感染症として治療され第10病日以降に当院に転院となった2例を除外した169症例を解析対象とした(Fig. 1).
倫理的配慮
本研究は,公益財団法人田附興風会医学研究所北野病院倫理委員会の審査承認を得て実施し(番号:2201017),病院ホームページへの記載によりオプトアウトの機会を設けた.
治療方法
1st lineは急性期に5%非修飾型静注用人免疫グロブリン製剤によるIVIG 2 g/kg(24時間投与),aspirin 30 mg/kg/day投与を行い,C-reactive protein (CRP)が概ね陰性化した後にaspirinを5 mg/kg/dayに減量した.なお,肝障害がある場合は,aspirinの代替薬としてflurbiprofen 5 mg/kg/dayを用いた.2nd lineは,初回IVIG終了後24時間以降も発熱が続く場合に1st lineと同様のIVIG, aspirin治療に加えて,methylprednisolone(30 mg/kg/dayを3日間投与),ulinastatin(5,000単位/kg/回,上限50,000単位/回を1日6回連日投与しCRP低下に合わせて漸減中止)により行った.3rd lineは定型的な方法はなく,該当した3症例のうち1例目はprednisolone 1 mg/kg/day, cyclosporin 4 mg/kg/day内服を,2例目,3例目はinfliximab 5 mg/kg単回投与を行った.冠動脈拡張を伴う33例のうち,1st lineのみで治療したのは18例,2nd lineまで施行したのが12例,3rd lineまで施行したのは3例であった.冠動脈拡張を伴わないのは136例のうち,1st lineのみで治療した102例,2nd lineまで施行した34例であった.入院期間中の心エコー検査について,評価頻度は症例により異なるが,概ね入院日,1st line IVIG開始日,2nd line IVIG開始日,さらに治療開始後は約1~3日に1回の頻度で評価を行った.
評価項目
本研究では,入院中の冠動脈拡張の有無を評価項目とした.2020年改訂版「川崎病心臓血管後遺症の診断と治療に関するガイドライン」4)および米国心臓協会のステートメント5)に基づき,Z≧2.5(発症30日以内に退縮したものを含む)を満たすものを冠動脈拡張と定義した.そのうち,発症30日以上経過してもZ≧2.5を満たすものをCAA(小瘤2.5≦Z<5,中等瘤5≦Z<10,巨大瘤10≦Z)と定義した.また実測値に基づく分類は,2003年改訂版「川崎病心臓血管後遺症の診断と治療に関するガイドライン」に基づき,発症30日以上経過しても4 mm≦内径を満たすものをCAA,そのうち,8 mm<内径を満たすものを巨大瘤と定義した6).さらに,冠動脈拡張のリスク因子となることが示唆された心エコー所見について,冠動脈拡張症例において川崎病発症日を起点(第1病日)としてそれらの心エコー所見が確認されるまでの日数を評価した.
心エコー所見の評価方法
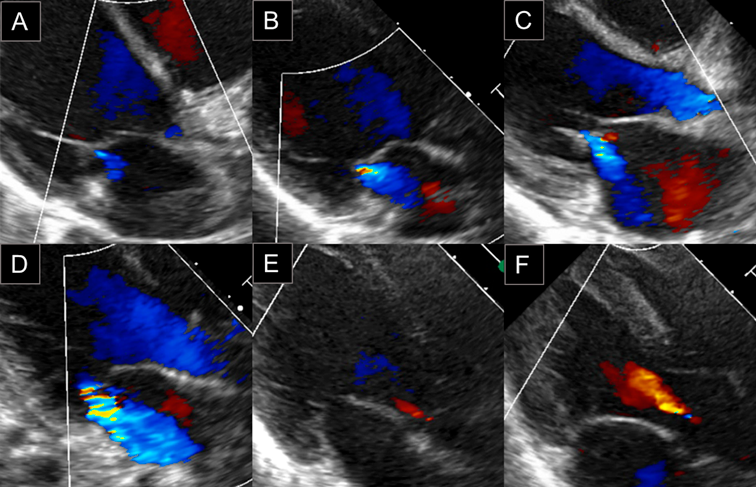
心エコー検査はPhilips EPIQ7を用い,全症例とも同一の小児循環器専門医の立ち会いのもと計測を行った.冠動脈の評価についてはZ score projectによるCoronary Z score Calculator Version 4.0を用い7),seg1, seg5, seg6, seg11のうちZが最大のものをZ maxとした.弁逆流の評価については,カラードプラをアーチファクトが出ない最大表示とした上で計測を行い,房室弁逆流では弁下部に限局し便宜上流速が計測できないものをtrace(Fig. 2A, 2B),カラーシグナルが心房後壁に達しないものをmild(Fig. 2C),カラーシグナルが心房後壁に達ししたものをmoderate(Fig. 2D),心房心室容量負荷がみられるものをsevereと定義した.肺動脈弁閉鎖不全(PR, pulmonary regurgitation)については,弁下部に限局しているものをtrace, traceとmoderateの間をmild,左右肺動脈で逆流が明らかのものをmoderate,右室容量負荷がみられるものをsevereと定義した.ARについては,弁下部に限局しているものをtrace(Fig. 2E),カラーシグナルが僧帽弁前尖を超えないものをmild(Fig. 2F),カラーシグナルが僧帽弁前尖を超えるものをmoderate,左房左室容量負荷がみられるものをsevereと定義した.三尖弁閉鎖不全(TR, tricuspid regurgitation),PRは通常でもtrace程度はみられることが多いため,経過中にmild以上となり退院約1か月後の外来で軽減したものを変化あり(+)とし,MR, ARは通常はみられないことが多いことから入院中にtrace以上で出現し退院1か月後の外来受診時に消失が確認できたものを変化あり(+)とした.PEは,水平断面,左室短軸断面,左室長軸断面の3方向で心臓全体をスキャンし,左室自由壁,右室自由壁の臓側心膜および壁側心膜の間に拡張期に1 mm以上で測定可能,もしくは心尖部に5 mm以上で測定可能な液貯留を認める場合に変化あり(+)とした.LVEFの算出には,左室短軸断面で計測した拡張末期径,収縮末期径を用いた.
統計学的解析
冠動脈拡張群と非拡張群の臨床的な患者背景について,連続変数(発症時月齢,初回IVIG開始病日,入院経過中のD-dimer最高値[D-dimer max],CRP最高値[CRP max],アルブミン最低値[Alb min],最大左室拡張末期径[%LVDd max],左室最低駆出率[LVEF min],最高収縮期血圧[sBP max, systolic blood pressure max])はデータの特性に応じてStudentのt検定またはMann–WhitneyのU検定による比較を行った.カテゴリ変数(性別,月齢<6か月の有無,群馬スコア8)≧5点の有無,不全型川崎病の有無,再発の有無,初回IVIG不応の有無,入院中心エコー検査で確認されたTR, PR, MR, AR, PEおよび%LVDd≧105%の有無)の比較にはFisherの正確検定を行った.冠動脈拡張に対する心エコー所見(MR, AR, PE, %LVDd)の関連の検討には,単変量および多変量ロジスティック回帰分析を用いた.CAA形成については,心エコー所見以外にもいくつかの臨床的背景がリスク因子となることが示唆されている4).本研究では冠動脈拡張症例が比較的少数であるため,多変量ロジスティック回帰分析では傾向スコアを用いてこれらの変数による影響を調整した.まず,Table 1に示された患者背景のうち,p<0.10を満たす項目を説明変数として各心エコー所見(MR, AR, PE, %LVDd≧105%)出現の有無を予測する傾向スコアを算出した(%LVDd maxについてはROC曲線を作成し,冠動脈拡張に対する感度,特異度の合計が最大となる105%をカットオフに設定した).次に,各心エコー所見(MR, AR, PE, %LVDd≧105%)出現の有無を説明変数,算出された傾向スコアを共変量として,冠動脈拡張の有無を目的変数とした多変量ロジスティック回帰分析を行った.さらに,冠動脈拡張の予測因子と示唆された心エコー所見の出現時期について検討するため,冠動脈拡張症例を対象として,各エコー所見の出現病日および冠動脈径が最大値に達した病日について中央値,第1,第3四分位点を算出した.さらに各エコー所見が冠動脈拡張(冠動脈径が最大化した際にZ≧2.5を超える)の予測因子として利用できるか検討するため,Z max記録病日以前に出現した各心エコー所見のみを対象に,Z max≧2.5に対する陽性適中率,感度,特異度を算出した.統計学的解析にはEZR Version 1.51を用いた.
Table 1 Characteristics and clinical outcome | | Dilation+
n=33 | Dilation−
n=136 | p value |
|---|
| Patient characteristics | Male gender | 14 (42%) | 72 (53%) | 0.333 |
| Age in month | 26 (11–42) | 31 (18–50) | 0.108 |
| Age of onset < 6 month | 6 (18%) | 7 (5%) | 0.022 |
| High risk in Gunma score (score≧5) | 18 (55%) | 61 (45%) | 0.337 |
| Incomplete Kawasaki disease | 4 (12%) | 22 (16%) | 0.788 |
| Recurrent Kawasaki disease | 5 (15%) | 7 (5%) | 0.059 |
| Clinical outcome | 1st line IVIG resistance | 15 (46%) | 34 (25%) | 0.031 |
| initiation date of first line therapy | 4 (2–5) | 5 (4–5) | 0.009 |
| sBP max | 122 (9.3) | 120 (8.9) | 0.295 |
| Albumin min | 3.2 (3.1–3.6) | 3.4 (3.1–3.6) | 0.663 |
| D-dimer max | 2.3 (1.4–3.5) | 2.6 (1.9–4.4) | 0.127 |
| CRP max | 5.5 (1.4–14.6) | 5.2 (1.2–12.6) | 0.556 |
| TR+ | 7 (21%) | 26 (19%) | 1 |
| PR+ | 1 (3%) | 0 (0%) | 0.195 |
| MR+ | 30 (91%) | 98 (72%) | 0.024 |
| AR+ | 23 (70%) | 23 (17%) | < 0.001 |
| PE+ | 22 (67%) | 34 (25%) | < 0.001 |
| %LVDd max | 105 (100–108) | 102 (91–105) | 0.001 |
| %LVDd≧105% | 27 (82%) | 73 (54%) | 0.003 |
| LVEF min | 0.61 (0.52–0.63) | 0.61 (0.46–0.63) | 0.688 |
Categorical variables are summarized as numbers and percentages and the Fisher’s exact test was used to compare between-group (Dilation+ or Dilation−). Continuous variables are summarized as the median and interquartile range and the Mann–Whitney U-test was used to compare between-group. For only sBP max, Student’s t-test was used.
AR, aortic regurgitation; CRP, C-reactive protein; LVDd, left ventricular end-diastolic diameter; LVEF, left ventricular ejection fraction; MR, mitral regurgitation; PE, pericardial effusion; PR, pulmonary regurgitation; TR, tricuspid regurgitation |
臨床的患者背景
本研究の対象者169例のうち,冠動脈拡張症例(以下,拡張症例)が33例(19.5%),うち1か月以内に瘤が退縮した一過性拡大症例は27例(16.0%),1か月以上瘤が残存したCAA症例は6例(3.6%)であった.川崎病発症1か月までの間にみられた拡張症例の内訳は,小瘤29例(17.2%),中等瘤3例(1.8%),巨大瘤1例(0.6%)であった.川崎病発症1か月以降に認められたCAA症例の内訳は小瘤5例(3.0%),中等瘤1例(0.6%),巨大瘤0例(0%)であった.なお,実測値によりCAAを定義した場合,川崎病発症1か月以降に認められた巨大瘤(8 mm<内径)は0例(0%),瘤(4 mm<内径≦8 mm)は1例(0.6%)であった.治療経過について,拡張症例のうち1st lineのみで治療したのは18例(54.5%),2nd lineまで施行したのが12例(36.4%),3rd lineまで施行したのは3例(9.1%)であった.一方,非拡張症例のうち,1st lineのみで治療したのは102例(75.0%),2nd lineまで施行したのは34例(25.0%)であった.患者背景について,不全型症例は26例(15.4%),再発症例は12例(7.1%)であった.
対象者の臨床的患者背景および観察期間中の治療結果をTable 1に示す.発症時月齢については拡張症例では26か月(IQR: 11~42か月),非拡張症例では31か月(IQR: 18~50か月)となり2群間で差を認めなかったが,生後半年未満の割合は,拡張症例では6例(18.2%),非拡張症例では7例(5.1%)となり,拡張症例に多い傾向が認められた.再発症例の割合についても,拡張症例では5例(15.2%),非拡張症例では7例(5.1%)であり,拡張症例に多い傾向が認められた.性別,群馬スコアが5点以上の症例,不全型症例の割合はいずれも2群間で差が認められなかった.
観察期間中の治療経過については,初回IVIG不応の割合は拡張症例で15例(45.5%),非拡張例では34例(25.0%)となり,冠動脈拡張症例で多い傾向がみられた.初回IVIG開始日は拡張症例では4日(IQR: 2~5日),非拡張症例では5日(IQR: 4~5日)となり,拡張症例で早い傾向がみられた.検査所見については,収縮期血圧最高値,Albumin最小値,D-dimer最大値,CRP最大値のいずれにおいても2群間で差が認められなかった.
心エコー所見については,MR, AR, PEが拡張症例に多い傾向がみられた.その内訳は,MRは拡張症例で30例(90.9%)(trace 27例,mild 3例),非拡張症例で98例(72.1%)(trace 82例,mild 13例,moderate 3例),ARは拡張症例で23例(69.7%)(trace 23例),非拡張例で23例(16.9%)(trace 21例,mild 2例),PEは拡張症例で22例(66.7%),非拡張症例で34例(25.0%)であった.%LVDd maxは拡張症例で105%(IQR: 100~108%),非拡張症例で102%(IQR: 91~105%)であり,拡張症例で高くなる傾向がみられた.さらに,%LVDd maxについてはROC曲線を作成し,冠動脈拡張に対する感度,特異度の合計が最大となる105%をカットオフとして症例数の割合を改めて検討したところ,%LVDd maxが105%以上となった症例は,拡張症例で27例(81.8%),非拡張例で73例(53.7%)となり,拡張症例で多い傾向がみられた.TR, PR, LVEF minはいずれも2群間で差が認められなかった.
心エコー所見と冠動脈拡張の関連
心エコー所見(MR, AR, PE, %LVDd)と冠動脈拡張との関連を検討した結果(Table 2),MRにおける交絡要因調整前のオッズ比は3.9(95%CI: 1.1–13.5),調整後のオッズ比は2.8(95%CI: 0.8–10.0)であった.ARにおける交絡要因調整前のオッズ比は11.3(95%CI: 4.7–26.9),調整後のオッズ比は9.9(95%CI: 4.0–24.5)であった.PEにおける交絡要因調整前のオッズ比は6.0(95%CI: 2.6–13.6),調整後のオッズ比は4.4(95%CI: 1.9–10.5)であった.LVDd拡大(%LVDd≧105%)における交絡要因調整前のオッズ比は3.8(95%CI: 1.5–10.0),調整後のオッズ比は3.6(95%CI: 1.4–9.5)であった.
Table 2 Echocardiographic findings associated with coronary dilation (Z≧2.5), univariate and multivariable logistic regression analysis | Unadjusted | Adjusted |
|---|
| OR (95% CI) | p | OR (95% CI) | p |
|---|
| MR | 3.9 (1.1–13.5) | p=0.03 | 2.8 (0.8–10.0) | p=0.118 |
| AR | 11.3 (4.7–26.9) | p<0.001 | 9.9 (4.0–24.5) | p<0.001 |
| PE | 6.0 (2.6–13.6) | p<0.001 | 4.4 (1.9–10.5) | p<0.001 |
| %LVDd max≧105% | 3.8 (1.5–10.0) | p=0.004 | 3.6 (1.4–9.5) | p=0.008 |
| OR, odds ratio |
冠動脈拡張とAR, PE出現の時間的関係について
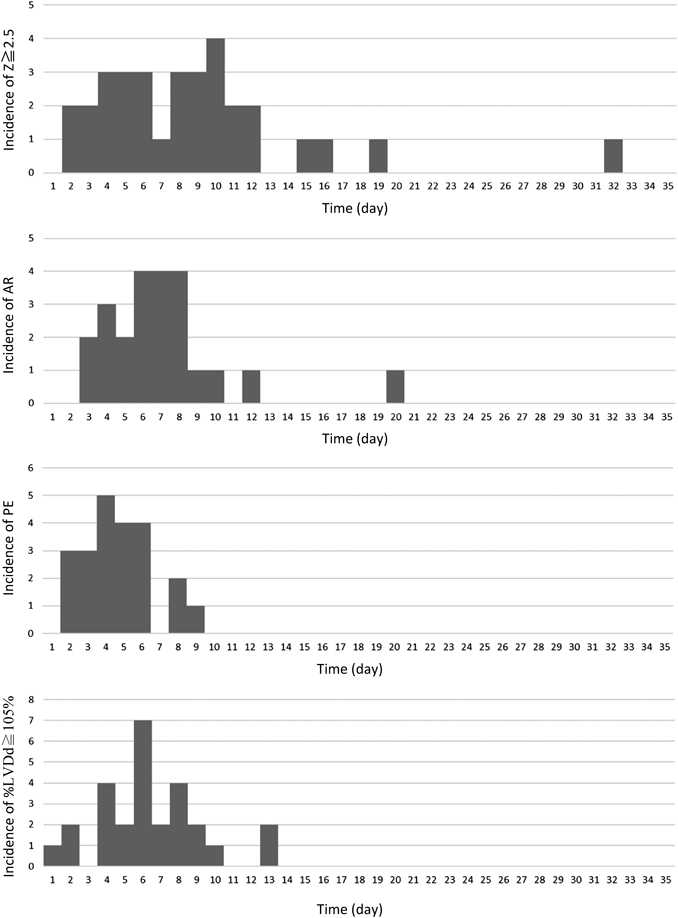
拡張症例33例を対象として,冠動脈拡張との関連性が示唆されたAR, PE, LVDd拡大について入院期間中の出現時期を検討した結果,ARは23例に所見が認められ,出現日中央値は7.0(IQR: 5.0–8.0)であった.LVDd拡大(%LVDd≧105%)については27例に所見が認められ,出現日中央値は6.0(IQR: 2.0–8.0)であった.PEは22例に所見が認められ,出現日中央値は4.5(IQR: 3.3–6.1)であった.また,Zが最大値をとる日の中央値は,8.0(95%CI: 5.0–11.0)であった(Fig. 3, Table 3).さらに,AR, PE, LVDd拡大(%LVDd≧105%)所見のうち,Z maxが2.5以上となる日以前に出現した所見に限り,改めて冠動脈拡張(Z≧2.5)に対する各心エコー所見の予測性を検討したところ,ARは拡張症例33例のうち14例(42.4%),非拡張症例136例のうち32例(23.5%)に認められ陽性適中率30%,感度42%,特異度76%,PEは拡張症例33例のうち7例(21.2%),非拡張症例136例のうち49例(36.0%)に認められ陽性的中率13%,感度21%,特異度64%,LVDd拡大(%LVDd≧105%)は拡張症例33例のうち11例,非拡張症例136例のうち86例(63.2%)に認められ陽性適中率11%,感度33%,特異度35%であった(Table 4).
Table 3 The date of Zmax, AR, %LVDd≧105% and PE | n | Median (day) | IQR (day) |
|---|
| Zmax | 33 | 8 | 5.0–11.0 |
| AR | 23 | 7 | 5.0–8.0 |
| PE | 22 | 4.5 | 3.3–6.1 |
| %LVDd max≧105% | 27 | 6 | 2.0–8.0 |
The date of each ultrasonographic change is summarized by the median and IQR.
AR, aortic regurgitation; IQR, interquartile range; LVDd, left ventricular end-diastolic diameter; PE, pericardial effusion |
Table 4 PPV, Sn and Sp of AR, PE and %LVDd≧105% for the detection of coronary dilation | n | PPV (%) | Sn (%) | Sp (%) |
|---|
| AR | 14 | 30 | 42 | 76 |
| PE | 7 | 13 | 21 | 64 |
| %LVDd max≧105% | 11 | 11 | 33 | 35 |
Ultrasonographic changes appeared before maximal coronary dilation (Zmax≧2.5) are only analyzed.
AR, aortic regurgitation; LVDd, left ventricular end-diastolic diameter; PE, pericardial effusion; PPV, positive predictive value; Sn, sensitivity; Sp, specificity |
CAAにおける臨床的背景
川崎病罹患後にZ≧2.5を満たす冠動脈拡張の頻度は海外報告と比較すると本研究で低く(19.5% vs 26%)9),本邦の全国統計と比較すると本研究で高い結果となった(19.5% vs 12.5%)10).全国統計と比較して冠動脈拡張の頻度が高くなった要因は,小瘤の頻度が本研究で高くなった影響であり,小瘤(全国統計10.1% vs本研究17.2%),中等瘤(全国統計2.12% vs本研究1.8%),巨大瘤(全国統計0.33% vs本研究0.6%)であった.本研究で,小瘤の頻度が高くなった要因としては,①当院では冠動脈拡張リスクが高いと病初期の心エコー所見より判断した際,心エコーの回数を上げて評価しており(心エコー施行頻度は,CAA症例では全入院期間中平均2.5日に1回,全症例では平均3日に1回),短期間だけZ≧ 2.5を満たす軽症例をより多くカウントした可能性や,②当院では群馬スコア5点以上の症例に対するプレドニゾロン初期併用療法を行っていないため治療選択の違いが影響した可能性(初回治療不応例の割合は全国統計と比較し当院で多い,全国統計20.4% vs本研究28.9%)が考えられた.
発症時の年齢については,2歳未満で急性期CAA合併率が高くなることや11),年齢が低いほどCAA合併率が高いことが報告されているが9),本研究でも同様の傾向が示された.また,CAA形成症例で初回治療不応例が多い傾向が認められたが,群馬スコア5点以上の患者割合はCAA形成症例とCAA非形成症例で差は認められなかった.しかし,群馬スコア評価項目の1つである初回治療開始病日についてみると,冠動脈拡張例で治療開始日が早い傾向がみられた.初回IVIG投与の遅れによりCAA形成リスクが高まることは明らかであるが,早期の初回IVIG投与に関しては,投与のタイミングが第5病日未満であるとCAA形成リスクが高くなるという報告や12),むしろ早期に投与したほうがCAA形成リスクは低くなるという報告もあり13),一定の結論が得られていない.早期にIVIG投与を行った症例のなかに,発症早期に冠動脈拡張がみられる重症例が偏っていたのか,もしくは川崎病自体にIVIG効果の得られやすい時期が存在するのか,さらに検討を行う必要がある.
AR, PE, LVDd拡大とCAAの関係
本研究により,心エコー所見のうちAR, PE, LVDd拡大所見(%LVDd≧105%)が冠動脈拡張に関連していることが示唆された.さらに,冠動脈拡張(Z≧2.5)出現以前に出現した所見に限り改めて冠動脈拡張(Z≧2.5)に対する予測性を検討すると,ARのみ冠動脈拡張前に出現する割合が高く,冠動脈拡張を予測する上で有用な指標であると考えられた.
CAA形成症例にARを合併する症例が多くみられるという報告はこれまでに2文献あり,一方はNakanoらが大動脈造影を用いて評価したもので1),もう一方は新垣らが超音波検査を用いて評価したものである2).しかし,両者ともに慢性期症例を評価対象としており,ARがCAA形成に先行して出現するかについては検討されていなかった.川崎病におけるARについて,逆流が急性期一過性に認められる場合と,心内膜の線維化,弁肥厚や心筋梗塞などの器質的な変化を伴い,罹患後長期にわたって認められる場合とが報告されている14, 15).本研究で対象としたARは川崎病治療後に全例消失していることから,急性期一過性に弁逆流が認められものであり,このような症例で冠動脈拡張リスクが高くなることが示唆された.
弁の炎症は,大動脈弁のほうが僧帽弁よりも早期に弁両面に広がるとされている16).さらに,弁炎の合併率は大動脈弁で高く16, 17),川崎病罹患後に大動脈基部が拡大するという報告もみられる18).これらの報告から,川崎病の炎症は大動脈弁周囲にもっとも早期に到達し,弁基部を介して弁全体に広がる機序が推定され,ARが冠動脈拡張よりも早期に出現し,CAA形成と高い関連性を示した背景因子と推測される.
PEについて,これまでも冠動脈輝度が高い症例で多く認められると報告され19),CAA形成との関連性が指摘されている20).Giddingらは,CAA形成症例にMRとPE(PEは収縮期・拡張期に心嚢液が確認されるものと定義)が多く認められ,両者がみられる場合,感度70%,特異度89%でCAAの形成を予測できると報告している20).しかし本研究においては,PEは単変量解析,多変量解析ともに冠動脈拡張と有意に関連することが示されたものの,冠動脈拡張以前にみられる所見に限って解析すると陽性的中率,感度,特異度とも低く,冠動脈拡張を予測する上で有用な指標とは考えられなかった.
MRは川崎病に合併する弁膜症として最も多く,先行研究では,CAA形成症例の約6割にMRを合併し20),川崎病急性期症例全体では約26%にMRを合併していたと報告されている21).しかし本研究においては,単変量解析でCAA形成と有意な関連を認めたものの,多変量解析では有意な関連を認めなかった.本研究では,CAA形成症例の91%(30例/33例),CAA非形成症例の72%(98例/136例)にMR所見が認められ,CAA形成症例において高い割合でMRが検出された.MR検出率が従来報告よりも高くなった要因として,小瘤検出率が高くなった要因と同様に,CAAリスクが高いと判断した症例で心エコーの施行頻度を高めたことにより短期間で消失する軽症のMR trace所見(Fig. 2A)を多くカウントした可能性が考えられた.大動脈弁と比較して僧帽弁は冠動脈起始部から解剖学的に離れており,さらに腱索によって心筋と繋がるため,汎心筋炎や21),それに伴う乳頭筋機能低下13),LVDd拡大など冠動脈炎以外の複数の要素の影響を受けやすい条件にある.そのような大動脈弁との解剖学的な条件の違いにより冠動脈拡張との関連性が低くなった可能性がある
これまで,川崎病急性期におけるCAA形成とLVDd拡大の関連性について指摘した報告はないが,川崎病急性期に左心機能が障害されることについては複数報告されており22–24),慢性期に心筋組織に肥大や変性などの組織学的変化を残す場合もあるとされる25).急性期CAAを伴う川崎病では,長軸方向および円周方向のグローバルストレインが低下し22),IVIG投与に伴い長軸方向の左心機能が低下する24)という報告もある.本研究では,IVIG投与前に%LVDdが105%を超える症例は11%(3例/27例)にとどまり,IVIGが投与される第5病日前後で増加する傾向がみられることから,容量負荷の増大に伴い拡大したと推測された.本研究によりLVDd拡大が冠動脈拡張に関連することが示されたが,冠動脈拡張以前にみられる所見に限って解析すると,陽性的中率,感度,特異度とも低く冠動脈拡張を予測する上で有用な指標とは考えられなかった.
今回の研究により,冠動脈拡張に先立って出現するARは冠動脈拡張を予測する上で有用な所見であることが示された.冠動脈径は施行者の技量の違いにより測定誤差が大きくなるが,ARは比較的容易に確認できる所見である.川崎病診断基準を満たす症例で病初期よりARを認めた場合,冠動脈拡張をきたす可能性が高いと判断し早期にIVIG投与を開始することが,冠動脈後遺症の減少に寄与すると考えられる.
本研究は,単施設における後ろ向き検討の結果であり,サンプルサイズが十分であったとはいえない.特にCAAは急性期一過性拡大症例が主であり,1か月を超えても残る冠動脈瘤症例および高年齢(6歳以上)の症例数が少なかった.今後は対象施設とサンプルサイズを増やした検討が必要である.また,心エコーの施行時期は症例ごとに異なり,今回観察対象とした心エコー所見の出現時期を正確に捉えられているとはいえない.今後はより正確に所見を検知できるよう,検査施行時期についても検討が必要である.
川崎病罹患後にZ≧2.5の冠動脈拡張を来す症例では,AR, PE, LVDd拡大を認める傾向がある.そのなかでもARは,冠動脈拡張以前に出現する割合が高く,冠動脈拡張を予測する上で有用な指標である.病初期にARを認める川崎病症例に対しては冠動脈拡張リスクが高いと判断し,注意深い心エコー評価と速やかなIVIG開始を検討することが重要と考えられる.
謝辞Acknowledgments
統計学的解析についてご指導をいただいた北野病院医学研究所研究支援センター品質管理室長片山俊郎先生,京都大学大学院医学研究科発達小児科学友滝清一先生に深謝申し上げます.
利益相反
本論文において開示すべき利益相反(COI)はありません.
著者の貢献度
阿久澤大智は筆頭著者として論文の執筆を行った.渡辺健は川崎病の診断,治療,心エコー検査の監督,論文の責任指導者として関わった.日高優は統計解析に関わった.沼田寛,枡野浩彰,吉岡孝和は川崎病の診断,治療,データ入手,論文の推敲に関わった.秦大資は論文の知的内容に関する校閲,および指導を行った.
引用文献References
1) Nakano H, Nojima K, Saito A, et al: High incidence of aortic regurgitation following Kawasaki disease. J Pediatr 1985; 107: 59–63
2) 新垣 義,鈴木 淳,木下 義,ほか:川崎病と大動脈弁閉鎖不全.Prog Med 1993: 13: 1347–1350
3) 日本川崎病学会:川崎病診断の手引き改訂第6版
4) 日本循環器学会:川崎病心臓血管後遺症の診断と治療に関するガイドライン2020
5) McCrindle BW, Rowley AH, Newburger JW, et al: Diagnosis, treatment, and long-term management of Kawasaki disease: A Scientific Statement for Health Professionals from the American Heart Association. Circulation 2017; 135: e927–e999
6) 日本循環器学会:川崎病心臓血管後遺症の診断と治療に関するガイドライン2003
7) Kobayashi T, Fuse S, Sakamoto N, et al: A new Z score curve of the coronary arterial internal diameter using the Lambda-Mu-Sigma Method in a pediatric population. J Am Soc Echocardiogr 2016; 29: 794–801
8) Kobayashi T, Inoue Y, Takeuchi K, et al: Prediction of intravenous immunoglobulin unresponsiveness in patients with Kawasaki disease. Circulation 2006; 113: 2606–2612
9) McCrindle BW, Li JS, Minich LL, et al: Coronary artery involvement in children with Kawasaki disease: Risk factors from analysis of serial normalized measurements. Circulation 2007; 116: 174–179
10) 小佐見 光,屋代 真,牧野 伸,ほか:第25回川崎病全国調査成績.小児科診療2020; 83: 269–273
11) 川崎病全国調査担当グループ:第26回川崎病全国調査成績.自治医科大学地域医療学センター公衆衛生学部門.Retrieved from https://www.jichi.ac.jp/dph/inprogress/kawasaki/ (2022年2月4日閲覧)
12) Nomura Y, Masuda K, Yoshinaga M, et al: Patients diagnosed with Kawasaki disease before the fifth day of illness have a higher risk of coronary artery aneurysm. Pediatr Int 2002; 44: 353–357
13) Tse SM, Silverman ED, McCrindle BW, et al: Early treatment with intravenous immunoglobulin in patients with Kawasaki disease. J Pediatr 2002; 140: 450–455
14) 藤関義樹,山崎正策,後藤正勝,ほか:MCLSによる大動脈弁閉鎖不全症.心臓1981; 13: 83–88
15) Akagi T, Kato H, Inoue HK, et al: Valvular heart disease in Kawasaki syndrome-incidence and natural history. Kurume Med J 1989; 36: 137–149
16) 原田 真,横内 幸,大原関利,ほか:川崎病剖検例における弁膜炎の病理学的検討.日小児科学会誌2013; 117: 466
17) 藤原 久,藤原 兌,武内 英:川崎病剖検例の臨床病理学的検討.小児科1985; 26: 1029–1039
18) Ravekes WJ, Colan SD, Gauvreau K, et al: Aortic root dilation in Kawasaki disease. Am J Cardiol 2001; 87: 919–922
19) Yu JJ, Jang WS, Ko HK, et al: Perivascular brightness of coronary arteries in Kawasaki disease. J Pediatr 2011; 159: 454–457
20) Gidding SS, Duffy CE, Pajcic S, et al: Usefulness of echocardiographic evidence of pericardial effusion and mitral regurgitation during the acute stage in predicting development of coronary arterial aneurysms in the late stage of Kawasaki disease. Am J Cardiol 1987; 60: 76–79
21) Akagi T, Inoue O, Ohara N, et al: Valvular regurgitation in patients with Kawasaki disease and in healthy children: A pulsed Doppler echocardiographic study. J Cardiol 1989; 19: 787–796
22) Sanchez AA, Sexson Tejtel SK, Almeida-Jones ME, et al: Comprehensive left ventricular myocardial deformation assessment in children with Kawasaki disease. Congenit Heart Dis 2019; 14: 1024–1031
23) Yu JJ, Kwak BO, Jeon YH, et al: Elevation of the index of left ventricular mass during the acute and subacute phase of Kawasaki disease, and its association with indexes of diastolic function. Cardiol Young 2009; 19: 64–69
24) Koteda Y, Suda K, Kishimoto S, et al: Impact of intravenous immunoglobulin infusion on longitudinal left ventricular performance in patients with acute Kawasaki disease of usual course. J Cardiol 2009; 54: 45–51
25) Liu AM, Ghazizadeh M, Onouchi Z, et al: Ultrastructural characteristics of myocardial and coronary microvascular lesions in Kawasaki disease. Microvasc Res 1999; 58: 10–27