胎児心エコーの歴史は,診断として1960年代に胎児心拍モニタリングの評価のためにパルスドプラ法が使用されるようになった.それに引き続いて1970年代に胎児不整脈モニターとしてMモードの利用,そして1980年頃より2Dエコーでの胎児心臓形態の描出についてイギリスのAllanらから報告された6).その後にカラードプラを利用した画像診断が進化し,1990年代になるとハーモニックイメージング法や3Dイメージの出現により胎児心臓の形態や機能評価をより正確に行うことが可能となった6).日本においても,胎児心臓診断の世界的な広がりからその必要性が高まり,1994年にまず日本胎児心臓病研究会が発足し,2006年に初版の胎児心エコーガイドラインが発表された.2010年に胎児心エコー検査が保険収載となって以降は,心精査としてスキルのある産科医および小児循環器科医が行う「レベル2」胎児心エコー検査数が急増し,疾患のより正確な診断のみならず,重症度評価についても詳細に行われるようになった.
一方で胎児治療については,特にCHDに関してはその専門性・特殊性のために適応・介入方法・効果判定,治療倫理に関する評価が難しい現状がある.それによりこれらの導入には,欧米と比較して長い期間を要している.1970年代から経母体胎盤的薬物投与による治療が開始され,その後前述のようなCHDの出生前診断の進歩によって一部の疾患群において胎児期に治療介入が行われないと,極めて予後不良な重篤な病態に進行し,妊娠期間中または新生児期早期に死亡に至る病態が明らかになった7).これらの疾患群に,経母体的に胎児に薬剤効果を届ける「経胎盤的胎児薬物療法」と母体腹壁より穿刺を行い経腹壁/経子宮的に胎児にカテーテルを到達させる「侵襲的胎児心臓治療」が1990年以降行われ,各国より報告されている8–10).これらの経母体的治療法は,疾患を持つ胎児に治療侵襲に見合ったメリットがあるべきという条件と,同時に健常母体を通して医療行為を行うため,母体の安全性が確保されるべきという条件の双方が要求される特殊性がある.胎児期に侵襲的治療を行うためには,技術的/倫理的に超えるべき問題が極めて高いため,世界的に見ても限られた施設でのみ行われているのが現状である.2014年に発行されたAmerican Heart Association(AHA)のステートメントにおいても,胎児治療の分野は未だ発達段階で,ランダム化比較試験がほとんど実施されていないため,母体へのリスクと出生後の予後が改善する可能性に対して,常に比較検討されながら実行されなければならないと記載されている11).また胎児疾患を取り囲む倫理的な背景として,胎児を一人の患者とみなす“Fetus as a patient”の考えに基づいているとしても,健常母体への身体的侵襲を伴うため,それがもたらすリスクに留意して患者家族,特に妊婦の同意への真摯性への考慮を重要視すべきであるとされている.それにより妊婦にとって想定されうる利益,つまり子の生後の重症度が軽減されることによる心理的・社会的利益の内実を,生命倫理の4原則(自立性尊重の原則(respect for autonomy),善行の原則(beneficence),無危害の原則(nonmaleficence),正義の原則(justice))に照らし合わせて,十分に検討する必要がある12, 13).
現在本邦で保険収載されている胎児治療は,胎児胸水に対する胸腔・羊水腔シャント術とTTTS(twin-twin transfusion syndrome)に対する胎児鏡下レーザー凝固術,TRAP(twin reversal arterial perfusion)sequenceに対するラジオ波凝固術,胎児輸血がある14)が,今後は胎児重症CHDに対する治療についても他施設共同研究や施設限定での実施がすすめられ,胎児心臓病領域の重要な地位を占めるようになると予想されている.
A.胎児頻脈性不整脈
1. 治療目的:胎児不整脈は全妊娠の約1~2%で認められ,その大部分は良性の期外収縮で治療を要さない.一方で胎児頻脈性不整脈は全妊娠の0.1%以下とまれであるが,無治療で頻脈が持続する場合は,症状が進行し胎児心不全,胎児水腫の原因となり,胎児・新生児死亡になり得る15).胎児頻脈性不整脈の際には有効な心拍出が得られず,静脈圧の上昇から1~2週間の経過で胎児水腫に進行することが知られている.胎児頻拍が長時間持続した場合,心筋局所の虚血や低酸素からリモデリングが進行し,頻拍誘発性心筋症に移行するとさらに予後不良となる.そのため,胎児頻脈性不整脈に対する胎児治療の目的は,胎児心不全が進行しないように胎児心拍の心拍数および出現頻度をコントロールすることとしている.頻脈性不整脈が洞調律への復帰が理想であるが,完全には達成できないこともあり,その場合には胎児心拍180/分以下を目標として治療を実施する16).
2. 世界と本邦の現状:胎児頻脈性不整脈の大部分を占める上室性頻脈(supraventicular tachycardia: SVT)および心房粗動に関しては,ジゴキシン,ソタロール,フレカイニドをはじめとした抗不整脈薬の胎児経胎盤治療の有効性が海外でも多く報告されている.2014年のAHAステートメントでもこれらの薬剤はクラス1の評価がなされ胎児治療の有効性に関してはコンセンサスが得られている11).本邦では2019年に胎児頻脈性不整脈に対する多施設共同介入試験の結果が公表された16).
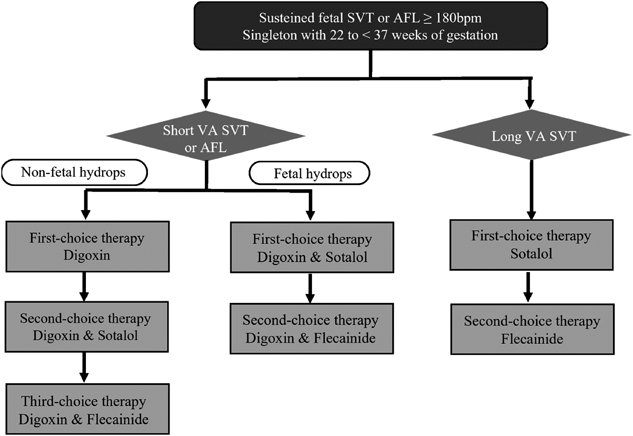
3. 治療方法:そのなかで使用されている胎児頻脈性不整脈治療の実際をFig. 1に示す.治療薬剤としてはジゴキシン,ソタロール,フレカイニドを用い不整脈のタイプおよび胎児水腫の有無によって治療選択をした.Long VAタイプのSVTではジゴキシン無効例が多いとされることから,パルスドプラ法を用いてshort VAとlong VAの鑑別を行うことによりFirst-line治療薬の選択を行っている.胎児水腫のある場合には,ジゴキシンの胎盤透過率が低下するため,第二選択薬であるソタロールをFirst-lineから併用して開始するプロトコルになっている.また本邦においてフレカイニドは妊娠中禁忌となっていることから,第三選択薬となっているが,欧米ではフレカイニドの有効性および安全性を示した報告があり今後に主流となっていく可能性はある17).現在主に使用されている薬剤の投与量は,ジゴキシンは,治療開始時の急速飽和として点滴静注で0.5 mg静注を行い,初回静注から8時間,16時間後にそれぞれ0.25 mg静注を行う.静注が不可の場合は1.5 mg/日を分3で経口投与を行う.その後の維持として経口投与で,0.75 mg/日を分3で経口投与する.血中濃度は1.5–2.0 ng/mLに維持することを目標として,有効血中濃度確認後3日以上経過しても胎児不整脈の改善を認めない場合は無効と判断する.第二選択薬であるソタロールは,経口投与で160 mg/日を分2で併用または単独治療として開始する.投与開始後3日で頻脈の改善を認めなければ240 mg/日を分2に増量する.最大投与量である320 mg/日まで増量して投与する.この際に母体心電図にてQTcが0.5 sec以上となった場合は内服中止を必要とすることが重要である.ソタロール最大増量後3日以上で頻脈改善を認めなければ,無効と判断して第三選択薬であるフレカイニドを使用する.フレカイニドは,ソタロールが無効であった場合に中止し,その後に200 mg/日を分2で経口投与にて,ジゴキシンとの併用または単独療法として開始する.投与開始後3日で改善なければ300 mg/日に増量する.ソタロールと同様にQTcが0.5 sec以上となった場合は内服中止とする.肝要な点は胎児治療を実施するにあたり,母体の安全確保は最重要項目であり,治療開始前には必ず母体心電図で伝導障害やQT延長がないことを確認しておく必要がある.また高用量薬剤を母体に投与するため,胎児新生児の管理のみでなく,母体の副作用のモニタリングおよび迅速な対応が可能な施設で実施する必要がある16).特にSVTにおいては,胎児治療によりいったん頻脈が消失した場合でも,出生後に再発する危険性が比較的高いため,小児循環器科の対応が可能な施設での周産期管理が望ましい.
4. 今後の展望:今後は証明された有効性をもとに,より安全性の高い治療プロトコルを確立すると同時に,治療体制の整備と保険収載への取り組みが期待されている.
B.胎児徐脈性不整脈
1. 治療目的:胎児徐脈性不整脈として,洞性徐脈,完全房室ブロック(complete atrioventicular: CAVB),2:1房室ブロック,PAC with blockが挙げられるが,胎児期に問題となる徐脈性不整脈はCAVBであり心形態異常に起因するものと,母体由来の移行抗体に起因するものとに大別される.心形態異常として内臓錯位症候群の左側相同や修正大血管転位が代表的である.母体由来の移行抗体として抗SS-A/Ro抗体,一部抗SS-B/La抗体によるCAVBが重要で,抗SS-A抗体陽性妊婦の2%に自己免疫性CAVBを発生する18).これらは,永続的であり出生後にペースメーカー植え込みを要することが多い.また房室結節だけでなく,心筋にも炎症を生じて拡張型心筋症,心内膜線維弾性症様の障害を来し,長期予後に影響し,現在も不良因子とされている.
2. 世界と本邦の現状:胎児期に生じたCAVBについて,診断時の在胎週数が20週未満,胎児心拍数50/分以下,左室機能障害,胎児水腫の有無が胎児死亡の危険因子とされており19),出生後治療としてペースメーカー埋め込みが実施されるが,娩出までの管理治療については定められていない.胎内でのペースメーカー治療を目的として,心室心拍数が55/分以下の症例に対し塩酸リトドリン持続静注を考慮する.また心筋炎に対する抗炎症作用を目的として,心機能障害,胎児水腫がある場合にはデキサメサゾン投与が諸外国で試みられている20).しかしながら,2009年にFriedmanらが報告したPRIED studyの結果では,CAVBに進展して時間が経過した症例ではその後の胎児治療によってブロックが改善する可能性はないとされている21).また本治療における胎児副腎機能への影響は無視できず慎重な検討が必要である.
3. 治療方法:CAVB発症後の治療方法については,いまだ確立された治療法はないが,各施設から母体へのステロイド,β刺激薬などの使用方法について報告されている19, 20).当院では上述の文献を参考に,CAVBの診断後よりデキサメサゾン4 mg/日で開始し,母体副作用を確認してから4–8 mg/日で継続し,1週間毎に1 mg/日ずつ減量していく.2–4 mg/日を妊娠28週まで,その後は2 mg/日を分娩まで継続している.β刺激薬の使用に関しては,胎児心拍数が50/分以下の症例では子宮内胎児死亡のリスクが上昇するため,胎児心拍数55/分以下で使用する19).また胎児心拍数55/分以上でも,合併心奇形,心機能障害があればβ刺激薬の使用を考慮してもよい.治療効果と母体合併症については定期的に評価を行い,治療を続けるか,胎外治療を選択する週数については各科での協議で決定している.
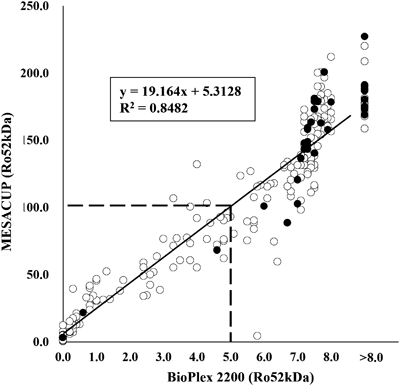
CAVBの疾患重症度を鑑みると,発症自体を予防することが最も重要であると考えられる.現在,本邦で「前児で新生児ループスの心病変を合併した抗SS-A抗体陽性の妊婦」に対してヒドロキシクロロキン投与による房室ブロック再発予防の臨床試験が始まっており今後の結果が期待される.またMiyasatoらは,抗SS-A抗体陽性妊婦についてELISA(Enzyme-Linked Immuno Sorbent Assay)法を用いて抗SS-A抗体のRo52kD分画を測定することで,CAVB発生を予測する抗体価のカットオフ値を設定し報告した22).当院ではこれらの母体に対して予防的プレドニン投与を行うことで,胎児期に房室ブロックの発症への進行予防の可能性を報告しているが,大規模な前向き研究が必要である.現在,抗SS-A抗体分画であるRo52kD, Ro60kDの抗体価は,SLIメディエンスの一般外注検査「マルチプル10」によって測定できるようになっている.このBioplex法で計測したRo52kDの値は,従来のMESACUP法で計測した値と,非常に良好な相関が得られており(Fig. 2),SSA Ro52kDが>5.0である症例をCAVB発症の高リスクとして層別化が可能である23).
4. 今後の展望:以上のように胎児徐脈性不整脈に関しては,発症後の治療は極めて限定的であり,現在Jaeggiらによる房室ブロックを発症した胎児の転機についてのデータ集積(SLOW HEARTレジストリ)が行われ,長期的予後を見据えた治療プロトコルの作成とともに,CAVB発症予防方法の確立が望まれている.
C.胎児重症大動脈弁狭窄
1. 治療目的:重症大動脈弁狭窄症は出生1万当たり3.5人の発生頻度と報告されている.重症大動脈弁狭窄症の一部に胎児期に左心低形成症候群に進行する症例があり,このような症例に対して胎児期に左室流出の狭窄解除を行うことで左心系の成長を促し,出生後の二心室修復が可能となる症例群が存在する.Tworetzkyら,Tulzerらが中心となり生後の二心室修復への到達とそれによる予後改善を目指す目的で胎児大動脈弁形成術の介入を報告している24–26).
2. 世界と本邦の現状:重症大動脈弁狭窄症に対する胎児カテーテル介入についての海外の報告では,2000年のKohlらの報告では12例に施行された治療のうち手技成功が7例(58%),不成功が5例であった.しかし成功7例のうち3例(43%)が胎児死亡,3例が出生後死亡,不成功のうち4例(80%)が胎児死亡となり,全体で2例(17%)のみ生存可能であり良好な結果とは言えなかった9).その後のアメリカ,ヨーロッパからの報告では,手技成功率77/100例(77%),59/67例(88%)であり,生後に二心室修復を目指せた症例は,38/88例(43%),19/43例(44%)となっており治療手技のみならず,出生後経過としても二心室修復への到達率は向上している.手技による死亡は6/67例(9%)とされている27, 28).日本においても日本胎児心臓病学会,日本胎児治療学会,日本小児循環器学会の協力のもとで本治療の早期安全性臨床試験が2019年2月から5例を目標に開始されており,有効性/安全性の検討がなされている29).
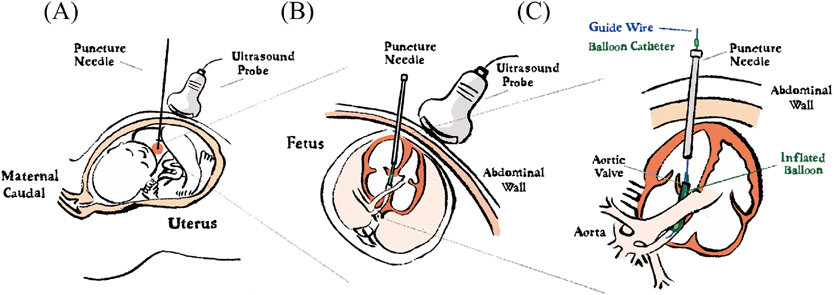
3. 治療方法:治療手技は,経母体腹壁からのエコーガイド下に施行する.母体に対する脊髄くも膜下硬膜外併用麻酔(combined spinal-epidual anesthesia: CSEA)とレミフェンタニルを用いた麻酔下で,胎児に対してアトロピン,ロクロニウムおよびフェンタニルを胎児臀部に筋肉内注射を投与し麻酔を行う.エコーガイド下で理想的な胎児の位置が確認された場合,18ゲージ針を母体腹壁から穿刺し,子宮壁と羊水を通して,胎児胸壁を経由して左室心尖部から左室内腔へと到達させる.穿刺針を大動脈弁下まで進めた後に,0.014 inchのガイドワイヤーを大動脈弁開口部に順行性に通し,それに冠動脈血管形成用バルーンカテーテルを追従させていく.適切な位置で,大動脈弁輪径の100%を超えない径のバルーンカテーテルを用い,狭窄解除/軽快を得られるようにする.拡張術後に穿刺装置を抜去した後,出血による胎児心嚢液貯留,胎児心拍,狭窄病変の程度を評価し手技を終了とする.上記手技は,穿刺から抜去までをできるだけ短時間で完遂できるようにする(Fig. 3)30, 31).
以下に重症大動脈弁狭窄症のうち胎児介入の適用となる症例選択方法を示す.母体に対する治療適応は,1)妊娠22週0日~31週6日,2)母体年齢が16歳以上45歳未満,3)妊娠高血圧症候群がない,4)性器出血がない,5)破水していない,6)子宮頚管長が20 mm以上である,7)胎児の妊婦と配偶者の研究参加同意が得られている,としている.更に胎児に対する選択基準の評価項目は,1)大動脈弁狭窄がある,2)左室機能不全がある,3)Transverse arch血流が逆行性もしくは両方向性である,4)左室長軸長Z score >−2である,5)Threshold score ≧4である,としており,詳細な適応基準をTable 1に示す.
Table 1 Suggested preoperative echocardiographic criteria with threshold Z scores for performance of aortic balloon valvuloplasty| 1) This study includes fetuses that comply with the following Boston children’s hospital criteria recommended by international registry group |
| 1. Dominant cardiac anatomic anomaly: valvular aortic stenosis with all of the following: |
| ・Decreased mobility of valve leaflets |
| ・Antegrade Doppler color flow jet across aortic valve smaller than valve annulus diameter |
| ・No or minimal subvalvular LV outflow obstruction |
| 2. LV function qualitatively depressed |
| 3. Either retrograde or bidirectional flow in the transverse aortic arch or 2 of the following: |
| ・Monophasic mitral inflow Doppler pattern |
| ・Left-to-right flow across atrial septum or intact atrial septum |
| ・Bidirectional flow in pulmonary veins |
| 4. LV long-axis Z score >−2 |
| 5. Threshold score ≧4 (fulfilling 4 or more of the following) |
| ・LV long-axis Z score >0 (1 point) |
| ・LV short-axis Z score >0 (1 point) |
| ・Aortic annulus Z score >−3.5 (1 point) |
| ・Mitral valve annulus Z score of >−2 (1 point) |
| ・Mitral regurgitation or aortic outflow peak systolic gradient >20 mmHg (1 point) |
| 2) There are no serious fetal abnormalities other than critical aortic valve stenosis |
| (Modified from https://www.jsfc.jp/clinical-trial-index/clinical-trial ) |
4. 今後の展望:今後国内での胎児心臓病治療の発展のためには,該当症例が発生した場合は早期安全性試験へ参加登録が必要であり,治療可能施設との迅速な連携が要求される(https://www.jsfc.jp/clinical-trial-index/clinical-trial).2021年に妊娠25週の妊婦・胎児に対する国内初の本胎児治療が臨床試験として実施された.
D.今後胎児治療対象となりうる疾患群
今後,本邦で治療対象となりうるCHDとして,エプスタイン病/三尖弁異形成(Ebstein’s anomaly and tricuspid valve dysplasia: EA/TVD),心房間交通に高度な制限のある左心低形成症候群,心室中隔欠損を伴わない重度肺動脈狭窄または閉鎖が挙げられる.今回はそのなかで,経胎盤薬物治療の一つである,Circular shuntを伴うEA/TVDに対する非ステロイド性抗炎症薬(Non-steroidal anti-inflammatory drug: NSAID)の可能性について提示する.
エプスタイン病/三尖弁異形成
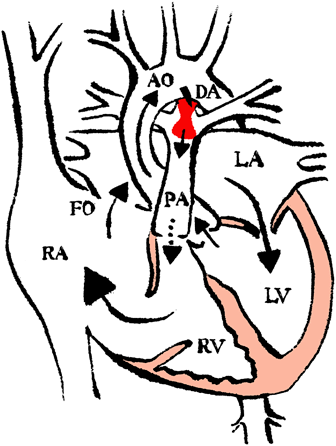
1. 治療目的:EA/TVDは,子宮内で診断された場合,周産期死亡率が約50%と報告されている重症疾患群である32).本症は心臓発生過程における三尖弁中隔尖,後尖の形成不全により,重度の三尖弁逆流を来す.同時に肺血流を順行性に拍出できない右室機能不全を合併することにより,肺動脈血流は動脈管を大動脈から肺動脈への逆シャントにより維持されることとなる.特に肺動脈弁閉鎖不全症(PR)がある場合は,いわゆるCircular shuntを形成し,胎児または新生児死亡の一因となる全身性の低心拍出状態を引き起こす.重要なことは上記病態が,妊娠中に週数とともに進行するということである33, 34).本疾患に対する胎児治療の目的は,NSAID投与により胎児動脈管を収縮させることで全身血流が動脈管に盗血され心拍出減少を引き起こす,いわゆるCircular shuntを軽快,中断することである.それにより血行動態の改善,妊娠期間の延長を図ることが期待できる(Fig. 4).一方,NSAIDであるIndomethacineは,Prostaglandin synthetaseを阻害し,胎盤移行により正常胎児動脈管の収縮を引き起こす可能性があるとされており,一般的には妊娠経過中の使用は禁忌とされている.
2. 世界と本邦の現状:EA/TVDに対するNSAIDによる胎児治療の有効性をMorgan Stanley小児病院のFreudらがまとめた10施設からの胎児21症例の報告をまとめている35).中央値30.3週(22.0–33.1週)でNSAIDによる治療を受けた15症例のうち,12例(80%)で有効な動脈管収縮によるPR改善(1例は消失),臍帯動脈,中大脳動脈血流パターンにより胎児循環の改善が確認された.その後のIbupurofenへの変更を経て,胎児動脈管収縮を認めた症例は有意に妊娠期間の延長を得ることができた.NSAID治療を受けて動脈管収縮を得られた12症例のうち11例(92%)が生存出生したことは,動脈管収縮を得られなかったまたは治療を受けなかった9症例のうち4例(44%)のみが生存出生したことと比較して,有意に胎児予後を改善したと結論付けている.
3. 治療方法:本治療の実施に際して使用するNSAID投与方法として,治療に同意が得られた母体に対し,高用量Indomethacineとして100 mgを2–4回/日から開始して,動脈管収縮が確認された症例に対して腎副作用の少ないとされているIbupurofenに変更し,200–600 mgを3–4回/日を分娩まで投与するというプロトコルを使用した.胎児副作用として腎機能低下によると考えられる羊水過小が67%,母体副作用として胸焼けの症状が1例で報告されていたが,NSAID治療により妊娠期間の延長と,生存出生率の改善を示唆していた.
4. 今後の展望:本治療はNSAIDの副作用によって胎児への治療効果を得る治療法であり,本邦でも多施設共同の前向き研究が望まれる治療の一つであるため,各施設が連携を取り薬剤投与期間や経過観察の方法を統一する必要がある.また現在の保険診療では,妊婦への禁忌薬剤であるNSAIDを治療薬として使用するといった社会的,倫理的問題点への配慮も課題となる.