正常気管・気管支と大血管の発生
胎生24~26日に咽頭部の前腸腹側部から呼吸器憩室が発生し,胎生26~28日に左右の肺芽に分かれる.この肺芽が尾側に伸長し,外側にある中胚葉が内側に嵌入して食道気管中隔を形成することで気管が食道から分離される.胎生28~30日に肺芽は伸長して気管支芽を形成し,胎生30~32日に5葉の気管支芽が見られるようになり,胎生36日にはすべての区域枝が発生する.同時期に,肺芽周辺の中胚葉由来の間葉組織がsplanchnic plexusと呼ばれる末梢肺毛細血管網を形成し,胎生34~36日に完成した第VI咽頭弓動脈由来の肺動脈弓と,胎生6週過ぎに結合する3, 4).
先天性気管狭窄の発生・解剖
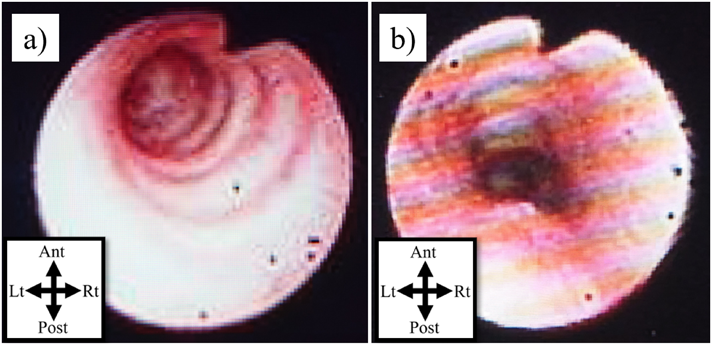
正常な気管では,前方に軟骨部と後方に膜様部を認めるが,先天性気管狭窄では,気管の一部あるいは広範囲にわたり膜様部を欠損した完全輪状軟骨輪を認め,狭窄所見を呈する(Fig. 1).気管軟骨は間葉組織の細胞に由来し,胎生8~10週に気管に分布する5).正常では気管腹側にC型に分布して軟骨を形成する(後方は膜様部)が,先天性気管狭窄では気管全周にわたり完全輪状軟骨輪が形成される6, 7).
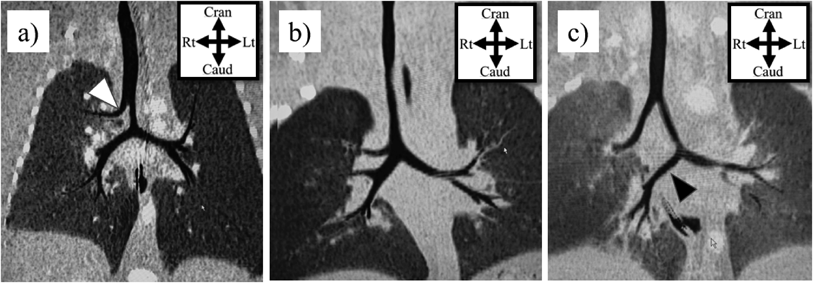
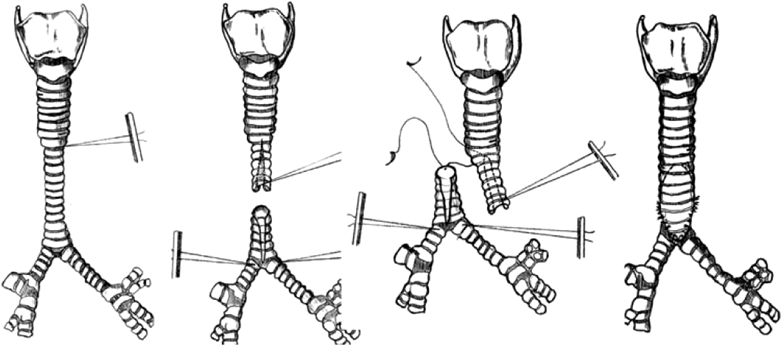
気管や気管支の先天異常を知るうえで,気管分岐異常の理解は欠かせない.気管分岐異常には,気管気管支(tracheal bronchus),気管三分岐(bronchial trifurcation),bridging bronchusなどがある(Fig. 2).
気管気管支とは,気管分岐部よりも上部の気管から上葉領域へ分枝する異常な気管支を指し,上葉の区域枝をすべて出すパターン(ブタではこの分岐パターンのため‘pig bronchus’と呼称される)から,上葉の一部区域のみに分枝するパターン(displaced),通常の上葉枝が右主気管支から分枝しているにもかかわらず余剰な分枝があるパターン(supernumerary),気管気管支の先が盲端となるパターン(rudimentary)など様々なタイプがある3, 8).これらは気管の右側で発生しやすいことが特徴的である9, 10).また,気管三分岐は気管分岐部から右の上葉枝が分岐するもので,気管気管支の亜型と考えられる.そして,bridging bronchusとは気管気管支に加えて,気管分岐部が通常よりも尾側・左方に偏位し,右中葉・下葉に向かう気管支が椎体をまたいで左から右に横走する気管支を指す11).これらの気管分岐異常は,胎生4~5週の間の肺芽・気管支芽の発生異常に起因すると考えられている.先天性気管狭窄も同時期の発生異常に起因することから,気管狭窄に気管気管支などが合併することは容易に理解できる.実際,気管気管支は先天性気管狭窄の11.9~24.7%の症例で認められる12).一方,気管気管支は症状のない一般人1%程度にも認められ,先天性気管狭窄に比して発生頻度が非常に高い9, 10).したがって,先天性気管狭窄の発症には,気管気管支の発生異常に,さらになんらかの因子が加わっていると推定される.
正常な気管は体格とともに成長するが,完全輪状軟骨輪では気管の成長が不十分なことが多く,時間経過とともに狭窄症状が顕在化することが多い.本症には先天性心疾患,消化器系異常(食道閉鎖・腸閉鎖・鎖肛など),泌尿器系異常,骨格系異常などの先天異常を合併することも多く,同時に複数の異常を合併することも珍しくない6, 13).また,Down症候群をはじめとした染色体異常の合併も認められる.これら合併異常の中でも予後に深く関連するのは心血管疾患で,呼吸と循環が相互に影響し合いながら病態を形成する14–16).
先天性心疾患を合併する先天性気管狭窄の病態
先天性気管狭窄の症例の60~80%で先天性心疾患を合併する17–19).逆に先天性心疾患の1%強で先天性気管狭窄を認める20).
気管・気管支(肺)と心臓・大血管は,胸郭内の限られたスペースで物理的に影響し合う.気管上部のレベルでは大動脈弓やその分枝である腕頭動脈が気管前方に,気管分岐部から気管支レベルでは右肺動脈が気管分岐部と右主気管支の前方に,左肺動脈は左主気管支を乗り越え,左房は気管分岐部の下方に位置する.左右短絡性心疾患では,肺動脈・肺静脈・左房が多くの循環血流により拡大し,気管分岐部や気管支を圧迫することで狭窄を増悪させる.また,肺動脈スリング(後述)では左肺動脈に取り囲まれた気管下部がより強く影響を受ける.さらに,高肺血流に起因した静水圧上昇も,Starlingの法則における平衡状態を毛細血管レベルで破綻させ,間質や肺胞腔への水分漏出による浮腫を生じ,気管狭窄増悪の要因となる21).静脈圧上昇による肺内リンパ流の障害も,肺浮腫の病態に影響する.肺浮腫により肺のコンプライアンスは低下し,呼吸努力も増大する.そして,気管支の浮腫や気管支周囲のうっ血による末梢気道の物理的圧迫も,気道狭窄悪化の要因となる.末梢気道の狭小化により気道分泌物の排出障害が生じ,感染を合併することでさらに悪化する.このように先天性気管狭窄の症状は循環動態の影響でより顕著となり,気管形成術前の挿管やECMO導入の機会が増える要因となる.
肺動脈スリングを合併する先天性気管狭窄の病態
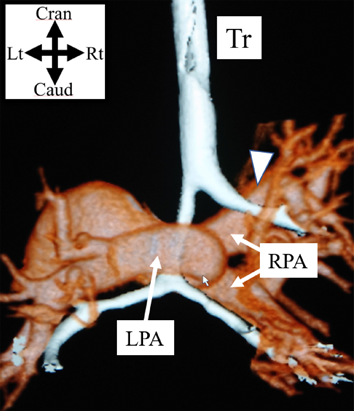
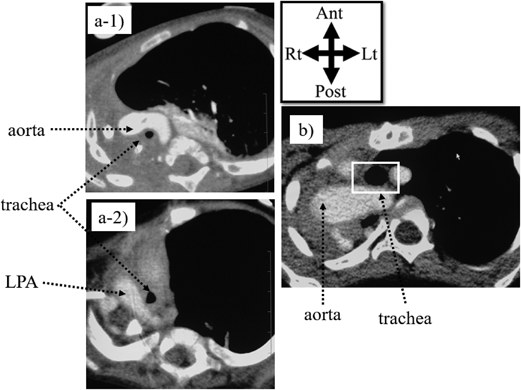
肺動脈スリングは,先天性気管狭窄に合併する頻度が特に高い心血管疾患である(40~50%)1, 13–15, 22).肺動脈スリングの解剖学的特徴は,左肺動脈が右肺動脈から起始し気管の背側に回り食道との間を走行し,左主気管支の背側を沿い左肺門部に至ることで,気管下部および気管分岐部に圧迫を来す位置関係にある(Fig. 3). 「右」肺動脈スリングは検索できる範囲で内臓錯位(両肺で左肺の気管分岐パターン)の1例が報告されているだけであり23),肺動脈スリングという場合,通常「左」肺動脈スリングを指す.肺動脈スリングでは,約50%の症例で完全輪状軟骨輪を伴う気管狭窄を認める(‘ring-sling complex’と呼称される)24, 25).
肺動脈スリングには,気道症状が目立たない症例もある.学童期の小児186,213人を網羅的に調査した台湾の調査では,11名(17,000人に1人の割合)に肺動脈スリングを認め,その内7例で完全輪状軟骨輪が確認された26).11名の内10名で反復性の気道感染が,9名で喘鳴を有する咳嗽の既往が見られたが,肺動脈スリングの診断は受けていなかった.気道症状が軽微な患者の中にも肺動脈スリングが潜んでいる場合がある.一方で,先天性気管狭窄と肺動脈スリングを合併する場合に,他の心血管疾患を33~68%で合併し14, 16, 27).心血管疾患を合併しない症例に比べ,症状がより早期に顕在化する13).気管が物理的に圧迫される影響についても,心血管疾患合併例では気道の軟化リスクが高まり,術後に軟化症が残存・顕在化することも指摘されている16).このことは,肺動脈が近接して気管・気管支を圧迫する解剖学的関係にあり,高肺血流など心血管疾患による循環動態の異常が圧迫の増悪因子となることからも説明できる.
肺動脈スリングは気管分岐異常を合併しやすく,Wellsらは合併率81%と報告している28).一方,Songらは気管分岐異常を合併した先天性気管狭窄の症例の61%に肺動脈スリングを認めたと報告している29).また,気管分岐異常の中では,bridging bronchusの68%に肺動脈スリングの合併が認められ,両者の関係が深いことを示している.胎生4~8週における気管発生の異常が,肺動脈スリングの形成にも関与すると考えられる.Chenらは,肺動脈スリングの発生機序として,気管・気管支芽の発生時期に,気管の右側に余剰スペースが生じることが原因とする‘space available’仮説を提唱している30).正常肺動脈は,左右の第VI咽頭弓動脈中枢部と同側の肺内血管叢が結合することで形成される.‘Space available’仮説では,気管の右側に生じた余剰スペースで,左肺内血管叢が気管・食道間の血管叢(postbranchial channels)を介して右第VI咽頭弓動脈由来の右肺動脈中枢部と結合することにより,肺動脈スリングが起こると説明している.気管右側に発生することの多い気管気管支などの気管分岐異常の合併が多いことも,この仮説を支持するものと考えられる.
肺動脈スリングの自験例
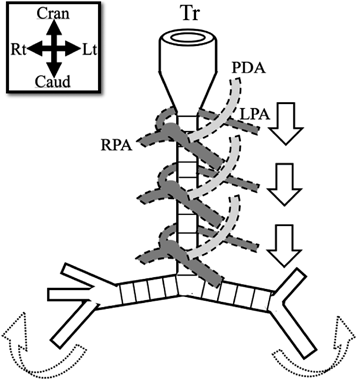
東京都立小児総合医療センターに入院した完全輪状軟骨輪を伴う気管狭窄の症例(72例の気管狭窄の全症例のうち,片側肺低形成・無形成の症例をのぞいた61例)で,左肺動脈スリング合併群と非合併群で,CT画像を用いて気管の特徴を分析した13).肺動脈スリング合併群は26例(43%)で,症状の出現率や気管への介入率が有意に高かった(Table 1).画像の特徴としては,肺動脈スリング合併群で以前から指摘されている通り25, 28, 31),気管狭窄範囲は大きく,気管分岐角は広く(‘inverted T’と報告されている),気管分岐部が有意に尾側方向に存在していた(Table 2).また,合併群で気管気管支などの気管分岐異常が多く,右肺がやや低形成で,‘space available’仮説を支持する所見であった.肺動脈スリングに完全輪状軟骨輪を伴う気管狭窄が高率に合併する機序は不明だが,肺動脈だけではなく,胎生4~8週の前腸とその周囲の間葉系細胞の発生異常が同時に起こった結果と考えられる32).胎生期の心臓大血管系は,胚の最も頭側で発生し,尾側に下降することをふまえ,肺動脈スリングと画像所見で確認された気管狭窄の形態が同時に発生する機序をFig. 4に示すように推測している:すなわち,頭側の位置で左肺動脈が右肺動脈中枢部に結合すると同時に気管後壁は食道から完全に分離され,気管の後面を形成する膜様部が欠如して,周囲の間葉系細胞が気管全周に分布し軟骨が輪状に形成される.そして,気管を前方から右肺動脈が,右方・後方から左肺動脈が,左方から左動脈管が囲むように存在し,そのまま心臓・肺動脈の下降に伴って長軸方向に絞られる(squeezing and milking)ことで,狭窄範囲が長く,気管分岐部が尾側に牽引されて気管分岐角が広角となり,完全輪状軟骨輪を合併した左肺動脈スリングの形態が形成される,という仮説である.
Table 1 Comparison of patient characteristics in the LPAS and non-LPAS groups | LPAS | Non-LPAS | p Value |
|---|
| Total no. of bilateral lung patients | 26 | 35 | |
| Male, n (%) | 15 (58) | 25 (71) | .29 |
| Symptoms, n (%) | 26 (100) | 27 (77) | .02 |
| Intervention, n (%) | 19 (73) | 15 (43) | .02 |
| Bronchial anomaly, n (%) | 15 (58) | 8 (23) | .008 |
| Bilateral SVC, n (%) | 18 (69) | 11 (31) | .005 |
| Complication | | | |
| Heart defect, n (%) | 10 (38) | 16 (46) | .61 |
| Gastrointestinal/anorectal defect, n (%) | 7 (27) | 5 (14) | .33 |
| Genitourinary defect, n (%) | 9 (38) | 2 (6) | .008 |
| Musculoskeletal defect, n (%) | 10 (37) | 6 (17) | .07 |
| Chromosomal aberration, n (%) | 1 (4) | 9 (26) | .03 |
| LPAS, left pulmonary artery sling; SVC, superior vena cava |
Table 2 Comparison of qualitative variables in the LPAS and non-LPAS groups | LPAS | Non-LPAS | p Value |
|---|
| Th, median (IQR) | 5.25 (5.0–5.5) | 4.5 (4.0–5.0) | <.001 |
| RBA (°), median (IQR) | 75.7 (66.8–81.7) | 44.0 (39.4–50.3) | <.001 |
| LBA (°), mean (SD) | 54.8 (13.9) | 54.4 (9.4) | .89 |
| SCA (°), median (IQR) | 129.9 (118.3–140.9) | 100.7 (87.3–111.9) | <.001 |
| Cardiac axis (°), median (IQR) | 50.3 (37.6–65.0) | 41.1 (35.1–49.5) | .06 |
| %range, median (IQR) | 56.7 (46.4–67.0) | 42.3 (32.7–51.9) | .02 |
| %stenosis, mean (SD) | 54.4 (10.2) | 62.2 (9.7) | .005 |
| %carinal depth, mean (SD) | 51.8 (7.0) | 41.7 (7.1) | <.001 |
| IQR, interquartile range; LBA, left bronchial angle; LPAS, left pulmonary artery sling; RBA, right bronchial angle; SCA, subcarinal angle; SD, standard deviation; Th, thoracic vertebral level of the tracheal bifurcation; %carinal depth, ratio of carinal depth from thoracic entry to total thoracic height; %range, ratio of stenotic length to total tracheal length; %stenosis, ratio of transverse stenotic diameter to reference diameter |
心血管疾患は,肺動脈スリング合併群26例中10例,非合併群35例中16例に合併し,両群間に有意差はなかった.気道症状の出現時期は,肺動脈スリングに心血管疾患を合併した例で有意に早かった.
先天性気管狭窄に対する手術法
狭窄範囲が小さい場合(気管全長の30%以下あるいは軟骨輪が連続6~8個以内)には,狭窄部の環状切除の後,上下の気管を端々吻合することが可能で,術後死亡率1~8%と良好な成績である.一方,狭窄範囲が大きい症例では切除する気管が長くなり,残存する上下の気管のギャップが大きく,直接吻合するには形成部の緊張が強くなるため,この術式は適用できない.そのような症例の外科治療として,1982年のKimuraらの肋軟骨を使用した気管形成術の報告を機に,自己組織を使用した拡大術が行われるようになった33).そして自己組織として,肋軟骨のほか心膜,気管(切除した狭窄部)などが使用されてきたが34),肋軟骨や心膜を使用した術式では肉芽切除やバルーン拡大など再介入のリスクが高く,死亡率も25~50%と高かった.自己の気管(autograft)を使用した術式では,比較的良好な成績が報告されているが,狭窄範囲がより広範だと自己心膜も併用するなどの工夫が必要となる35).
2000年代以降,多くの施設でスライド気管形成術が行われるようになった.この術式では,狭窄部の中間点で気管を横断的に離断し,頭側の気管後壁を狭窄が始まる手前まで縦に切開し,尾側の気管前壁を狭窄が終わった先まで縦に切開36)し,上下の切開部が重なるように「スライド」させ側々吻合する(Fig. 5,原法は,前壁・後壁の切開が上下で逆38)).スライド気管形成術により,最狭窄部の直径は2倍,断面積は4倍となるが,スライドしたぶん,狭窄部分の長さの半分だけ気管が短縮する.最近では,術後の生存率が約90%と報告されている18).この術式の利点は,血流の保たれた強固な自己組織を用いて形成することができ,従来の方法よりも早期に抜管できることである17).また,術後の気管の成長は正常小児と同等であることが報告されており,長期成績も良好である39, 40).
気管支まで狭窄が及ぶ症例にも,スライド気管形成術が応用される17).尾側気管の前壁切開線を,分岐部を超えて気管支狭窄部まで逆Y字に延長し,頭側気管を覆うように吻合する.ただし,形成した部分の捻じれが生じて,狭窄や軟化が進行するリスクもある.中枢部の気管形成がうまくいけば,分岐部狭窄に関しては介入を最小限にしても気管支の成長が見込めるとの報告もあり,現時点では議論が分かれる16).
気管気管支を合併した気管狭窄では,開口部に近接した部分の気管壁が肥厚して縫合が難しく開存性も不良だが,同様にスライド気管形成術が応用される.Wangらは,気管気管支の対側壁(左側)を切開し,離断したもう一方の気管では気管気管支と同側壁(右側)を切開,スライドして側々吻合する「側方」スライド気管形成術を行い,良好な成績を報告している41).ただし,この術式では吻合部が前後に位置するため前後方向の支持力が弱く,呼吸の影響で気管内部へ虚脱するリスクがある.また,気管に血流を供給する気管側壁の剥離が広範に及ぶため,術後に気管軟化症が生じる危険性がある.Moritaらは,気管気管支は右後側方から分岐するため,この部位を尾側気管として前方切開する通常のスライド気管形成術で影響がないと報告している12).
先天性気管狭窄では,術後に気管・気管支軟化症が顕在化した場合,人工呼吸器の使用期間,入院期間,死亡率に影響する1, 19).術前の気管・気管支軟化症の合併率は約20%と報告されているが,術前には狭窄部より末梢の呼気終末圧が上昇(auto-PEEP)することにより,軟化所見が目立たないことも多い1).また重度の気管狭窄の場合,気管支鏡で狭窄部を超えて下部気管や気管分岐部まで観察することは厳しく,CTではダイナミックな気道変化の評価が困難であることから,術前に気管・気管支の軟化症の有無を正確に評価することは難しい.さらに術前に軟化症がなくても,気管形成術の際に周囲の剥離範囲が広範になることで術後の軟化症の原因となり,抜管困難から気管切開が必要になる症例も存在する.術後の軟化症に対しては,ステントを留置する介入法もあるが,時間経過で軟化症が改善することも期待されるので,中長期戦略としてCPAP管理を継続することもある.外科的介入を行わずバルーン拡張を行うと,気管軟骨の断片化が起こり,スライド形成した後に軟化症が発生しやすくなる.ステント留置も効果が限定的で合併症が多い.これらの方法は外科的気管形成術後の再狭窄への介入法に位置づけられる42).一般に金属ステントが使用されるが,肉芽形成のリスクが高く,頻回に再拡張を必要とすることが多いため,術後に再狭窄を来した場合は長期予後が不良である.
先天性気管狭窄への介入の要否
気管狭窄の重症度・予後の予測および外科的介入の要否の検討については,様々な観点から議論が行われてきた.形態的(anatomical)な面からは,気管径の狭窄率や気管全長に対する狭窄範囲の評価が挙げられる.Wilcoxらは,幼児期以降に診断された気道症状が軽微で,狭窄範囲が50%以下の症例の17%で,保存的な経過観察で気管の成長が確認できることを報告した43).Chengらは,さらに狭窄部径が正常部径の60%以上という条件を加えて保存的管理の基準として推奨し,気管径が成長したことを報告している44).Antón-Pachecoらは,形態的評価に加え,気道症状の程度や合併疾患の有無などの臨床情報を加味(anatomo-clinical correlation)し,治療方針を決定することを提唱している45).また,形態的評価に機能面での情報を加味(anatomo-functional information)した客観的指標として,狭窄部における気道抵抗,狭窄部の前後での圧や気流の変化を評価することが挙げられ46),成人で気道にpressure catheterを直接挿入して気道抵抗を算出することにより介入を検討した報告がある47).この方法は,侵襲性が強く新生児・乳児期早期では実施困難だが,最近では3D構築したCT上の気管のgeometryからcomputational fluid dynamicsにより機能的に評価した結果を臨床応用する試みが報告されている48, 49).Mimouni-Benabuらは,気管形態から予測した重症度よりも,computational fluid dynamicsによる狭窄前後の圧変化を予測し評価した重症度のほうが,臨床経過とよく相関すると報告している.気管形態からの重症度予測には,どうしても評価者の主観が入るため,短期および長期予後を見据えた介入について検討する際には,computational fluid dynamicsのような客観的な評価法が望まれる.
先天性心疾患を合併する先天性気管狭窄への外科的介入
先天性気管狭窄に先天性心疾患を合併し,両方への外科的介入が必要と診断された場合,手術死亡率や術後合併症が増加することは想像に難くない.前述のように,呼吸状態と循環動態は密接に関連するので,術前にそれぞれを単独で評価するには困難が伴うが,心血管疾患を修復することで呼吸状態が改善し,気管狭窄への直接的な介入を回避できる症例を術前に診断できれば,上記のリスクを減らすことができる.Wangらは,狭窄径が正常径の60%を超える場合には心疾患の修復だけを実施し,40~50%の狭窄径であれば,臨床症状によって気管への介入を検討することを提唱している41).
心血管疾患に加えて気管への外科的介入を実施する場合,段階的に介入する(staged repair)か,同時に介入する(simultaneous repair)かについて検討しなければならない.段階的介入でも同時介入でも,体肺動脈短絡手術など人工物を使用する際には縦隔炎などの感染症に一層留意する必要があり,専門施設へ事前に相談することを考慮するべきである.Staged repairの場合,気道,心血管疾患のいずれの外科手術を先行するのが良いかを熟慮する.気道への介入を先行する場合,周術期に循環動態が安定しておらず末梢循環不全やチアノーゼにより形成部の縫合不全や感染の問題が生じる.心血管疾患への介入を先行する場合,人工心肺の影響や術後の低心拍出状態から間質浮腫が増大し,気管狭窄部の狭小化が進行して気道管理に難渋する5).Okamotoらは,同時手術を行った症例のなかで死亡した例について検討し14),リスク因子として人工心肺時間,複雑心疾患の合併を挙げている.Staged repairでは,頻回の開胸操作による感染や癒着剥離による出血のリスクが上がるため,複雑先天性心疾患に限ってstaged repairとすることを検討するのが肝要と考えられる.スライド気管形成術により治療成績が向上したことで,心血管疾患とのsimultaneous repairも良好な成績を収め,広く実施されている22, 41).心血管疾患が一期的に修復可能であれば,検討する価値のある戦略である.一方,Fontan型手術など心血管疾患に段階的介入を行う場合は,チアノーゼや循環動態の不安定性があり,今後の課題である22).RACHS-1などにより,心血管疾患修復術の難易度による層別化を行い50),どのレベルまでがsimultaneous repairに適しているか,症例を集積し検討する必要があるだろう.
肺動脈スリングを合併する先天性気管狭窄への外科的介入
完全輪状軟骨輪を合併しない肺動脈スリングでは,気道症状のない症例は保存的に経過観察する.症状がある症例には左肺動脈の移植術を行い,血管による気管への圧迫を解除することで気管への直接介入を回避し,その後の気管の成長を期待する.気管そのものの発生異常を伴わない血管輪(重複大動脈弓など)でも,血管の手術により気道の圧迫を解除すれば,気管・気管支の成長が見込めるのと同様である.
一方,完全輪状軟骨輪を伴う肺動脈スリングの場合,肺動脈の移植による血管の圧迫を解除しただけでは気道狭窄が残存し,気管形成術を検討しなければならない.Wilcoxらは,肺動脈スリングに完全輪状軟骨輪を有する気管狭窄を合併した32例中1例のみで,気管への直接介入を回避できたと報告している43).Huangらは,完全輪状軟骨輪を認める場合でも,3 mm以上の径があれば左肺動脈の移植術のみで気管への直接介入を回避できたことを報告している51).狭窄範囲に言及した報告としては,Hongらが14例中7例で狭窄範囲が50%以下で,左肺動脈の移植術のみで気管への直接介入なしに気道症状の改善を得たと報告している52).また,狭窄部径も考慮に入れたDLR(diameter/length ratio;狭窄部径(mm)/狭窄範囲(%)/100)についても検討し,気管介入群5.07±2.37,非介入群10.81±3.87と有意差が見られ,気管への直接介入の適用の判断に有用と報告している.Haradaらも同様にDLRに着目し,気管への介入リスクを予測するcut-off値を5.9以下と報告している53).
術式として,スライド気管形成術と左肺動脈移植術の同時手術による良好な成績が報告されている16).Songらは,スライド気管形成術により気管支分岐部が頭側に引き上げられ,気管に対する左右の気管支の分岐角が小さくなることで,流体力学的に吸入気が慣性にしたがってスムーズに気管支に流入することを期待できるとして,この術式を積極的に推奨している29).その効果は,術前に‘inverted T’と表現される広角な気管分岐角を特徴とする肺動脈スリングで,他の先天性気管狭窄よりも大きいことが期待できる.肺動脈スリングの症例で,気管支の分岐角が大きい側で吸入気の流入量のバランスが不良であることは,Qiらのcomputational fluid dynamicsを用いた解析で示されており,流体力学的観点からもスライド気管形成術の有用性は高いと考えられる54).
一方,Chenらは肺動脈スリングの50%の症例で周囲の血管による圧迫所見があり,気管分岐部の軟化症の発症に関連し,さらに25%の症例では狭窄範囲が気管支までおよび,術後の再狭窄や気管・気管支の軟化症のリスクならびに死亡率が上昇すると分析している16).また複雑先天性心疾患合併例では,同時手術により人工心肺時間が長時間となり,術後合併症や死亡リスクが高まるという報告もある14).
片側肺無形成
先天性気管狭窄の症例の内,10~20%は片側肺が無形成(片肺)である55–57).肺実質,血管,気管支のすべてが形成されない場合をpulmonary agenesis,痕跡的な気管支が見られる場合をpulmonary aplasiaと分類する58).胎生4~8週の肺芽,気管支芽の発生段階の異常によるものと考えられおり59),発生時期が一致することから,これまで述べてきた両肺を持つ先天性気管狭窄のvariantと考えられる.症状は両肺症例と変わらないが,重症化リスクが高い.Bakerらは,症状の出現時期は有意差がなかったものの,両肺の20%に対して,片肺では73%の症例で術前に挿管・人工呼吸器管理が必要だったと報告している57).
片肺症例の気管形成術の死亡率は,スライド気管形成術が普及する以前は33~65%と予後不良だった57).しかし,片肺症例でもスライド気管形成術が広く行われるようになり,死亡率は10~15%まで低下し,両肺症例と大差ないと報告されている55, 56).また,術後のバルーン拡張などの介入,気管切開などのリスクも両肺症例と同等である.
左片肺症例(右肺の無形成)では,気管・心臓・縦隔が右方に大きく偏位し,前方から大動脈弓が気管を後方に圧迫するため,右片肺症例(左肺の無形成)よりも予後不良であることが多い60).気管形成を行うだけでは大動脈による圧迫が残存し,気道症状が改善しないことが懸念される.Tissue expanderを心臓の右方に位置するように胸腔内へ留置し,心臓の偏位を矯正する方法(mediastinal repositioning)は,(片側)肺全摘後症候群の呼吸窮迫症例に対する治療として考案され,先天性の片肺症例でも有効である報告が散見されるが59, 61),心臓を物理的に圧迫するため循環動態の変化に注意が必要である62).大動脈弓による圧迫を解除する方法としては,そのほかに気管形成術と同時に気管を大動脈弓前方にtranslocationする方法がある.形成後の気管長が不足しtranslocationすることが難しい症例では,気管形成術と同時に大動脈弓を前方に吊り上げる手術が検討される57, 63).一方,右片肺症例(左肺の無形成)では,気管への心臓,大動脈の影響は少ないが,右大動脈弓である場合や,高肺血流性心疾患合併例で右肺動脈が拡張する場合には,気管分岐部および右主気管支が圧迫されるリスクがあり,注意が必要である64).
心血管疾患の合併率も43~55%と両肺の症例と変わりがない56, 57).心血管疾患の手術に関しては,左片肺症例では心臓・縦隔の右方偏位に伴い上大静脈,大動脈,右房が右後方に偏位し,正中からの人工心肺の確立および心内修復のための視野が限定されるなど,手技上の問題が生じる.Hasegawaらは,左片肺症例で心室中隔欠損や総肺静脈還流異常の手術において,気管形成の同時手術が不要と判断した症例で右側開胸を選択し,良好に人工心肺を確立し,心内操作時の視野を確保したと報告している60).また,左片肺症例に合併した大動脈縮窄複合の外科手術として,Blalock-Parkおよび肺動脈絞扼術を行う際には,通常の左側開胸を選択して問題なく実施できたことも報告している.
左片肺に合併する肺動脈スリング
左片肺(右肺無形成)では右肺動脈が存在しないが,左肺動脈が気管と食道の間を走行して肺門部まで左主気管支の背側を走行する,肺動脈スリングと同様の解剖学的特徴を有する症例がある.この場合,完全輪状軟骨輪を伴う気管狭窄を合併することが多く,‘pseudo-ring-sling complex’とも呼ばれる65).左片肺の場合,前述したように気管・心臓・縦隔が右方へ偏位し,大動脈弓が気管を前方から圧迫するため,pseudo-ring-sling complexでは気管が大動脈弓の高さでは前方から後方へ,左肺動脈の高さでは後方から前方へ圧迫され,右側方からみると気管形状が‘S-shape’となる.気管は縦隔とともに側方に偏位するのに加えて前後方向にも屈曲するため,狭窄症状が重篤化する可能性がある66).この場合,小児期を無症状で過ごすことは少なく,成人期に達して診断された報告例は1例だけである67).
自験例では,6例の左片肺症例のうち3例でpseudo-ring-sling complexを合併していた.胎生4~8週の気管・気管支形成期に右肺が形成されなければ,気管の右側には両肺症例よりも多くの余剰スペースが存在することとなり,pseudo-ring-sling complexの発生機序としても前述した‘space-available’仮説が支持される.
手術治療は,気管径が比較的保たれているようであれば左肺動脈を気管前方に移植し,さらに大動脈つり上げ術を追加する.気管径の拡大が必要な場合には,スライド気管形成術を適用する.また,気管形状が‘S-shape’となっていることから,スライド気管形成術と同時に気管を大動脈前方にtranslocationする術式も報告されている57).自験pseudo-ring-sling complexの2例では,いずれも左大動脈弓,右下行大動脈で狭い大動脈弓のスペースのためさらに気管が圧迫される形態で,スライド気管形成術に気管のtranslocationを併用して有効だった(Fig. 6).
Down症候群
Down症候群では鼻咽頭,喉頭,声門下の狭窄を認めることが多く,心疾患を合併すると循環に加えて呼吸状態が悪化する.したがって,Down症候群で心疾患を有する患者の診療では,循環動態だけではなく呼吸状態にも注意して評価する必要がある.Down症候群に完全輪状軟骨輪による先天性気管狭窄を合併した報告例は,検索できた範囲で19例,その内13例(68%)に心疾患を合併し,10例では心疾患周術期の挿管ないし抜管困難により気管狭窄が明らかになっていた68–74).残りの6例では,5例で気道症状の治療や精査,1例で心疾患以外の手術挿管時の挿管困難が診断の契機になっていた.心疾患を有するDown症候群の患者で気管狭窄を合併しやすい可能性があるが,心疾患の手術や心臓カテーテル検査のために挿管の機会が増えることにより,診断の契機が増えているとも考えられる.報告数が少なく定まった見解とは言いがたいが,Down症候群に合併する気管狭窄では,狭窄が気管の中部に限局して気管分岐部に及ばず,「砂時計」型の形態を呈する症例が多い69, 72, 75).狭窄部位が限局し,気道症状が比較的軽微なため,気道症状以外の要因で診断される機会が多くなる.
自験例では,72例の気管狭窄の患者のうち,8例(11%)がDown症候群だった13).8例のうち1例が心臓カテーテル検査,3例が心疾患手術時の挿管困難で診断に至っており,既報と同様に半数が心疾患を契機に気管狭窄が診断されていた.また,狭窄範囲は41%(40~66%)と限局性の傾向が強く,8例中7例で既報の「砂時計」型の気管形態を認めた.Down症候群における先天性気管狭窄は決して希少な病態ではなく,特に心疾患を合併するDown症候群患者の診療では,気管狭窄の合併も念頭におく必要があると思われる.