ダイレクトリプログラミングという概念自体は意外と古く,1987年に骨格筋のマスター因子としてMyoDが同定され,MyoDの遺伝子を線維芽細胞で強制発現させることで,骨格筋の元になる筋芽細胞を作り出すことに成功したのが最初のダイレクトリプログラミングの報告である1).その後,世界中の研究者が各臓器への分化転換を促すリプログラミング因子の探索に乗り出したが,単一の細胞特異的な因子の同定には至らなかった.2006年に山中らによってES細胞に発現するOct4, Sox2, Klf4, c-Mycの4つの転写因子を人工的に線維芽細胞に発現させると,細胞が初期化されiPS細胞が作製されることが示され,複数因子の組み合わせによる特定の臓器へのリプログラミング研究が大きく加速した2, 3).
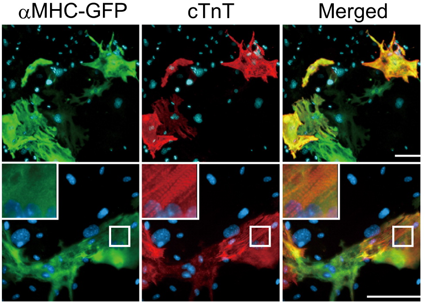
そして心筋リプログラミングにおいては,2010年に我々が世界で初めて線維芽細胞を拍動心筋へと誘導することに成功した4).心筋リプログラミング因子の同定に向け,始めに我々は成熟分化した心筋細胞でのみ特異的に蛍光タンパクGFPを発現するαミオシン重鎖(MHC)-GFPマウスを作製し,線維芽細胞(GFP陰性)から心筋細胞(GFP陽性)の誘導を定量的に測定しスクリーニングできる方法を確立した.この実験系を用いて,胎児期心筋細胞に特異的に発現し,且つ心臓発生に重要な14個の遺伝子を絞り込んだ.さらに,その14因子のレトロウイルスベクターを作成し,それぞれの遺伝子を線維芽細胞に導入することで最終的にGata4, Mef2c, Tbx5(GMT)を心筋ダイレクトリプログラミング因子として同定した(Fig. 1).この3因子を線維芽細胞に導入することで心筋特異的な遺伝子発現パターンが認められ,さらにはαアクチニンや心筋トロポニン(cTnT)などの収縮関連タンパク質の発現とサルコメア構造が確認された(Fig. 1).また誘導された心筋細胞(induced Cardiomyocyte: iCM)の一部で,新生児心筋細胞と非常によく似た活動電位が観察され,自律拍動を認めたことから,誘導されたiCMは生理的にも心筋細胞に近い性質を持つ細胞であることが明らかとなった4).
近年,他のグループからの研究成果により,iCMの詳細な特徴も徐々に明らかになりつつある.Zhouらは同一のマウスから誘導したiPS細胞由来心筋とiCMの遺伝子発現を比較した5).その結果,iCMのほうがより成熟心筋細胞に近い遺伝子発現プロファイルを示すことを明らかにした.具体的にはiPS細胞由来心筋は解糖系主体の代謝プロファイルを示すのに対し,iCMは成熟心筋における主要なエネルギー産生系である脂肪酸酸化などの酸化的リン酸化主体の代謝プロファイルを示した.また細胞周期に関連する遺伝子発現もiCMは抑制され,成熟心筋に近いことが明らかとなった.これらの結果が意味することは,心筋ダイレクトリプログラミングは腫瘍形成などのリスクが低いばかりでなく,誘導された心筋自体の成熟度が高いことから,疾患モデルや薬剤スクリーニングなど心筋再生医療を大きく発展させる可能性を秘めている.
ヒト線維芽細胞から心筋へのダイレクトリプログラミング因子の探索
マウスでの生体内リプログラミング実験の成功の結果を受け,次に臨床応用を目指したヒト心臓線維芽細胞における心筋リプログラミング研究が行われた.我々はマウスにおけるiCM誘導と同様の方法でヒト心筋誘導を試みたが,マウスで用いた3因子GMTのみでは,ヒト線維芽細胞を心筋に誘導するには十分でないことが分かった.そこで,ヒト心筋ダイレクトリプログラミング因子のスクリーニングに新たに着手し,GMTに加えMesp1, Myocdを追加した5因子(GMTMM)がヒト心筋ダイレクトリプログラミングに必須であることを報告した9).しかし,誘導されたヒトiCMはサルコメア構造や心筋特異的なタンパク質を発現することが確認されたが,一方で心筋特有の自律拍動は観察されなかった.一方で,ヒトiCMをラット心筋細胞と共培養することで同期収縮がみられたことから,GMTMMによってヒト心臓線維芽細胞を心筋様細胞に誘導できることが示唆された.同時期に,海外の研究室からもヒト心筋ダイレクトリプログラミング因子として,Gata4, Tbx5, Hand2, Myocd, miR-1, miR-133の6因子や,GMTにMesp1, Myocd, Esrrg, Zfpm2を加えた7因子によってヒト線維芽細胞を心筋誘導できたと報告されている10, 11).しかし,これまでヒトiCMにおいて自律拍動した報告はなく,マウスに比べ心筋誘導効率が低く,より多くの遺伝子が必要となるため,今後さらなる転写因子探索や培養条件の検討が必要である.
近年のシングルセル解析の発展に伴い,これまでヒト細胞における心筋ダイレクトリプログラミングが困難である理由や心筋リプログラミングにおける過程が徐々に明らかになりつつある.Qianらのグループはヒト線維芽細胞に心筋リプログラミング因子を導入後,さまざまなタイムポイントでシングルセルRNA sequencing(scRNA-seq)を行った12, 13).マウス線維芽細胞と同様に細胞周期の活性化状態,即ち増殖期の細胞において,リプログラミング効率が有意に低下することが明らかとなった点に加え,彼らは心筋リプログラミング因子導入後にヒト線維芽細胞が心筋細胞になるか(Reprogramming route),あるいはならない(Refractory route)という“decision point”をRNA velocity解析によって見極めることに成功した.しかしながら,具体的にこの“decision point”が何によって規定されているかは明らかでなく今後の課題である.また,マウス線維芽細胞から心筋細胞へのリプログラミングにおいては,炎症や免疫反応が心筋リプログラミングの障壁になることが報告されているが,ヒトにおいては全く逆の結果を示した点は非常に興味深い.自然免疫受容体Toll-like receptor 3(TLR3)を心筋リプログラミング因子導入後に抑制した場合,心筋リプログラミング効率が有意に低下することがわかった.この原因として,TLR3を含む自然免疫系シグナルは心臓関連遺伝子(Myh6/7)におけるDNAのメチル化状態を変容させる可能性が示されている.このように,マウスとヒトではリプログラミングに重要な要素が大きく異なる可能性があり,マウスで得られた知見が必ずしも正しいとは限らないことを意味している.今後の基礎研究として,マウス細胞を用いたより詳細な分子生物学アプローチに加え,臨床応用に向けては実際のヒト検体を用いた基礎研究を同時に行っていく必要性があるだろう.
高効率な心筋ダイレクトリプログラミング法の開発と現状
2010年に我々が最初の心筋ダイレクトリプログラミングを報告して以来4),我々を含む国内外のさまざまな研究室が,心臓ダイレクトリプログラミング法のさらなる改良を進めている14).心筋へのダイレクトリプログラミングを促す新たな転写因子の探索に加え,microRNA(miRNA)を介した心筋誘導などが報告されている.また,別のアプローチとして,細胞培養時の基質の検討,サイトカインや薬剤の付与などもこれまで数多く検討されている.
miRNAはタンパク質をコードしない21–24塩基程度の小さなRNAであり,mRNAからタンパク質への翻訳抑制やmRNAの分解による転写後制御を行なっている.またmiRNAの大部分が異なる種間でも保存されているという特徴がある.Jayawardenaらはレンチウイルスを用いて4つのmiRNA(miR-1, miR-133, miR-208m miR-499)を心筋梗塞後のマウス心臓に直接投与することで,心筋ダイレクトリプログラミングに成功し,心機能の改善と線維化の低下が起きることを報告した15).また,我々によって行われた研究によってGMTにmiR-133を加えると短期間で効率よく心筋が誘導できることが明らかになった16).さらにこの論文の重要な点として,miR-133はマウスだけでなく,ヒト線維芽細胞における心筋誘導効率を10倍程度改善することに成功し,miRNAがヒト心筋のダイレクトリプログラミングにも大きな役割を担う可能性が示された.この機序としては,miR-133が上皮間葉転換のマスター因子であるSnailのタンパク質発現を抑えることで,線維芽細胞関連遺伝子の遺伝子発現を抑制していることが考えられる16).これらの結果は線維芽細胞としての形質を抑えつつ,心筋誘導を行うことがより効率的なiCMを誘導する上で重要であることを示している.
ダイレクトリプログラミング効率を劇的に上昇させる増殖因子の発見は簡便・安全という観点から臨床応用にとって重要な発見である一方で,実際の実験現場で使用される増殖因子は非常に高価であり,より低コストな低分子化合物等で置き換える手法も試みられている.Zhaoらは線維芽細胞の形質維持機構が心筋へのリプログラミングを阻害していると考え,線維芽細胞の増殖能や遊走能に重要な分子であるTGF-b, ROCK, Wntに着目した.ZhaoらはTGF-b, ROCK経路を低分子化合物で阻害することにより,心筋ダイレクトリプログラミングの効率が促進するだけでなく,より早期に拍動する心筋細胞がマウス胎児線維芽細胞から得られることを報告した17).また,Mohamedらも,5,500種類の化合物からスクリーニングを行い,WntシグナルやTGF-βシグナルの阻害薬によって,GMTによる心筋ダイレクトリプログラミングの誘導効率が上昇することを報告している18).その他にも心筋ダイレクトリプログラミングを促進するシグナル伝達経路として,Aktシグナルの重要性が示唆されている.HashimotoらはGMHTに加え,Akt1を過剰発現させることで,心筋リプログラミング効率の改善に成功した19).さらに,Akt1を入れた場合ではより成熟した心筋が誘導されることも同時に示している.
適切な培養条件が効率的なリプログラミングを左右する重要な因子であることは,生物の発生過程において周囲の環境(ニッシェ)が細胞運命決定に重要な役割をしていることからも疑う余地がない.特に周囲の細胞から放出される液性因子や細胞間接着及び,細胞外マトリクスとの接着などを含むニッシェとの相互作用や機械刺激(メカノストレス)は細胞の運命選択において非常に大きな役割を果たすと考えられている.iPS細胞から心筋を効率よく誘導するためには,無血清培地に生体内での心臓発生時のシグナルを模倣するような化合物や増殖因子を加えることが知られている.このような背景から,我々の研究グループは心筋誘導因子の中から,心筋ダイレクトリプログラミングの効率を劇的に変化させるものがあるかを独自にスクリーニングした.その結果,線維芽細胞増殖因子であるFGF2, FGF10,血管内皮細胞増殖因子VEGFを同定し,これらを培地に付加することで,従来の方法に比べて40倍の効率で,拍動心筋を誘導できることを明らかにした20).さらにこれらの因子があることでGata4の内在性の発現を誘導するために,Mef2c, Tbx5の2つの遺伝子のみで心筋誘導をすることが可能になった.
細胞間,細胞外マトリックスを介したメカノストレスはクロマチン状態の変化を誘導し遺伝子発現変化に影響を与えることが知られている.実際に3次元ハイドロゲルで培養すると,2次元の通常培養に比べmiRNAを介した心筋ダイレクトリプログラミング効率が上昇するということがすでに報告されている21).通常の培養皿の硬さは1 GPa程度にあるのに対して,筋肉や心臓は8–17 kPaと非常に柔らかい.実際に,我々は近年GMHTによる胎児線維芽細胞からの心筋ダイレクトリプログラミングをより生体心筋に近い硬さ(8 kPa)のハイドロゲルで培養することで,より効率よく心筋を誘導できることを報告した22).機序としては,細胞接着に関与するインテグリン受容体の下流に存在する転写共役因子YAP/TAZの発現を抑制することで線維芽細胞関連遺伝子の発現を抑え,心筋誘導効率を上昇させると考えている.
心筋ダイレクトリプログラミングの大きな障壁は線維芽細胞の形質維持機構に加え,加齢変容が挙げられる.胎児線維芽細胞と比較して,成体の線維芽細胞における心筋リプログラミング効率は有意に低下する.その具体的な分子機序が明確でないばかりでなく,実際の臨床応用においては胎児や未熟な細胞を対象にすることはないため,成体の線維芽細胞で効率よく心筋を誘導することが望まれる.そこで,我々は8,400種類の化合物ライブラリーから,心筋誘導を促進する4つの化合物を同定した.その中でも特に,臨床でも汎用されている非ステロイド性抗炎症薬ジクロフェナクが加齢に伴う炎症を抑制することで,これまで誘導が困難であった成体マウス線維芽細胞から心筋へのダイレクトリプログラミング効率を改善することを証明した23).このように線維芽細胞自身が出す炎症物質やその経路を低分子化合物や既存の薬剤等で遮断することで,安価で効率的な心筋誘導法が確立される可能性が示された.
今後はさらなる新しい知見を積み上げることはもちろんのこと,これまでの発見をさらに緻密に精査し改善していく必要がある.例えば,心筋リプログラミングにおいて,導入因子の量的バランスが心筋誘導効率に重要な可能性が示唆されている.WangらはGMTの3因子のうち,Mef2cの発現を高め,逆にGata4, Tbx5の発現を弱めることで心筋リプログラミングが促進すると報告しており24),今後GMTの量的バランスをさらに詳細に検討する必要があるだろう.また各転写因子が果たす役割についてもさらなる検討が必要である.これまでに,ChIPシーケンシング等の手法によって,GMT導入後,速やかに線維芽細胞関連遺伝子のエンハンサー領域がサイレンシングされ,心筋関連遺伝子のエンハンサー領域が活性化されることが報告されている.これに加え,Hand2やAkt1を加えることで,GMTがより同調し,心臓関連遺伝子のエンハンサー領域に集積することでターゲット遺伝子の発現を高めることが示された19).またStoneらはMef2cとTbx5の導入によって,クロマチンのリモデリングが誘導され,特定の遺伝子領域にアクセスしやすくなる状態を作り出すことで,心筋誘導を促すことを報告している25).各リプログラミング因子が持つ役割を詳細に解析することで,各因子の導入や発現のタイミングなどの検討も今後重要なファクターとなってくることが予想される.
さらに,これまでにベクターによる遺伝子導入を全く用いない低分子化合物のみでの心筋細胞誘導も報告されている26, 27).Caoらは9つの低分子化合物を入れることで,ヒト線維芽細胞を機能的な心筋に誘導できると報告している27).一方で,この手法による誘導では,心臓前駆細胞の遺伝子発現が誘導されており,線維芽細胞から直接心筋細胞を誘導するGMTによるダイレクトリプログラミング法とは,異なる機序であることが示唆される.しかし遺伝子やウイルスベクターを用いないことでより安全で,細胞培養等における制御も比較的容易いことがメリットであり,今後それぞれの低分子化合物の心筋特異的遺伝子への影響を明らかにすることで,新たな方法が開発されることが期待される.
このような心筋誘導効率を上昇させる研究とは別に,多分化能・増殖能をもつ心臓幹細胞を誘導するという研究も心臓再生医療にとって重要である.我々の研究グループのSadahiroらは胎児期の心臓を含めた中胚葉に広く発現する転写因子Tbx6をES細胞・ヒトiPS細胞といった多能性幹細胞に導入することにより,液性因子を使用せずに効率よく増殖可能な心臓中胚葉様細胞を誘導できることを見出した28).またTbx6の発現期間を調整することで,同じく中胚葉である骨格筋や軟骨細胞を誘導することが可能であることを同時に発見し,Tbx6の発現とその期間が中胚葉組織の運命決定に重要であることが明らかとなった.Tbx6が心臓中胚葉を誘導する分子メカニズムとしては,Tbx6は心臓発生に重要なMesp1やBMP4といった遺伝子発現を一過性に上昇させることで,心臓中胚葉を誘導することが示された.さらに重要な点として,心臓中胚葉は心筋だけでなく,平滑筋や血管内皮細胞などの心臓を構成する細胞へと分化する能力を持つことから,今後さらなる詳細な検討を行うことで,胎児期や新生児期のような再生能力をもった心筋に加え,心臓を構成する血管内皮細胞や平滑筋などの非心筋細胞を生体内で同時に誘導できる画期的な方法が実現できる可能性を秘めていると言えるだろう.
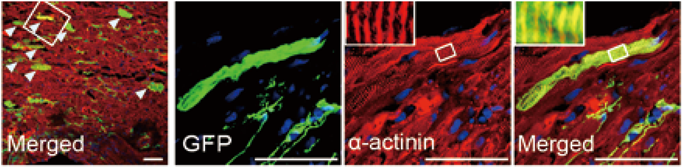
このようにこれまで多くの研究によって,心筋ダイレクトリプログラミングが少しずつ応用に向け進歩している.しかし,当初の目的である臨床応用にあたっては未ださまざまな課題が挙げられている.その一つが,遺伝子導入ベクターの問題である.従来のマウス心筋リプログラミング法では,レトロウイルスベクターやレンチウイルスベクターが遺伝子導入手段として用いられてきたが,感染した細胞のゲノムDNAにランダムに組み込まれ,DNAに損傷を与える危険性がある.そこで,我々の研究グループはGMTを同時に発現するセンダイウイルスベクターを作成した(Fig. 2).センダイウイルスはレトロウイルスやレンチウイルスと違い細胞内でゲノムDNAに組み込まれないというメリットがある.実際に,マウス及びヒト線維芽細胞に心筋誘導センダイウイルスベクターを感染させたところ,短期間で効率よく心筋を誘導することに成功した29)(Fig. 2).またセンダイウイルスベクターはレトロウイルスベクターに比べ,導入遺伝子のタンパク質発現効率が高いことが一因である可能性が示唆された.さらに,マウス心筋梗塞モデルにおいて,心筋誘導センダイウイルスベクターを心臓に直接投与すると,約1週間で梗塞部位において心筋が誘導され,1か月後には線維化部位の減少及び心機能の改善を認めた29).このように,安全かつ短期間で心筋誘導ができるセンダイウイルスベクターを用いてマウス急性心筋梗塞モデルにおける有効性を証明できたことは,着実に臨床応用に向けての課題を克服しつつあると言えるであろう.今後,慢性心不全などの別のマウスモデルでの検討を進めていきたいと考えている.
このように,国内外で非常に多くの基礎研究成果が積み上げられ,心筋ダイレクトリプログラミングは臨床応用に向けて着実に前進している(Fig. 3).しかし先に挙げたように解決すべき課題が多く残されているのも事実である.今後はブタなどの大型動物モデルを用いた有効性・安全性の検証に加え,さらに効率的で容易なダイレクトリプログラミング法の開発が必須であろう(文献14,Table 1, 2参照).そのためには,発生学や幹細胞生物学の知見や近年発展が著しいシングルセル解析やゲノム編集,さらには機械学習,材料工学等を用いた研究者の専門を超えた学際的な研究によって,さらなる発展が望まれる.今後のさらなるリプログラミング研究によって,心臓病患者へこの新しい治療法がいち早く届けられる日が来ることを期待している.