総肺静脈還流異常症(total anomalous pulmonary venous connection: TAPVC)は,新生児期あるいは乳児期早期に低酸素血症や低心拍出症候群を生じて緊急手術を要する代表的疾患であり,その治療成績は近年,手術手技の進歩や,診断から治療までの周術期管理の改善により著しく向上した.しかし,多様な肺静脈還流形態を呈する混合型TAPVCや無脾症候群に合併したTAPVCでは,手術方法や術後血行動態,肺静脈狭窄を含む合併症などに関して,未だ一定の見解はなく議論が尽きない.
今回,機能的単心室を有する無脾症児の混合型TAPVCに対する修復術後に,遺残垂直静脈をシャント血管とする症候性門脈体循環シャント(porto-systemic shunt: PSS)を来した稀な症例を経験したので報告する.
なお,論文投稿に関しては保護者に説明し同意を得た.
症例
日齢18,男児
診断
無脾症候群,混合型TAPVC(Darling分類Ib+III),単心房(Single atrium: SA),両大血管右室起始(Double outlet right ventricle: DORV),膜性心室中隔欠損(Ventricular septal defect: VSD),右側大動脈弓(Right aortic arch: RAA),両側上大静脈(Bilateral superior vena cava: bil.SVC),肺動脈狭窄(Pulmonary stenosis: PS),動脈管開存(Patent ductus arteriosus: PDA)
現病歴
胎児エコーで無脾症候群と先天性心疾患を疑われ,在胎38週1日,出生体重2,518 g, Apgar score 8/8点(1分値/5分値)で出生した.出生直後からチアノーゼ,陥没呼吸,呻吟を認め,心エコーで上記診断となり,Lipo-PGE1持続静注を開始した.動脈管径2 mmで開存していたが,徐々に肺静脈狭窄(Pulmonary venous stenosis: PVS)の進行を認め,頻脈と多呼吸,啼泣時チアノーゼ増悪を認めたため,日齢18に循環器内科に転科となった.
転科時現症
身長48.8 cm,体重2,411 g,心拍数150/分,血圧65/29 mmHg,呼吸数50/分,経皮的酸素飽和度80%(室内気)であった.身体所見上,呼吸音清だが多呼吸と陥没呼吸を認め,第3肋間胸骨左縁にLevine III/VI度の収縮期雑音を聴取した.
血液検査
総ビリルビン2.8 mg/dL以外に異常所見は認めず,AST 42U/L, ALT 33U/L,血糖79 mg/dL, APTT 35.1秒,PT-INR 1.01,フィブリノーゲン196 mg/dL, AT-III 83.3%といずれも正常範囲内であった.
胸部単純X線写真
心胸郭比45%.両側肺野の透過性低下と鬱血像を認めた.
心電図
洞調律,心拍数152/分で正常であった.
心エコー
心房内臓位は不定位,d-loop,大血管位は平行.TAPVC(Darling分類Ib+III),SA, DORV, RAA, bil.SVC, PS, PDA.下大静脈と下行大動脈は椎体左側を並行し,VSDは膜様欠損で欠損孔は10 mmで肉柱部方向に大きく進展していた.Fontan手術適応疾患と考えられ,肺動脈漏斗部狭窄を認めるものの両心室の拡大や左右房室弁逆流はなく,心機能は正常範囲内であった.右肺静脈は右垂直静脈を介して左上大静脈に還流するが,動脈管下面で狭窄を認めた.左肺静脈は左垂直静脈を介して狭窄なく門脈に還流した.
造影CT検査
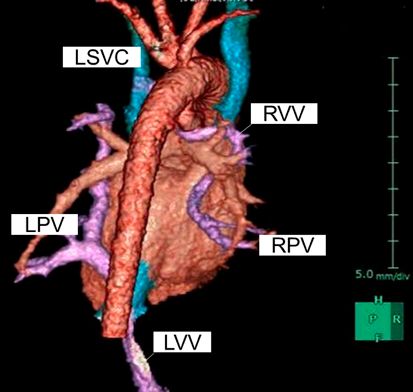
右肺静脈2本は垂直静脈になって後縦隔を蛇行して左上大静脈へ還流し,左肺静脈2本は垂直静脈になって門脈に還流していた(Fig. 1).また,静脈管の開存を認めた.
初回手術
右肺静脈狭窄の進行を伴ってきたため,日齢18にTAPVC修復術を施行した.手術は人工心肺確立後に心停止下,部分的な循環停止および低流量灌流を併用しながら,TAPVC修復術を施行した.右肺静脈は右側アプローチでprimary sutureless法1)を用いて心膜–心房縫合し,左肺静脈は胸腔内走行していたため後方アプローチでLugones法2)に準じて左肺静脈–心膜縫合後に心膜–心房縫合した.右垂直静脈は高度狭窄のため,左垂直静脈は自然閉鎖を期待して共に放置した.肺血流の調整のためにtransannular patchで肺動脈弁狭窄を解除した後に主肺動脈絞扼術(外周19.5 mm)を追加した.人工心肺から離脱し,二期的胸骨閉鎖の方針として手術を終了した.人工心肺時間182分,大動脈遮断時間115分であった.
術後経過
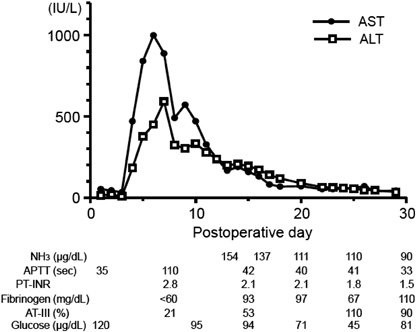
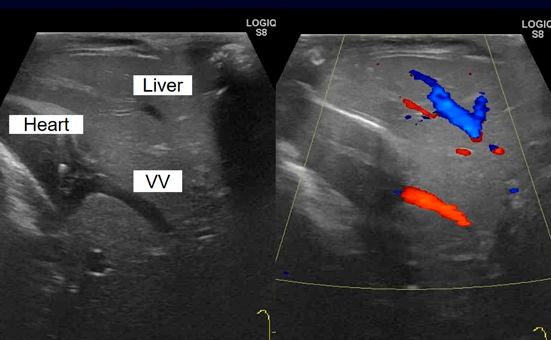
術直後は房室接合部頻拍や経時的な肺血流過多によって循環不安定であったが,術後4日目に肺動脈の追加絞扼を行うことで安定した.同日,肺動脈追加絞扼前の採血で肝逸脱酵素の上昇(AST 985U/L, ALT 359U/L)を認め,術後6日目にかけてAST 1000U/L, ALT 450U/Lまで上昇した(Fig. 2).術後7日目に閉胸したが,術後8日目より凝固能異常(APTT 110秒,PT-INR 2.78,フィブリノーゲン60 mg/dL以下,AT-III 21.1%)を認め,新鮮凍結血漿の投与を5日間要した.術後11日目に腹部エコーを施行したところ,門脈から遺残垂直静脈を介して心房に流入する血流を認め,PSSと診断した(Fig. 3).心エコー上,左右房室弁逆流はなかった.術後13日目には高アンモニア血症(NH3 154 µg/dL)を認め,術後26日目までNH3 100台µg/dLで推移した.術後25日目に低血糖(45 mg/dL)を認めたが,持続経腸栄養とグルコース持続投与を行って改善を得た.以後,血液データはいずれも正常化して,術後47日目にCardiac ICUを退室した.術後60日目に造影CT検査を行い,右肺静脈が心房開口部でやや狭いものの,修復した肺静脈は両側とも開存していることや,静脈管が閉鎖していることを確認し,術後69日目に退院となった.
その後の経過
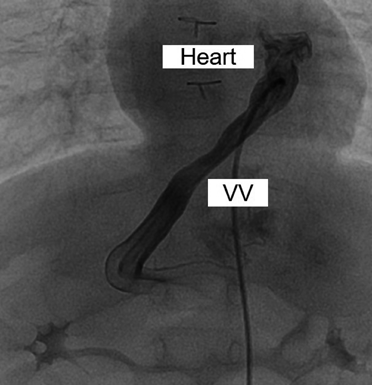
PSSに関して,血液検査において肝逸脱酵素,アンモニア,血糖,および凝固系のいずれも正常範囲内で経過したが,心エコーで左側房室弁逆流を軽度認めた.術後5か月,8か月時に施行した心臓カテーテル検査では,肺血管抵抗1.3–2.1単位・m2と良好であったが,心房圧10–11 mmHgと軽度上昇を認め,PSSによる容量負荷の可能性が考えられた.遺残垂直静脈を閉鎖する方針として,遺残垂直静脈(Fig. 4)の閉塞試験を行ったところ門脈圧は20 mmHgと許容内であった.1歳1か月時に開腹下で遺残垂直静脈の結紮術を試みたが,結紮の際に腸管鬱血を認めたため遺残垂直静脈の絞扼のみに留めた.心臓に関しては,右下肺静脈狭窄が徐々に進行し,経皮的バルーン血管形成術および外科的肺静脈解除術を経て,2歳時に両方向性Glenn手術を施行した.この術後経過の中でPSSの症状や血液検査所見の異常は認めなかった.
先天性心疾患の1~3%3, 4)を占めるTAPVCのうち,Darling分類IV型にあたる混合型TAPVCの発生頻度は5~10%5, 6)である.本症例は,Darling分類のIb型とIII型を併せ持つ混合型であったが,左右肺静脈が二分して,右肺静脈2本が右垂直静脈となって左上大静脈に還流し,左肺静脈2本は左垂直静脈となって門脈に還流する稀な肺静脈還流形態であった.Chowdhuryらの分類7)の「Group of patients with bizarre anatomical variants」に相当するが,類似した形態として左上下肺静脈2本が上大静脈に還流して右上下肺静脈2本が門脈に還流するGuptaら8)の報告や,右上肺静脈が無名静脈に還流して右下肺静脈と左肺静脈2本が合流後に門脈に還流するMishraら5)の報告がある.
一方,PSSは静脈管開存や異常血管がシャント血管となり門脈血流が下大静脈などの静脈系体循環に直接流入し,シャント血流量によって無症候例から高アンモニア血症や肝肺症候群,門脈肺高血圧症,肝性脳症などを合併する有症候例まで多岐にわたる9).先天性心疾患に関連したPSSとして,多脾症に合併した先天性PSS10)がよく知られているが,後天性PSSの報告例は少ない.Fontan術後に合併したPSS11)や肺動脈弁狭窄のあるNoonan症候群に認めたPSS12)といった報告が散見されるのみで,本症例と類似した肺静脈形態をもつ混合型TAPVCの報告5, 8)でもPSSに関する記述はなかった.私たちが調べた限り,本症例のような混合型TAPVC修復術後の遺残垂直静脈による症候性PSSの報告は初めてである.
本症例では,術後4日目に急激な肝逸脱酵素上昇を認めた際に一度腹部エコーを施行したが,当初は肝胆道系の炎症や結石症,あるいは薬剤性を念頭においていたためPSSの診断に至らなかった.その後の症状遷延や悪化によって腹部エコーを再検してPSSの診断に至ったが,診断確定までに時間を要した.幸いにも対症療法を行っている間に症状の改善が得られたが,経過中に何らかの要因で門脈圧と心房圧のバランスが変化し,門脈から心房内へ流入する血流量が減少した結果であろうと推察する.また術前に静脈管開存が確認されていることから,静脈管と遺残垂直静脈の両方がシャント血管として働いて症候性PSSを認めていたが,静脈管の自然閉鎖によってシャント血流量が減少して無症候化した可能性も考えられる.いずれにしても門脈圧が心房圧より高い状態が続き,遺残垂直静脈を介するシャント血流量が減少せずに更なる症状の悪化を認める場合には,その対応策を検討しておく必要がある.
混合型TAPVCの外科的修復は,基本的にはI~III型TAPVCの術式に準じて,肺静脈還流形態に応じたアプローチを行い,それぞれの共通肺静脈を狭窄や捻れのないように心房に還流させる.TAPVC修復時の垂直静脈の処理に関しては,術後肺静脈閉塞のリスクを考慮して処理せずに放置されることがあるが,未だ一定の見解があるわけではなく,議論の余地を残すところである.また,症候性PSSでは何らかの治療介入が必要であると考えられており,その治療法として,シャント血管結紮または切離や,コイル塞栓によるシャント血流遮断が外科的介入となりうるが9, 13),TAPVC修復術後の遺残垂直静脈によるPSSに対する適応と治療効果は明らかではない.
無脾症候群の機能的単心室においてTAPVCは予後不良の因子であり,特に下心臓型や混合型では術後肺静脈狭窄の発症頻度が高く14),術前PVSを伴う場合には垂直静脈の放置を推奨する報告もある15).本症例では,右垂直静脈は術前から進行性の狭窄を認めていたため放置し,左垂直静脈は自然閉鎖を期待して放置した.一般的に二心室血行動態でのTAPVC修復術後は,左房圧が高く,垂直静脈を介する経路は自然閉塞する傾向にあるため,遺残垂直静脈は問題にならない.しかし,機能的な単心室血行動態をもつ本症例では,左PVSがなかったことに加えて,門脈圧が心房圧より高くなるためにPSSを生じたと考えられる.本症例では将来Fontan循環へ向かううえでの血行動態への影響(肺高血圧や低酸素血症)も考慮したうえで,遺残垂直静脈を閉鎖する方針としたが,結果的には,結紮時に門脈低形成による門脈うっ滞所見を認め,遺残垂直静脈の絞扼術に変更となった.本症例の場合は,TAPVC修復術前に明らかな門脈低形成は指摘されておらず,PSSにより門脈血流が減少した結果として門脈低形成が生じたものと考えているが,TAPVC修復術の術前には門脈低形成など門脈うっ滞が懸念される病態の有無も確認しておくべきであると考える.さらに,自然閉鎖しにくい遺残垂直静脈の予測因子や,遺残垂直静脈によるPSS合併の危険因子なども含めて,今後症例を蓄積しながら議論していく必要がある.
著者役割
宍戸亜由美:症例の治療に関与し,データ収集・解釈,論文執筆に関与した.
長谷川智巳:症例の診断・治療に関与し,論文の構想,データ収集・解釈,論文の執筆指導に関与した.
亀井直哉:症例の診断・治療に関与し,データ収集・解釈に関与した.
林 賢,松久弘典,大嶋義博,田中敏克:症例の診断・治療に関与し,論文の知的内容にかかわる批判的校閲に貢献した.