症例
26歳,女性
現病歴
8か月時に修正大血管転位症(S, L, L),心室中隔欠損症,肺動脈閉鎖,主要肺動脈大動脈側副血行,動脈管開存症と診断された.3歳時に,セントラルシャント手術,動脈管離断術を施行された.10歳時に,主要肺動脈大動脈側副血行にコイル塞栓術を施行された後,機能的修復手術(左室肺動脈導管:弁付き導管18 mm),肺動脈形成術,心房中隔閉鎖術,心室中隔開窓術を施行された.術後に高度房室ブロックを生じ,心外膜リードによるペースメーカー植え込み術(VVI)を施行された.その後20歳時に,左室肺動脈導管再置換術(CEP Magna 21 mm)を施行された.その際,心室中隔の開窓部は自然閉鎖していた.23歳時に,当院成人先天性心疾患外来へ紹介となった.25歳時に経静脈的に心房ペーシングリードを追加され,以前の心外膜心室ペーシングリードと組み合わせることで,ペースメーカーの設定をDDDへ変更された.当院紹介時は,大動脈弁閉鎖不全,三尖弁閉鎖不全はともに軽度であったが経時的に増悪をみとめた.弁逆流の進行とともに,心房頻拍や感冒等を契機に心不全増悪を繰り返すようになり,頻回の入院治療が必要となった.26歳時には,大動脈弁閉鎖不全は中等度から高度,三尖弁閉鎖不全は高度まで進行した.さらに,心臓超音波検査では左室ペーシングによる両室非同期の所見もみとめ,これも心不全の一因と考えられた.以上より,大動脈弁置換術,三尖弁置換術,心室再同期療法を行う方針となり,26歳3か月時に手術となった.
入院時現症
NYHA:III度,身長:144 cm,体重:50.9 kg,血圧:108/53 mmHg,脈拍:72 mmHg, SpO2:98%(room air),頸静脈怒張なし,胸骨右縁第2肋間を最強点とするLevine III度の収縮期駆出性雑音を聴取,両下腿浮腫なし.
検査所見
血液検査
白血球数:7.91×10^3/µL,赤血球数:5.12×10^6/µL,ヘモグロビン値:13.7 g/dL,血小板数:164×10^3/µL,総蛋白:7.2 g/dL,アルブミン:4.6 g/dL, AST:18 U/L, ALT:11 U/L,総ビリルビン:0.5 mg/dL,尿素窒素:13 mg/dL,クレアチニン:0.46 mg/dL,B型ナトリウム利尿ペプチド(BNP):293.4 pg/mL.
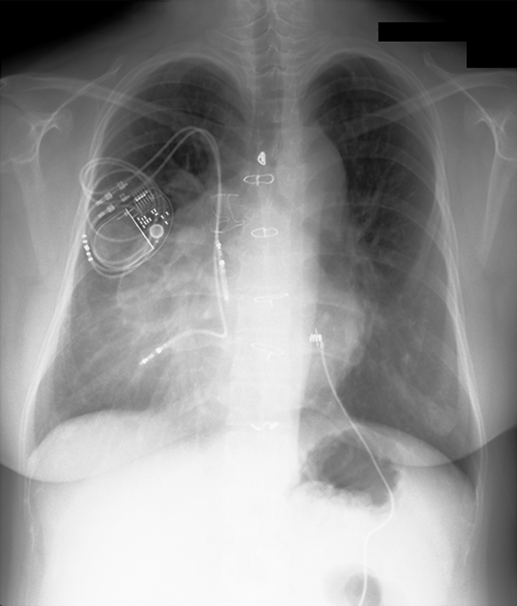
胸部X線写真(Fig. 1)
心胸郭比60%,肺血管陰影増強なし,左第3, 4弓突出あり.
十二誘導心電図検査
心拍数:77回/分,ペースメーカー調律:心房センシング,心室ペーシング(モード:DDD,下限ペーシングレート:60/分,上限ペーシングレート:130/分).
経胸壁心臓超音波検査
右室拡張末期径:69 mm,右室収縮末期径:51 mm,右室拡張末期容量:186 mL,右室収縮末期容量:124 mL,左房径:49 mm,右室駆出率: 33.3%,大動脈弁逆流:中等度から高度,三尖弁逆流:高度,肺動脈弁逆流:なし,左室–肺動脈導管部の最大流速:0.954 m/s,最大圧較差:4.0 mmHg,左室ペーシングのため両室非同期の所見あり.
心臓カテーテル検査
下大静脈圧:5 mmHg,左心室圧:46/0(3)mmHg,肺動脈圧:36/8(19)mmHg,右心室圧:95/3(14)mmHg,右室拡張末期圧:14 mmHg,大動脈圧:108/43(67)mmHg,心係数:2.51 L/min/m2,肺血管抵抗:1.4 Wood unit-m2,冠動脈に有意狭窄なし,右室造影:Sellers II度の三尖弁逆流,大動脈造影:Sellers II度の大動脈弁逆流.
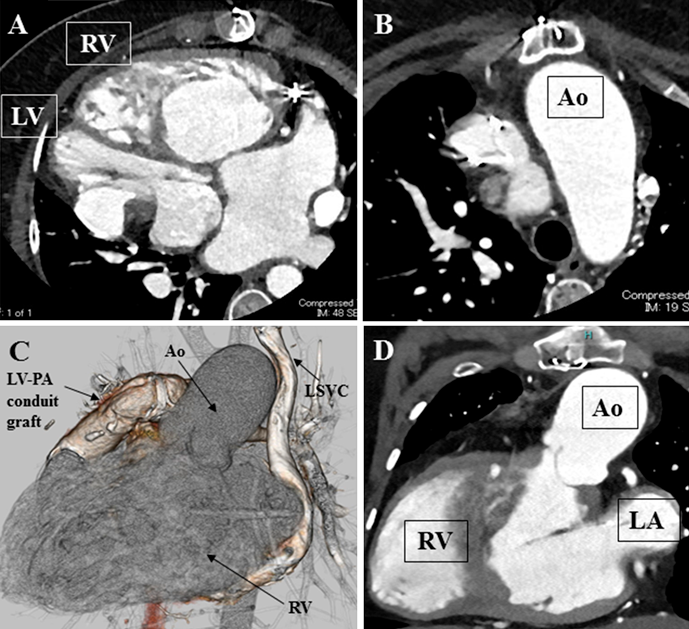
造影CT検査(Fig. 2)
大動脈が胸骨に近接している.左上大静脈遺残をみとめ,右心房に流入している.上行大動脈拡大あり(最大径:40 mm).ペースメーカーリードは,右鎖骨下静脈より上大静脈を経由して右心耳,左心室心尖部にそれぞれ留置されている.
心臓同期CTによる計測
左室拡張末期容量:110.6 mL,左室収縮末期容量:51.6 mL,左室一回心拍出量:58.9 mL,左室駆出率:53.3%,右室拡張末期容量:334.1 mL,右室収縮末期容量:227.9 mL,右室一回心拍出量:106.1 mL,右室駆出率:31.8%.
手術
術式:大動脈弁置換術(SJM弁® 23 mm,セント・ジュード・メディカル社),三尖弁置換術(ATSバイリーフレット人工弁® 25 mm,メドトロニック社),心室再同期療法(右室心外膜リード挿入).人工心肺時間:405分,大動脈遮断時間:219分.
手術所見
右鼠径部切開を行い,大腿動静脈を確保した.再胸骨正中切開.癒着は高度であった.上行大動脈送血,左右上大静脈下大静脈脱血で人工心肺を確立した.右上大静脈は解剖学的に露出が困難であったため,経皮的に右内頸静脈より右上大静脈への脱血管の挿入を行った.左房より右室ベントチューブを挿入した.大動脈遮断と同時に上行大動脈を切開し,選択的冠動脈灌流を行うことにより心停止を得た.大動脈弁を切開しeverting mattress sutureにて,大動脈弁置換術(SJM弁® 23 mm,セント・ジュード・メディカル社)を施行する方針とした.人工弁への運針までで一旦中断し,結紮は三尖弁置換術後に行った.左側左房を切開し三尖弁へアプローチした.中隔尖の一部を残し,前尖,後尖を切除した.everting mattress sutureにて,三尖弁置換術(ATSバイリーフレット人工弁® 25 mm,メドトロニック社)を施行した.その後,大動脈弁置換術を完成させ,大動脈閉鎖後に大動脈遮断を解除した.右心室に心外膜リード(Myopore Bipolar®, Greatbatch medical)を追加した.再手術症例であったため癒着が高度であり,リードの位置を決定するのは容易ではなかった.経食道心臓超音波検査で心臓の動きを見ながら術野で赤黒電極コードを用いて検索した.さらに,閾値が低い部位を特定し,screw inで右室の外側よりの心外膜へ直接固定した.右鎖骨下のペースメーカーポケットを開放し,ペースメーカーを摘出した.心外膜リードは鎖骨切痕から右鎖骨下のポケットに誘導し,このリードと,以前に静脈経由で留置していた右房リード,左室リードを新規のジェネレーターに接続してポケット内へ収納した.人工心肺離脱時には心房頻拍,心機能不全がみとめられたが,ドパミン5 µg/kg/min,ドブタミン3 µg/kg/min,ノルアドレナリン0.1 µg/kg/min,ランジオロール8 µg/kg/minまで増量し,大動脈バルーンパンピング(IABP)下に人工心肺は離脱可能であった.止血を行い型どおり閉胸し手術を終了した.
術後経過
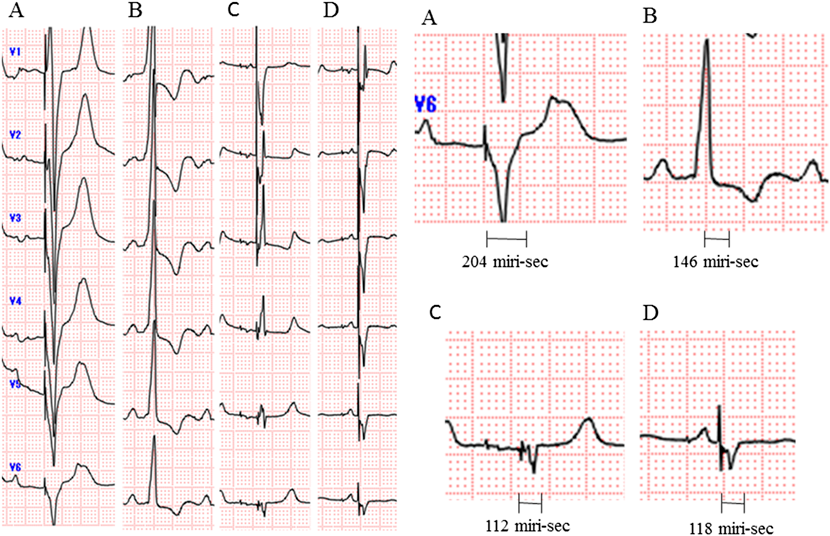
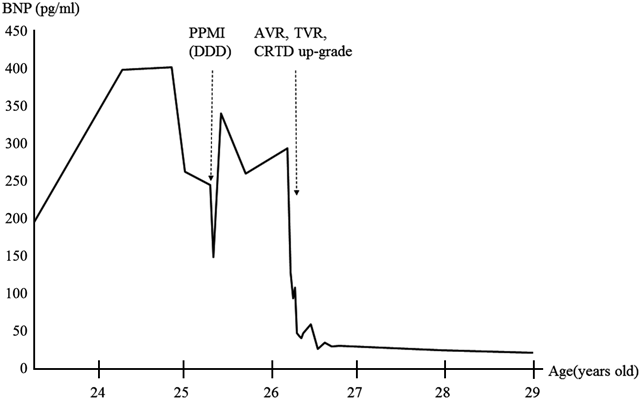
術後2日目にIABPを離脱し,術後3日目に抜管した.術後4日目にICUを退室した.術後7日目の心臓超音波検査では,右室駆出率は17%であった.ドパミン1 µg/kg/minの投与を継続したまま,術後18日目に循環器内科へ転科した.転科後にドパミンの投与を中止したところ,嘔気や食欲不振等の心不全症状が出現した.ドブタミンを開始し,内服薬を調整の後,漸減中止した.術後45日目の心臓超音波検査では,右室駆出率は33%まで改善をみとめた.心電図ではQRS時間が112 msまで短縮した(Fig. 3).血清BNP値は術前と比較して,293.4 pg/mLから26.5 pg/mLまで著明に低下した(Fig. 4).術後2か月目の心臓カテーテル検査では,肺動脈楔入圧は11 mmHg,心係数は3.2 L/min/m2と改善をみとめた.術後60日目に自宅退院となった.術後2年目の心臓超音波検査では,術前と比較して,右室拡張末期径は69 mmから50 mmへ,右室拡張末期容量は186 mLから117 mLへ,右室収縮末期容量は124 mLから59 mLへと著明に改善をみとめており,両室の同期所見の改善も保たれていた.血清BNP値も再上昇なく経過しており,術後2年9か月現在,22.0 pg/mLである(Fig. 4).現在の心不全症状はNYHA I度で経過良好である.
修正大血管転位症は,循環は生理的に修正されるが,多くの場合心室中隔欠損症などの心内病変を伴い,外科的治療が必要となることが多い.しかしながら,機能的修復術後は解剖学的右室を体心室として使用するため,遠隔期における解剖学的右心不全,三尖弁閉鎖不症,不整脈の問題が多く見られる.
機能的修復術後の三尖弁閉鎖不全は,右心不全とともに遠隔期の問題点となる.しかしながら,三尖弁閉鎖不全が原因で右心不全となるのか,右心不全から三尖弁閉鎖不全が増強するのかは判断が難しいところである.Kohらは,左室肺動脈導管を用いた機能的修復術後の患者において,ある程度の左室肺動脈導管の圧較差を保つ方が左室圧を維持することで三尖弁閉鎖不全のリスクを下げると述べている1).本症例においても,20歳時に左室肺動脈導管再置換術を施行した後に三尖弁閉鎖不全が進行したため,導管狭窄の解除が左室圧低下を招き三尖弁閉鎖不全や両心室の非同期を増悪させた可能性は十分に考えられる.一方で,その進行は緩徐であったため,左室肺動脈導管再置換術のみが原因ではなかったとも考えている.Scherptongらは,右心室を体心室とするccTGAなどに合併した三尖弁閉鎖不全に対して,三尖弁置換術,あるいは形成術を施行することで,心不全はNYHA 2.7度から2.1度へと,有意に改善したと報告している2).しかしながら,三尖弁形成術後の逆流再発率は37%と比較的高く,弁置換術と比較して有意差はないものの術後生存率は劣る傾向が見られた.本症例でも心不全の進行を抑えるためにも三尖弁置換術を施行した.一方で,Mongeonらは,機能的修復術後に対する三尖弁置換術後の10年生存率は,術前の体心室の駆出率が40%以上の群で82%, 40%未満の群で40%であったと報告している3).本症例は大動脈弁閉鎖不全および三尖弁閉鎖不全があったにもかかわらず,術前の右室駆出率が33%と著明に低下しており,この点は術前の危険因子であった.そのため,今回もしくは将来的に植込み型人工心臓や心臓移植の可能性もあり,術前に患者および家族と,今回の手術の危険性および今後の補助循環や心臓移植の可能性を話し合った.人工心肺離脱時には,大量カテコラミンとIABPを必要とした.しかしながら,術後2日目にIABPを抜去,術後4日目にはICUを退室できた.術後3週間程度は少量のカテコラミンを必要としたが,最終的に心不全の改善を得ることができ,血清BNP値は著明な低下をみとめた(Fig. 4).本症例では,二弁置換術を行うことにより弁逆流を制御したことに加えて,心室再同期療法が有効であったと考えられた.術前後の心電図を比較すると,VVIペーシングからDDDペーシング,そして右室心外膜リードを追加し心室再同期療法を導入することにより,経時的にQRS時間は著明に短縮した(Fig. 3).心室再同期療法による急性期,短期的な解剖学的右室機能の改善に関しては複数の報告がなされている4, 5).その機序は両室同期により収縮効率を上げることにあるが,心筋酸素需要を低下させることで虚血予防にも寄与するとされ,解剖学的右室機能の長期的な予後改善も期待されている4).特に,本疾患のようにペースメーカー植え込み術後の場合,左室ペーシングによる右室非同期が右室機能不全をさらに進行させるとも報告されており,心室同期療法の効果は大きいと考えられる.
遠隔期において三尖弁閉鎖不全,左室肺動脈導管狭窄もしくは閉鎖不全とともに大動脈弁閉鎖不全も問題になると考えられる.修正大血管転位症における大動脈弁閉鎖不全の報告は少ないが,Grahamらの報告では25~36%の患者で,原因不明であるが大動脈弁閉鎖不全がみとめられた6).自験例34例においても軽度以上の大動脈弁閉鎖不全を50%にみとめ,4例では大動脈弁置換術を必要としていた7).
右心不全に関してPrietroらは,機能的修復術後の20年生存率は,三尖弁閉鎖不全がある群で34%,ない群で90%であったと報告している8).成人期に到達した修正大血管転移症に対する機能的修復術後症例に関しては報告が少ないものの,今後さらに遠隔期において右心不全が進行し,心補助装置や心臓移植が必要となる症例が増加してくると考えられる.遠隔期での補助人工心臓,心臓移植を見据えた治療が必要になるが,薬物治療も含め,少しでも右心不全の進行を遅くすることが重要であると考えており,現時点ではその時期において最善と考えられる外科治療法を選択している.補助人工心臓装着時には大動脈弁は機械弁から生体弁に再置換する必要もあるが,今回の手術が最終手術になる可能性もあり,できるだけ手術回数を減らすために二弁ともに機械弁を選択した.一方で,左室肺動脈導管については術前に弁機能不全が見られなかったため,手術侵襲を小さくするために,今回は予防的な再置換術は行わなかった.