症例
30歳,女性
診断
純型肺動脈閉鎖症,心房中隔欠損,右側大動脈弓,チアノーゼ腎症,慢性気管支炎,気管支拡張症,脊柱側弯症
手術歴
3か月時に左modified Blalock–Taussig(BT)シャント,9か月時に右original BTシャント,12歳時に右BTシャント狭窄に対しバルーン拡張術,17歳時に大動脈弁輪拡張と大動脈弁逆流の増悪に対しBentall手術(ATS 27 mm+Hemashield 30 mm)が施行された.
主訴
倦怠感,咳嗽,顔面浮腫の増悪
家族歴
特記すべき事項なし
既往歴
9歳時に学校検尿で蛋白尿を指摘された.以降,蛋白尿が持続し15歳時の採血でBUN 17 mg/dL, SCr 0.3 mg/dL,実測クレアチニンクリアランス(creatinine clearance: CCr)66.9 mL/minと軽度の腎機能障害を認めたため,腎生検が施行された.病理組織像では大部分の糸球体で腫大傾向と分節性増殖病変を認め,CNと診断された.dilazep dihydrochloride hydrateとlisinopril hydrateの投与が開始され,蛋白尿の改善を認めた.その他,慢性心不全や心房性不整脈に対してdigoxin, pimobendan, tolvaptan, carvedilol, furosemide, spironolactone, procainamide,血栓予防にaspirin, warfarin potassiumを処方されていた.これまで慢性心不全の急性増悪で複数回の入院歴があり,New York Heart Association心機能分類class 3で日常生活を送っていた.20歳時に造影CT検査を2回施行され,それぞれiopamidolを50 mL(2.3 mL/kg),iohexolを50 mL使用したが,いずれも副作用や検査後の腎機能障害は認めなかった.喫煙歴なし.
現病歴
入院数日前から発熱があり,徐々に咳嗽,動悸,食欲不振,乏尿なども出現したため当科外来を受診した.体重22.9 kg(入院前は23 kg前後)と目立った増減はなく,心エコー検査で心機能は前回までと比べて低下していなかったが,血液検査(Table 1)でBUN 36 mg/dL, SCr 0.90 mg/dL, BNP 66.1 pg/mL(前回までは200~300 pg/mL)と脱水所見を認めた.CRP 8.51 mg/dLと高値であり,呼吸器感染症を疑われ入院した.
Table 1 Laboratory data| Blood test | On admission | Before catheterization | Before CHDF | At discharge |
|---|
| WBC | /µL | 4,010 | 3,480 | 6,740 | 3,370 |
| Hb | g/dL | 12.6 | 13.9 | 14.6 | 15.7 |
| Ht | % | 46.8 | 47.4 | 51.8 | 56.6 |
| Plat | ×104/µL | 15.8 | 11.2 | 7.2 | 11 |
| PT-INR | | 1.39 | 1.53 | 2.18 | 2.74 |
| APTT ratio | | 1.27 | 1.32 | 1.52 | 1.68 |
| TP | g/dL | 7.1 | 6.5 | 6.7 | 6.6 |
| Alb | g/dL | 3.7 | 3.7 | 3.8 | 4.5 |
| BUN | mg/dL | 36 | 40 | 49 | 30 |
| Crea | mg/dL | 0.9 | 0.79 | 3.86 | 0.68 |
| eGFR | mL/min/1.73 m2 | 60.6 | 69.9 | 12.3 | 82.4 |
| UA | mg/dL | 7.4 | 7.3 | 8.3 | 7.6 |
| Na | mmol/L | 135 | 141 | 134 | 139 |
| K | mmol/L | 5.5 | 3.6 | 4.5 | 4 |
| Cl | mmol/L | 103 | 103 | 94 | 102 |
| Ca | mg/dL | 9.3 | 8.7 | 8.4 | 9.2 |
| Urinalysis | | | | |
| A/C | mg/gCr | 150 | ND | ≧300 | 150 |
| Occult blood | (−) | ND | (3+) | (±) |
| ND, no data; A/C, albumin/creatinine |
入院後の経過
sulbactam/ampicillin(SBT/ABPC)の投与と補液(100 mL/kg/day)を開始した.入院翌日には解熱し利尿も良好となり,入院3日目に維持輸液(60 mL/kg/day)に変更し,入院6日目にSBT/ABPCを中止した.しかし入院7日目に顔面の浮腫や尿量減少が出現し,体重24.1 kgと増加を認めた.心エコー検査で著変なく,furosemideの静脈内投与を行い尿量は軽度増加したものの,体重は24 kg前後と変化を認めなかった.入院12日目にBUN 29 mg/dL, SCr 0.66 mg/dLと脱水所見は改善したものの,BNP 376.2 pg/mLと上昇し,倦怠感や腹部膨満,下痢の出現もあり,右心不全の増悪と判断して内服薬のfurosemideとspironolactoneを30 mg/dayから40 mg/dayに増量した.その後,体重23.1 kgまで減少したが下痢は改善せず,BUN 35 mg/dL, SCr 0.81 mg/dLと脱水所見と腎機能の増悪を認め,利尿薬の増量と心不全の増悪による,腎血流減少・腸管浮腫の状態と考えられた.SpO2 80%程度に対してHb 12.5 g/dLと相対的貧血と判断し,入院18日目に赤血球輸血2単位を施行した.その後も倦怠感や下痢は改善せず,入院20日目にmilrinone 0.3 µg/kg/minの投与を開始した.入院22日目からfurosemide 1 mg/kgの静脈内投与に反応した尿量の増加と,倦怠感や下痢の改善を認めた.同日milrinoneを0.15 µg/kg/minに漸減し,入院23日目に中止した.
現在の血行動態を評価し治療方針を検討する目的で,入院24日目に心臓カテーテル検査を施行した.検査開始4時間前から絶食とし,3号液40 mL/hで補液を行った.造影剤はiohexolを使用し,投与部位と投与量はそれぞれ,左室20 mL,上大静脈10 mL,上行大動脈20 mL,右BTシャント15 mL,大動脈弓15 mLの計80 mL(3.4 mL/kg)を使用した.カテーテル検査中・検査後ともに血圧低下や不整脈を認めず全身状態は安定していた.検査後帰室時から飲水を再開し,食事量は検査前と同程度だったため,補液を3号液5 mL/hに減量した.
検査翌日から乏尿となり,検査後30時間でSCr 1.62 mg/dLと上昇を認め,CINと診断した.利尿薬やmilrinoneの投与に反応せず,検査48時間後にはSCr 3.86 mg/dLとさらに上昇し(Table 1),pH 7.198, HCO3 −11.9 mmol/L, BE −14.8 mEq/Lと高度の代謝性アシドーシスを認め,全身の浮腫や胸腹水貯留も出現したため,カテーテル検査3日後に持続血液濾過透析(continuous hemodiafiltration: CHDF)を導入した.
カテーテル検査前日の身体所見
身長130.5 cm,体重23.3 kg,体表面積0.94 m2,BMI 13.7,肥満度 −37.7%,基本的日常生活動作はほぼ自立しているものの,階段昇降は不能で自宅内トイレまでの歩行でも息切れを認めた.心拍数90/分・整,左上肢血圧89/54 mmHg, SpO2 80%(室内気),体温36.0°C,顔面蒼白,顔面と下腿の浮腫著明,胸骨右縁第1肋間にLevine 4度の連続性雑音,胸骨右縁第2肋間に最強点のあるクリック音を聴取,腹部膨満あり.
カテーテル検査前の検査所見
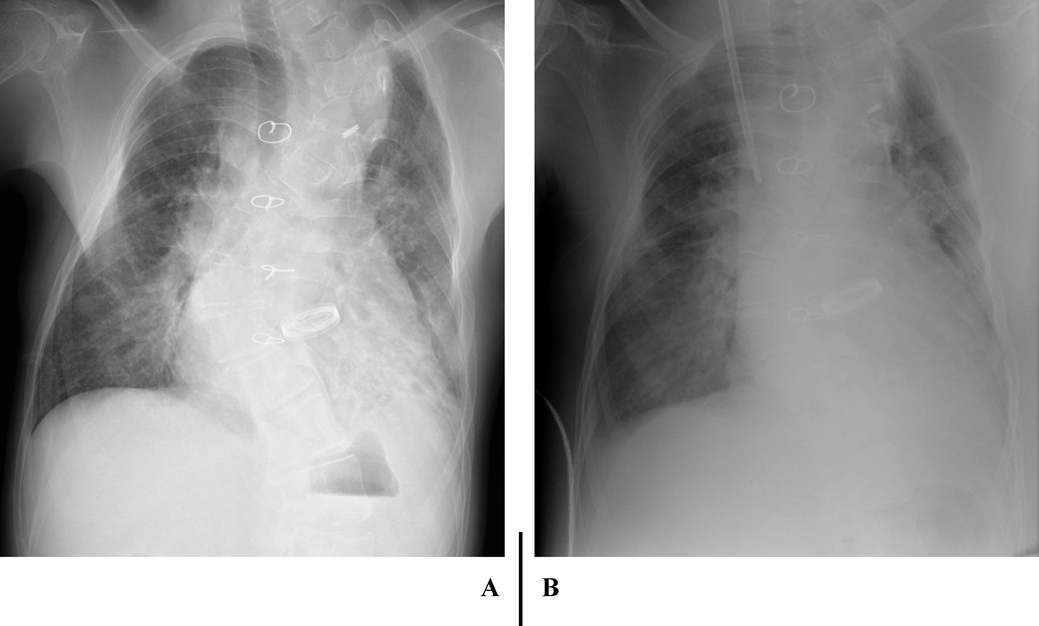
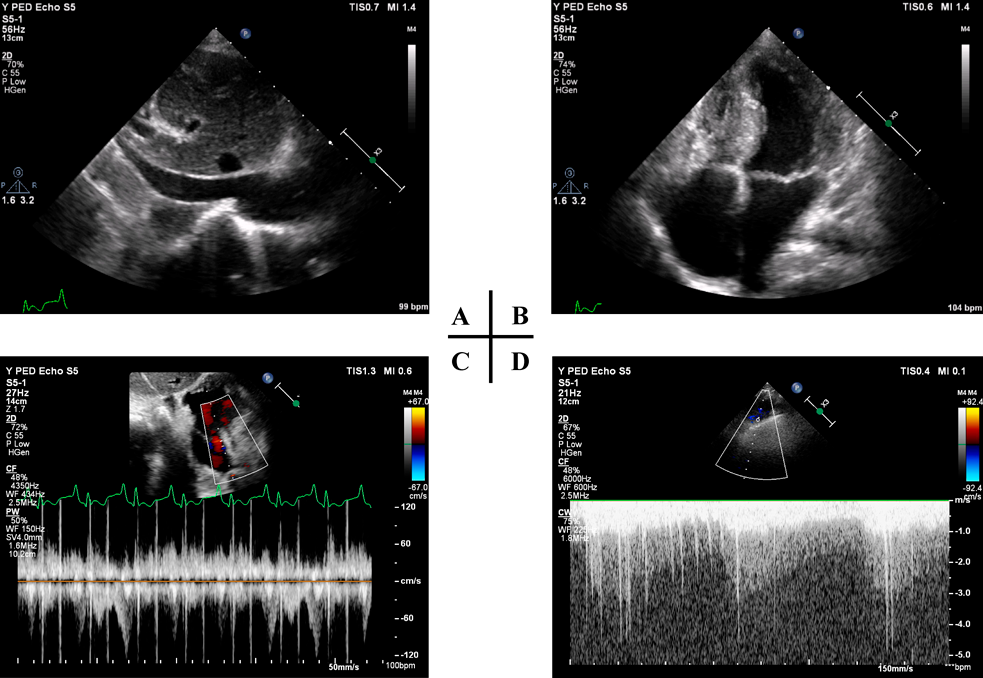
心臓カテーテル検査前日の血液検査(Table 1)で,BUN 40 mg/dL, SCr 0.79 mg/dL, SCrから推定した糸球体濾過量(eGFRcreat) 69.9 mL/min/1.73 m2と,軽度の腎機能低下を認めた.随時尿で150 mg/gCrの微量アルブミン尿を認め,潜血は陰性だった.同日の胸部X線(Fig. 1A)では,心胸郭比63.3%と定期外来受診時と同程度の心拡大および肺うっ血所見であった.入院22日目の心エコー検査では,下大静脈径14.9 mmと拡大し,呼吸性変動は乏しかった(Fig. 2A).両心房の拡大を認め(Fig. 2B),心房間交通は8.9 mmと狭小で右左短絡であった(Fig. 2C).右BTシャント血流は明瞭に描出できたが(Fig. 2D),左BTシャント血流は描出できなかった.
カテーテル検査所見
体血流量2.7 L/min/m2と保たれており,肺体血流量比1.6と肺血流増多を認めた.肺動脈平均圧40 mmHgと高値であったが,肺血管抵抗2.8 units·m2と上昇しておらず,高肺血流性肺高血圧と考えられた.左室拡張末期圧16 mmHg,右房平均圧13 mmHg,左房平均圧13 mmHgと上昇しており,左室拡張障害の影響が疑われた.造影では,左室駆出率55%と収縮能は保たれていた.
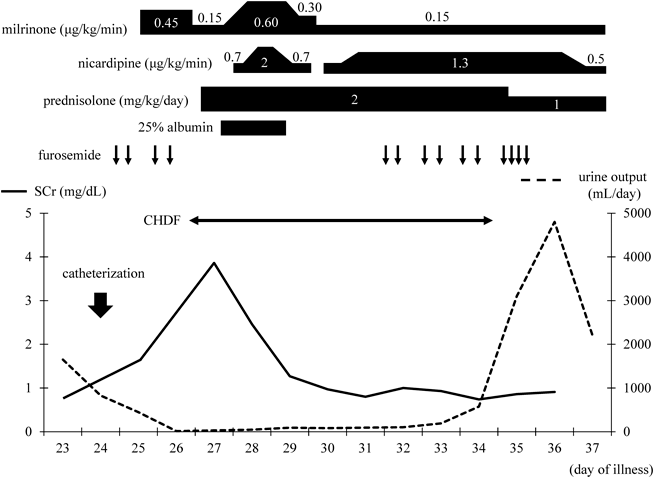
CHDF導入からの経過(Fig. 3)
CHDF導入時の胸部X線(Fig. 1B)では,心胸郭比67.7%と心拡大および肺うっ血の増強と両側胸水を認めた.CHDF開始直後に血圧低下,嘔気が出現したため,CHDFを一時中断した.しかし,その後も症状の改善がないためいったん回路を離脱した.CHDF離脱後の心エコーでは,下大静脈の虚脱と左心室の過収縮を認め,脱血による血管内容量の不足を疑い,補液の増量とmilrinoneの減量を行った.プライミングを生理食塩液から赤血球液に変更し,抗凝固薬をnafamostat mesilateからheparin sodiumに変更した上でCHDFを再導入したところ,症状の再燃を認めなかったため除水を開始した.その後も血圧は安定していたため,補液を減量しmilrinoneを再増量した.徐々に呼吸困難が出現し,両側肺野で湿性ラ音を聴取したため,肺うっ血の増強を疑い除水速度を上げて対応した.また,血管透過性の亢進や低アルブミン血症の影響を考慮し,prednisolone 2 mg/kg/dayと25% albuminの投与を行った.CHDF導入2日目には顔面の浮腫や呼吸困難は改善し,血液ガスでpH 7.334, HCO3 −19.4 mmol/L, BE −5.8 mEq/Lと代謝性アシドーシスの改善を認めた.脱水傾向で除水速度を下げたが,その後徐々に血圧が上昇し,収縮期血圧200 mmHgと高血圧を認めた.除水速度を上げmilrinoneを増量したが改善しないため,nicardipine hydrochlorideの投与を開始したところ,血圧は正常域に改善した.CHDF導入4日目にはSCr 0.97 mg/dLまで低下したものの,尿量は増加傾向なく胸水の再貯留を認めたため,輸液を減量し,除水速度を上げて対応した.CHDF導入6日目から利尿薬の投与に反応を認めるようになったため,導入7日目にCHDFを一時中止した.その後もSCrの上昇や代謝性アシドーシスの再燃なく,自尿で3,100 mL/dayと十分量保たれていたため,導入8日目にCHDFを離脱した.離脱後も腎機能の増悪や乏尿の再燃はなく,CHDFの再導入を必要としなかった.退院時の腎機能および尿所見は入院前と同程度に改善していた(Table 1).
CINの正確な発症機序は現在でも不明であるが,①造影剤の投与により腎血管の収縮から腎血流量が低下し,腎虚血や低酸素が起こり,②造影剤による尿細管への直接的な障害や,③一酸化窒素低下・エンドセリン増加などの血管作動性物質の変動も認められ,これらの複合的な要因でCINを発症すると考えられている5).一方,CINの腎機能障害は可逆的であり,典型的にはSCrはCIN発症から3~5日後にピークに達し,7~14日後に前値に戻り寛解する症例が多く,透析を要する例は1%未満とまれである3).しかし,透析を要する重症CINの発症は高い死亡率や入院期間の長期化と関連しており,その発症予測は重要である.CINには,脱水,重症心不全,造影剤投与前の腎機能障害や利尿薬投与,貧血,造影剤の投与量など多くのリスクファクターがあり,これらが各々相加的に作用することが知られている4).
本症例では,これまで浮腫の増悪による入院が多く,外来管理中からBUN 25~35 mg/dLと高めで経過し,心臓カテーテル検査時点で著しい脱水傾向はないと判断した.急性増悪を繰り返す難治性心不全に対して,カテーテル検査前日までループ利尿薬やmilrinoneの投与を必要としていた.カテーテル検査前日のHb 13.9 g/dLはチアノーゼのない患者では正常値であるが,CCHD患者における至適ヘモグロビン濃度を示した報告6)から,実際は22.0 g/dL程度が必要と算出され,相対的に貧血状態と判断した.
本症例は上記に加えてCNを合併していた.CNでは蛋白尿や血尿を呈し,腎機能障害へ進行する例もあるが,本症例では蛋白尿は改善しており,eGFRcreatで評価した腎機能はCINのリスクとされる腎機能障害(eGFR<60 mL/min/1.73 m2)には該当しなかった.しかし,eGFRcreatは同じ年齢・性別内の平均的な体格を前提にして計算されているため,極端な体格では信頼性が低い.CCHD患者では,幼少期から持続するチアノーゼや心不全により運動耐容能が低く,同年代と比較して小柄で筋肉量が少ない傾向がある7).そのため,eGFRcreatで算出した腎機能は過大評価となる可能性が高く,腎機能障害の合併を認識しづらく,CINのリスク評価に際して誤った解釈をしてしまう危険性があり注意が必要である.シスタチンC(cystatin C: cysC)は,年齢・性別・筋肉量の影響は少なく,cysCによるeGFR(eGFRcys)とeGFRcreatを平均化したeGFRはより正確性が高いため,CCHD患者の腎機能評価にSCrよりcysCを推奨する報告もある8).本症例でカテーテル検査から1年後にSCrとcysCを同時に測定したところ,SCr 0.80 mg/dL, eGFRcreat 68.3 mL/min/1.73 m2とカテーテル検査時とほぼ同程度の数値であったが,cysC 1.53 mg/L, eGFRcys 47.5 mL/min/1.73 m2とeGFRcreatと乖離しており,平均化したeGFRは57.9 mL/min/1.73 m2であり,カテーテル検査時の腎機能はCINのリスク群である可能性がある.
また,造影剤投与量の増加はCINの発症リスクを高めるため,使用量は必要最小限とすることが推奨されている.最大造影剤投与量の推定式として,一般的には5 mL/kg/SCr(mg/dL)が提唱されており9),これに基づくと本症例で使用した造影剤80 mL(2.7 mL/kg/SCr)は最大投与量の範囲内だった.しかし,SCrは筋肉量に影響されるため,本症例のように小柄で筋肉量の少ない成人CCHD患者では,最大造影剤投与量を過大評価する可能性があり,eGFRcysのように筋肉量の影響が少ないバイオマーカーを用いて算出する必要性が考えられる.
重症CINの発症リスクに関する報告は少ないが,経皮的冠動脈形成術後の重症CINについて検討した複数の報告10–12)では,重症CIN発症のリスクファクターとして,高齢,女性,糖尿病,カテーテル検査の緊急度,うっ血性心不全,造影検査前の腎機能障害,大動脈内バルーンパンピングの既往などを挙げており,腎機能障害の重症度が高く,循環動態が不安定な症例ほど透析導入率が高かった.また報告内ではリスクファクターをスコア化し,その合計スコアから重症CINの発症予測率を推算している.本症例でリスクスコアを計算したところ,Brownらの報告10)ではリスクスコア6点で,重症CIN(新規の透析導入や,SCrの2.0 mg/dLまたは50%以上の上昇)の発症予測率は1%未満だった.また,Tsaiらの報告11)では透析導入リスクスコア1点で透析開始リスクは0.05%,Mehranらの報告12)ではリスクスコア7点で透析リスクは0.12%といずれも低かった.これらリスク因子の算定結果から,代替検査(心臓MRI検査など)の選択や造影剤の投与量・投与部位の制限など,特段の配慮は不要と判断しルーティンでカテーテル検査を行った.しかし,結果として透析を要する重症CINを発症しており,これまで報告されてきたリスクファクター以外の原因が関与している可能性が考えられる.
前述の報告と本症例で大きく異なる点として,本症例がCCHD患者でありCNを合併していたことが挙げられる.成人CCHD患者は,長期間の慢性的な低酸素状態という病態下にあり,これが造影剤による腎組織の低酸素を修飾し,さらにCNによる糸球体肥大や尿細管障害も加わることで,CINの重症度がより高くなった可能性が考えられる.CCHD患者では,血栓塞栓症や出血のリスクなどから腎生検が行われる機会は少ないが,16歳以上の60%に蛋白尿あるいは血尿が認められたとの報告もあり13),未診断のCN症例も相当数存在すると推測される.CCHD患者に対する造影剤の使用は,CNの合併も念頭におき,適応を慎重に検討する必要がある.
eGFR 60 mL/min/1.73 m2未満の腎機能障害では,動脈造影検査の前後での生理食塩液輸液が推奨されている2).本症例では,前述のようにeGFRcreatで算出した以上に腎機能が低下していた可能性があり,検査前後の輸液によりCINの発症を予防できた可能性がある.しかし,CCHD患者では利尿薬の投与を要する心不全を合併していることが多く,長時間の輸液負荷による心不全の増悪が懸念されるため,輸液量の調整が必要である.カテーテル検査時のループ利尿薬の使用はCINの独立したリスクファクターであるが,尿量と等量の輸液を行う特殊な装置を用いて,尿量を300 mL/時以上確保するように生理食塩液による輸液と経静脈的なfurosemide投与の併用療法(Renal Guard療法)を行うことで,体液過多や体液減少を起こさずにCINの発症を有意に抑えられることが報告されており14).CCHD患者における有用なCINの予防法となり得る.
著者の貢献度
鈴木康太は筆頭著者として論文作成を行った.
小田切徹州は論文内容に関する直接的な指導を行った.
藤井隆は論文の重要な知的内容に関わる批判的校閲に関与した.
高橋辰徳は論文の重要な知的内容に関わる批判的校閲に関与した.
安孫子雅之は論文の重要な知的内容に関わる批判的校閲に関与した.
三井哲夫は論文の重要な知的内容に関わる批判的校閲に関与した.