我々の先輩は症例が少ないなかで,工夫をされ世界に発信する画期的な手術法を数多く編み出してこられた.今野手術,川島手術,安井手術,竹内法などは日本から発信したものである.
私は,メルボルン王立小児病院の心臓外科准教授から戻った2年後の1993年に,岡山大学の心臓血管外科学講座の教授になった.私が岡山大学で新しいプログラムを始める前は,岡山大学病院では年間5件未満の小児外科手術しか行っていなかった.現在,岡山大学では年間300〜400件の小児心臓手術を行っており,世界をリードする小児心臓手術病院の1つになっている. 1993年以来,私たちは8,000人以上の小児心臓手術を行っており,死亡率は約1%で,英語で300編以上の論文を発表している.これらの成果は,私のニュージーランドとオーストラリア留学時の恩師の影響が大きい.2人の恩師、ニュージーランドのGreen Lane Hospitalでホモグラフト移植手術と超低体温循環停止法を開発したSir Brian Barratte-Boyes,およびメルボルンのRoyal Children’s Hospitalでtrap door法(大血管転位症に対する動脈スイッチ手術),cc-TGA患者のダブルスイッチ手術,壁内冠状動脈のためのMee法などを開発したRoger Meeである.1998年に,左心低形成症候群(HLHS)の第1期手術として,我々は新しい外科的手法,いわゆる佐野シャント(RV-PAシャント)を開発し発表した.その他,1996年に重症型のエブスタイン症に対しRV/ RA exclusion法,2001年に純系肺動脈閉鎖症に対する段階的2心室修復術,および1996年の大動脈弓再建時の順行性脳灌流による脳保護が含まれる.また最近,心臓幹細胞療法の研究を開始した.2011年に左心低形成症候群や単心室症の小児を対象として第I相臨床試験を開始し,小児における心臓幹細胞治療法による世界初の臨床試験成功となった.現在,第Ⅱ相を終了し,2016年8月に第III相(多施設共同研究)を開始した.
「学術的で革新的な外科医であれ」,私の恩師に常に言われていたことを次世代と共有したい.
留学中の恩師Sir Brian Barratt-Boyesから教えられたことは良き心臓外科医であると同時にacademic surgeon, innovative surgeonであることであった.Sir Brianは超低体温停止法を世界に広め,またHomograftを世界で最初に大動脈弁置換に使った人の一人である.私が留学した当時もホモグラフトの保存法の改良,新しい生体弁の開発などで精力的に臨床研究をされていた.もう一人の恩師Roger Meeは,①failing RVに対するLV training,②Double switch operation,③大血管転位症に対するTrapdoor法,④PAVSDMAPCAsに対するunifocalization,⑤Mee shunt,⑥壁在性冠動脈走行に対するMee法など多くの新しい手術法を開発された.ちょうどその頃,Mee先生の下で働く機会を得て,一緒に新しい手術を考えるうちに,自分自身も自然と世界に発信する新しい治療法を考えるようになったと思う.
岡山大学に帰り,多くの症例が集まるようになり,失敗例から多くのことを学ばせてもらった.亡くなった子供達には申し訳ないが,どうしてこの子は亡くなったのか,どうしたら生きたのか,亡くなった原因を考えることが,亡くならない手術法を考えるヒントとなった.
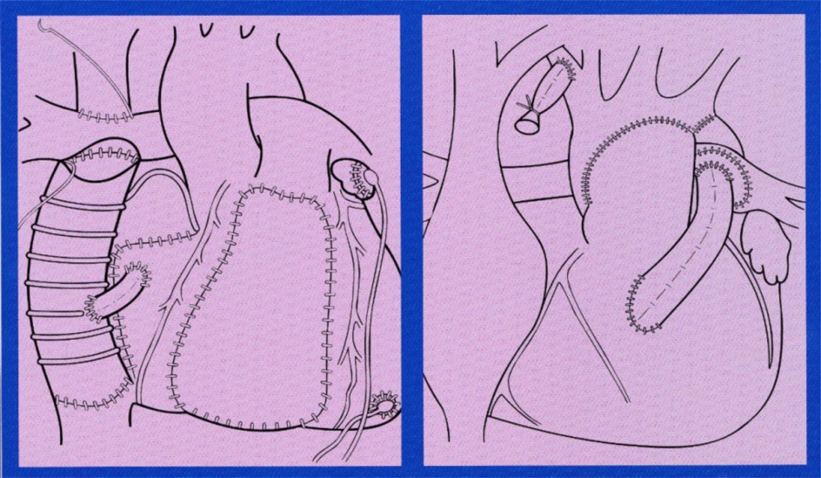
左心低形成症候群(HLHS)に対するRV-PAシャント(Sano procedure)(Fig. 1B)
メルボルン小児病院時代は手術の名手Mee先生やBrawn先生がNorwood手術をしてもことごとく死亡する時代であった.世界を代表する名手がどんなに早く的確に手術をしても亡くなるのである.拡張期血圧が30–25 mmHgになると危ないと感じたものであるが,血圧を上げようとカテコラミンを増やしても,拡張期圧は何故か下がる.岡山大学に帰って,同じ手術をし,人工心肺から離脱しても,夜中や翌日に突然心停止,それも直前まで申し分のないような血行動態なのである.岡山大学ではバランスを取る術後管理は無理だ,それならバランスを取らなくても救命できる手術法はないかと思案にくれていたとき,大阪府立母子センターの岸本英文先生が“Norwood手術でRV-PA シャントを使った手術をしたけど,拡張期血圧が高いから術後は楽やった”と言われたのを聞いた.その言葉がずっと気になっていて岸本先生の論文“The Modified Norwood Palliation on a Beating Heart. J Thorac Cardiovasc Surg 118: 1130–1132, 1999”を読んだが,どちらかというと,心停止をせずにNorwood手術ができ,うまくいったことに重点が置いてあった.私にはRV-PAシャントのほうが面白く,その後文献を探してみると,Norwood教授が1981年にHancock弁付き導管を用いた手術を5例にされていた(J Thorac Cardiovasc Surg 82: 511–519, 1981).しかし当時の弁付き導管は12 mmが一番小さく,また血流をコントロールするため肺動脈弁の末梢側を絞扼したのである.結果は全例死亡し,Norwood教授はこの手術を諦められた.当時榊原記念病院の龍野勝彦先生が右室流出路再建で,小さめの導管を用いれば,肺動脈弁機能はなくても良好な結果が得られるという報告をされていたのを思い出した.またGreen Lane病院にいるときに調べたホモグラフトによる右室流出路再建でも,少し小さめのホモグラフトを用いると軽度の狭窄と軽度の逆流を作り,心機能は落ちず,再手術を回避できるということを思い出した.そこで小さなPTFE graftを用いたRV-PAシャントを行えば,拡張期圧を高く保てるだけでなく,右室機能への悪影響も最低限に抑えられるのではないかと考えた.大動脈閉鎖から肺動脈閉鎖を作るのではなく,ファロー四徴症を作ればよいのだ.とすれば何ミリの人工血管を選ぶかである.肺動脈閉鎖の新生児ではBlalock–Taussigシャントには4 mmの人工血管をよく用いていたので,ワンサイズ大きめがよいかなと単純に思い,1998年2月に5 mmのPTFE graftを用いたRV-PAシャント手術を行った.通常のNorwood手術をしても助からないので,理論的に正しいと思われるこの手術に賭けたわけである.
その後,大動物を使った実験で,冠動脈血流と拡張期圧の有意な増加を認め,この手術の特徴と優位性を確認した.HLHSの少ない施設でも比較的簡単に術後管理ができ,また右室切開を工夫することにより,心機能を落とすことなく維持できる.また心配した不整脈も今のところ杞憂であることもRV-PAシャントを続け成績を向上すべく工夫している次第である.また2001年のトロントでの世界小児心臓病学会発表後,それを聞いていたNorwood教授が同じ手術をすぐに行ったということもうれしいニュースであった1).この新しい術式はHLHSの子供たちが最終手術であるFontan手術に無事到達し,生存することを確認した後の2003年に論文として報告した1).
RV/RA Exclusion(Fig. 1A)
1996年27歳の男性が多発する不整脈と右心不全で広島より岡山大学に緊急搬送された.いかなる薬物も冷凍凝固も有効ではなく,不整脈源性右室異形成(Arrhythmogenic right ventricular dysplasia: ARVD)と診断され,最終的にはECMOまで装着された.夜のカンファレンスで循環器内科より,内科的治療の限界なので外科的な処置をしてほしいと依頼があった.元々ARVDという病気さえ知らなかったので,10編ほどの論文を読んだが,重症例ではどのような手術をしても成績は悪く,治療法は心臓移植しか考えられなかった.不整脈の発生源が特定でき,この部分を切除しても右心不全で亡くなってしまう.右心不全の治療を優先すれば不整脈で亡くなってしまう.右心不全と不整脈両方の問題を解決しなければ,患者さんを救命できないのである.“左心機能は良いの?”と内科に尋ねると,“この病気は右心室に限定した心筋症のようなものですから左心機能は良いです”との答えであった.論文によると不整脈はほとんど右心室から出ている.とっさに右心室を取ったら右心不全も不整脈もコントロールできると考えた.先天性心疾患では単心室症の子供たちがFontan手術で生きている.数か月前まで社会人で元気に働いていた若者の肺血管抵抗が高いはずはないだろうと思い,翌朝,著明に拡大した右室,右房を切り取りFontan循環に変えることにした.心室細動でECMOに乗ったままで開胸し,人工心肺装着,右心室自由壁をできるだけ広範に切除し,右室流出路の冷凍凝固をしたとたん,突然心室細動が整脈に戻った.右室自由壁をPTFEパッチに置き換えた.心房細動も合併していたため,外科的に房室ブロックを作り,拡大した右心房を切除,左心耳と左室にペースメーカーリードを埋め込み,24 mmのPTFE人工血管を使いFontan手術を行った.中心静脈圧は25 mmHgから11 mmHgに下がり,当日抜管.27歳の若者は数か月ぶりに見違えるように元気になり退院していった.その時,術後のエコーで左心室側に偏位していた心室中隔が術後正常に戻っていること,それにより左心機能が著明に改善していることに気がついた.その後重症Ebstein病で著明な右室拡大を来している子供達の右室を切除し右室容積を縮小することでも心室中隔偏位は改善し,左心機能が改善することを知り,Fontan conversionや重症Ebstein病に対するRV/RA Exclusionによる心室中隔の形状変化と左心機能改善をアメリカ胸部外科学会(STS, AATS)で発表した2).発表が終わると,故Buckberg教授が駆け寄って下さり,自分が考えていた心室中隔が心機能に及ぼす影響をSanoは臨床で証明して見せてくれた.どこでそのようなことを考えたのか?と聞かれ,以来メールでデータのやり取りをさせてもらったことを思い出す.なお第1例目の成功を,心臓移植のいらない新しい治療法として直ちに世界中に放送してくれたのは英国BBC放送であった.
純系肺動脈閉鎖症(PA・IVS)に対する段階的減圧による右室・冠動脈瘻の消失と2心室治療
純系肺動脈閉鎖症(PA・IVS)は三尖弁低形成,右室低形成に右室・冠動脈瘻を伴うことが多い.また右室・冠動脈瘻がある症例では,右室の減圧はできず,Fontan循環に行かざるをえず,またFontan手術となっても右室・冠動脈瘻の存在が遠隔期での心機能不全の原因となる治療困難な疾患である.我々は乳児期までに右室減圧を行うことにより右室・冠動脈瘻が縮小することに注目し,手術による肺動脈弁切開後,カテーテルによる段階的減圧により多くの疾患で右室・冠動脈瘻が消失することを認めた.また同じように乳児期までにRV overhaulを同時に行うことにより,低形成な右室が正常近くまで成長することにより70%以上の症例で2心室または1.5心室治療が可能なことを発表した(2000年STS).この方法はOkayama approachとも言われている.さらに従来のRV overhaulでは,右心室特に心尖部の肉柱を広範囲に切除するため,術後に右室拡張末期圧(RVEDP)が高くなり,右心不全を来すことがあった.そこで我々は心尖部の高度な肉柱形成を切除するのではなく,肉柱をできるだけ切断するmodified RV overhaulを考案した.この方法では右室の拡大と同時にRVEDPの低下を認める.この術式の改良により,純系肺動脈閉鎖症(PA・IVS)に対する1心室修復治療(Fontan手術)は10%に低下した3).
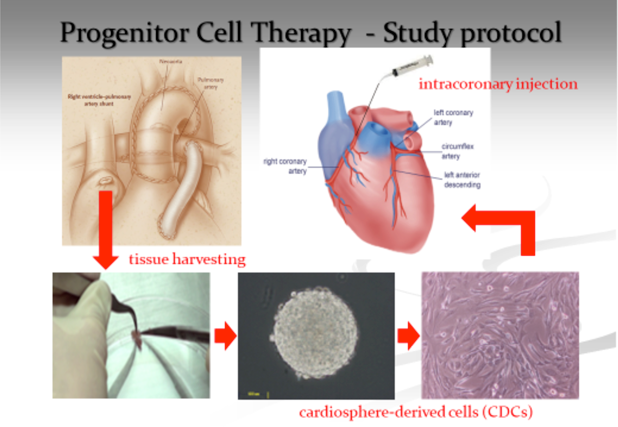
心臓幹細胞治療(Fig. 2)
Fontan手術後に心不全で亡くなる,またFontan Failureを来す子供達を何とか救えないか,特にHLHSのような右心室主体の心臓では正常心筋が5~10%でも増加してくれれば心不全がよくなるのではないかと思っていた.我々が再生医療を始めたのはこのように正常な心筋をわずかでも増やしたいためであった.多くの臨床経験から新生児,乳児の心筋のリモデリング能力が小児と全く異なり,強いことを感じていた.また小児では成人再生医療と異なり,心筋梗塞になった心筋を正常心筋に変える必要はないので,うまくいきやすいのではないかと思っていたときに,王英正先生と出会った.成人ではなかなかうまくいかず再生医療を半ばあきらめていた王先生は小児に対する再生医療に興味を持たれ,京都から岡山に移動され,我々の研究が始まった.新生児未熟児心筋に対する実験を繰り返すうちにうまくいくという確信を得,2011年HLHS患者に対し最初の細胞治療を行った.結果は思った通りで細胞治療後有意な心機能改善を見た.現在我々の再生医療は世界で初めての臨床第3相治験に入っている4).
この他,いくつかの新しい治療法,手術法,補助手段,ペースメーカー(MedtronicのDDDペースメーカーのデザイン,操作法は私の考案である)などを考えたが,その多くが現在世界で使用されている.しかしほとんどのアイデアはうまくいかなかった患者さんたちがヒントを与えてくれたものである.また先人の論文の中にも多くのアイデア,ヒントがあった.PTFE人工血管のように昔はなかったので,うまくいかず埋もれてしまった手術法なども沢山ある.同じ人間が考えるのであるから似たようなことを考えている.そのようなヒントをいかに活かすかが問題であろう.
我々の領域にはまだまだ新しい治療法がたくさん眠っている.ヒントは多くの患者さんが教えてくれる.臨床にどれだけ真剣に向き合うか,若い人達にも学術的で革新的なマインド(mind)をもって日々を過ごしてもらいたい.