症例
女性
家族歴
父が胃癌,母が高血圧.糖尿病や褐色細胞腫の家族歴なし
臨床経過
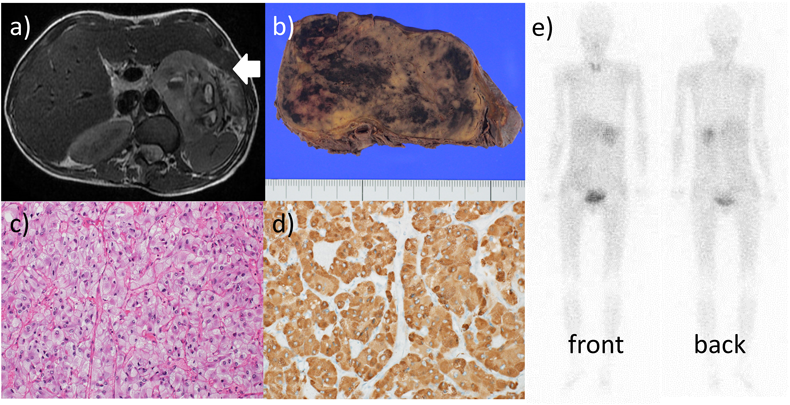
新生児期に両大血管右室起始(double outlet right ventricle: DORV),遠位型心室中隔欠損と診断された.1歳1か月の心臓カテーテル検査で,肺動脈圧95/45(75)mmHg,肺体血圧比1.0だった.9歳の心臓カテーテル検査でも,肺動脈圧120/70(88)mmHg,肺血管抵抗値23.0 Wood Unit·m2,肺体血圧比1.0であった.奇形症候群や染色体異常を指摘されたことはなく,またそれらを疑う所見も認めなかったが,乳児期よりESの病態を呈し心内修復術の適応外とされ,内服薬による抗心不全療法を行っていた.1歳頃から発作性上室頻拍を反復し,9歳時の電気生理学的検査で房室結節リエントリー性頻拍と診断した.23歳時に血液検査で血糖値:128 mg/dL, HbA1C: 7.4%が判明し,2型糖尿病と診断しα-グルコシダーゼ阻害薬(ボグリボース),DPP-4阻害薬(シタグリプチン)の内服で加療した.24歳時から収縮期血圧150 mmHg程度の高血圧を認めた.25歳時から発作性の頻脈を認めるようになった.27歳時に感染性心内膜炎を発症し,抗菌療法で治癒した.30歳時に頻拍発作後の腹痛と背部痛があり,CTとMRIで径78 mmの左副腎腫瘍を認め(Fig. 1a),尿中アドレナン250.8 µg/day(基準値:3.4~26.9 µg/day),尿中ノルアドレナリン5643 µg/day(基準値:48.6~168.4 µg/day),尿中メタネフリン2.20 mg/day(基準値:0.04~0.19 mg/day),尿中ノルメタネフリン19.36 mg/day(基準値:0.09~0.33 mg/day)と高値,123I-MIBGシンチグラフィーで同部位に集積を認め(Fig. 1e),左副腎のPCCと診断した.手術は周術期のリスクから適応外とされ,α遮断薬(ドキサゾシン)とβ遮断薬(メトプロロール)による血圧と頻脈のコントロールを継続した.しかし,コントロールには難渋した.31歳時に肺塞栓,肺梗塞を発症した(Fig. 2).抗凝固療法で症状は改善した.その後SpO2は在宅酸素2 L/minを使用し70%台前半,NYHA心機能分類はII度に相当する状態で日常生活を送っていた.内科治療については利尿薬(フロセミド,スピロノラクトン),ジギタリス製剤(ジゴキシン),抗不整脈薬(ジソピラミド),抗血小板薬(アスピリン),抗凝固薬(ワルファリン),降圧薬(ドキサゾシン,メトプロロール,ニフェジピン),尿酸生成阻害薬(アロプリノール)をそれぞれ内服して加療していた.
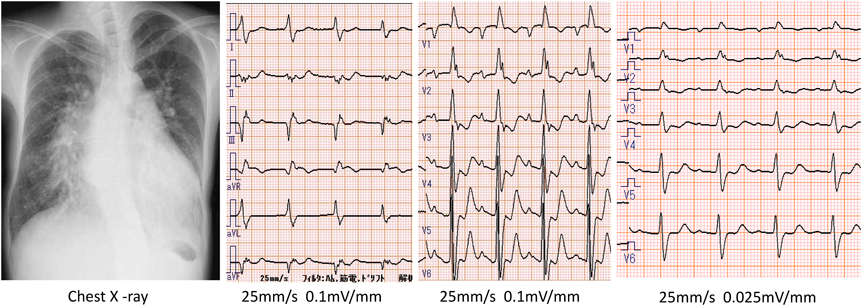
32歳時に感染を契機に心不全が悪化し,入院加療を行った.入院時の血液検査では,WBC 5570/µL, RBC 701×103/µL, Hb 13.8 g/dL, Ht 48.9%, Plt 245×103/µL, PT-INR 2.32,フィブリノーゲン456 mg/dL, FDP 3.5 µg/mL, D-dimer 0.2 µg/mL, BUN 45 mg/dL, CRE 1.50 mg/dL, Na 132 mmol/L, K 6.3 mmol/L, T-Bil 1.1 mg/dL, UA 8.8 mg/dL, CRP 5.7 mg/dL, BNP 624 pg/mLだった.炎症反応の上昇と,腎機能障害,BNPの上昇を認めた.尿定性検査では潜血,蛋白,糖いずれも陰性だった.胸部レントゲンは心胸郭比60%,肺動脈主幹部の拡大,両側肺門部周囲の腫脹と中枢肺血管陰影の増強を認めた(Fig. 3).心電図は心拍数86/minの洞調律で,右軸偏位と完全右脚ブロックを認めた(Fig. 3).
入院後,利尿剤,強心剤,持続的血液濾過透析,BiPAPによる呼吸補助などを行ったが,治療に反応なく入院8日目に死亡した.家族の同意を得て,病理解剖を行った.
病理所見
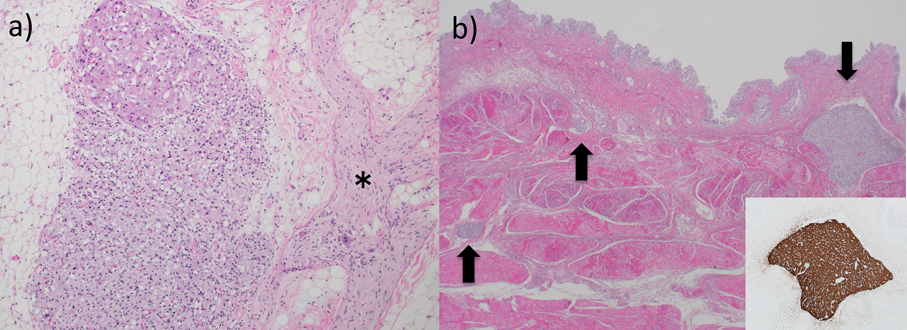
心臓は大動脈が前方,肺動脈が後方でいずれも右室から起始し,右室壁は24 mmと著明に肥厚していた.心室中隔欠損も認めたが,左室,僧帽弁は痕跡的だった.DORVに矛盾しない所見だった.心筋細胞の肥大も認めた.三尖弁と僧帽弁の陳旧性感染性心内膜炎と右肺動脈幹の陳旧性血栓,両肺野の著明な肺水腫とうっ血を認めた.腹部の腫瘍は11×7×4 cm,235 g,多辺形の細胞が胞巣状構造をとって豊富な血管網を伴いながら増生し,腫瘍細胞は免疫組織化学的にクロモグラニンが陽性でPCCの所見であった(Fig. 1b, c, d).またミクロ所見で膀胱および傍大動脈領域に多発性PGLを認めた(Fig. 4a, b).
Succinate dehydrogenase subunit B(SDHB)免疫染色で腫瘍細胞の染色性は保たれ,SDH変異は否定された.肺血管は内膜病変が高度に進行し,Heath–Edwards分類4度,Index of Pulmonary Vascular Disease: 2.8と高度の肺血管閉塞性病変を呈していた(Fig. 5a, b).腎臓はうっ血を伴う糸球体腫大,メサンギウム細胞の軽度増殖とメサンギウム基質の増加を認め,チアノーゼ腎症の所見を呈していた(Fig. 5c, d).
ESは主として肺血流増加型先天性心疾患における終末像で様々な合併症を来す.PCC/PGLは副腎髄質など交感神経系由来の細胞や頚動脈小体など副交感神経系由来の細胞から発生するカテコールアミン産生腫瘍である.主な症状として高血圧,頻脈,動悸,頭痛,発汗過多などがあり,高血圧症患者の約0.1~0.6%にPCCが潜在しているとされている1, 4).
程度や期間の違いはあれども,チアノーゼ性CHDやESに至った患者は一定の期間以上チアノーゼを来す.PCC/PGL発生には以前からチアノーゼ性を中心にCHDとの合併の報告が散見される.Opotowskyらによる米国における全国調査によると先天性心疾患患者の入院数をPCC/PGL合併の有無で比較すると非チアノーゼ性先天性心疾患のオッズ比は0.9に対して,チアノーゼ性先天性心疾患(cyanotic congenital heart disease: CCHD)では6.0で,CCHDでは有意にPCC/PGLによる入院が多く,両者の因果関係が示されている5).既報において,この関係についていくつかの考察がなされている.
まずは慢性低酸素によるPCC/PGLの発生である.CCHD患者や慢性的に低酸素に曝露される高地住民ではPCC/PGLを合併する率が高いという報告がある5, 6).またRodríguez-Cuevasらは高地住民で頸動脈小体腫瘍患者は女性が多く,家族歴がある例は少なかったとし,性差についての考察として男性は肺容量,運動能力が高く,また月経による貧血のリスクもないため慢性的な低酸素をより回避できるからではないかと考察している7).この慢性低酸素とPCC/PGLの関連には低酸素誘導因子(hypoxia-inducible factor: HIF)の活性化の関与が推測されている.HIFとは血管新生やエネルギー代謝などに関連する多数の遺伝子を誘導し,細胞の低酸素応答において中心的な役割を果たす転写因子であり癌細胞の転移能増強に関係している可能性が示唆されている8).つまりここでは,CCHDなどの慢性低酸素(hypoxia)によってHIFが活性化されPCC/PGLの発生に関与しているという推察がなされている9, 10).一方で,遺伝子異常によるpseudo hypoxiaもPCC/PGL発生の関与が推測されている10).PCC/PGLは従来からのNF1, RETなどに加え,近年様々な原因遺伝子が同定されている.特に注目されているのはクエン酸回路のコハク酸脱水素酵素サブユニットをコードするSDH遺伝子である.そのなかでもSDHB(SDHサブユニットB)遺伝子は悪性例や予後不良例が多いとされ注目されている.SDHx変異から腫瘍形成に至る機序はまだ不明な点も多いが,これら褐色細胞腫の原因遺伝子の下流にHIFが存在し,遺伝子異常によって低酸素とは無関係にHIFが活性化することからpseudo hypoxiaとしている10).つまり,これらの文献では慢性的な低酸素(hypoxia),またはSDHなどの遺伝子異常(pseudo hypoxia)によっていずれもHIFが活性化され,PCC/PGL発生へと進行するのではないかと考察されている.本症例は乳児期からSpO2 70%台のチアノーゼが長期に持続しており,長期の低酸素がPCC/PGL発症の誘因になった可能性がある.若年発生であるが,SDHB免疫染色でSDH変異は否定された.
またCHDを起こす発生学的素因もPCC/PGL発生に関与している可能性があるとされている.PCC/PGLが発生する副腎髄質や交感神経節も,CHDの約30%を占める病変箇所である心臓流出路も発生学的には神経堤細胞を由来としている11, 12).既報におけるCHDとPCC/PGLの高い合併率についてはPCC/PGLと同一の起源である神経芽腫群腫瘍としての報告が散見される13, 14).理由として同じ神経堤細胞を由来としているから合併が多いのではないかと考察されている.CHD患者の管理の進歩により慢性的な低酸素に暴露される症例は減少しているが,チアノーゼのすでに消失した症例や非チアノーゼ性CHDでも症例数は少ないもののPCC/PGLやその類縁疾患を発症していることからも,この考えは支持される.本症例の心疾患は心臓流出路の異常の範疇にあるDORVであり,その発生学的素因もPCC/PGL発症に関与している可能性がある.
CHDがPCC/PGLを合併する明確な原因については前述した低酸素,遺伝子異常に加え,他の病態因子,またはこれらの複合などの可能性もあり,今後の症例の蓄積とさらなる検討が必要と思われた.
Opotowskyらは前述の全国調査の中でESに合併したPCC/PGLを3例報告している5).心疾患については2例が心室中隔欠損,1例が左室型単心室で,診断の契機は頻脈や頭痛など本症例と同様であった.PCC/PGLの治療の詳細についての記述はなかったが,いずれも酸素飽和度70%台が40~50年持続した症例で,診断年齢は40~50歳代と本症例より高年齢でかつ長期のチアノーゼが持続している例だった.これらの症例も慢性的な低酸素がPCC/PGLの発生に関与した可能性があると考察されている.
PCC/PGLの高血圧や頻脈,心不全や不整脈などの症状はCHDの症状とオーバーラップしており,CHD患者のPCC/PGLの診断は遅れがちになりやすい.またなかには無症状のPCC/PGL患者も存在する.Batisse-LignierらはPCC/PGLによる心筋症の誘発を報告し,臨床経過と矛盾する心筋症様変化が出現した際にはPCC/PGLの検査をすることを薦めている15).本症例では20代から持続する高血圧,発作性の頻脈があった.後方視的に見ると,経過中に発症した糖尿病もPCC/PGLのカテコラミン,特にαとβ受容体に作用するアドレナリンによるインスリン分泌抑制,グルカゴン分泌亢進,糖新生亢進の影響と思われた.PCC/PGLの正確な発症時期の推定は困難であるが,発見された時には既に腫瘍も大きく,診断の時期については反省すべき点である.またPCCの診断確定後も,ESによるPCCの治療の制限,PCCによる高血圧,頻脈の心血行動態への悪影響など治療と管理に難渋した.肺高血圧の存在は,それ自体が心筋負荷や心筋障害に基づく心不全と不整脈をもたらし,PCC/PGLの心不全や頻脈による心血行動態の悪影響と相互に悪影響を及ぼしてしまう.他にもインスリン抵抗性と心不全16),糖尿病やチアノーゼ性腎症による腎不全と心不全など,様々な要因で相互に悪影響を及ぼしやすい病態の存在も一層管理を難しくした.
ESにおいて,患者の非心臓手術における周術期死亡率は近年減少してきているとはいえ,肺体血管抵抗のバランスの調整,適切な循環血漿量の維持,出血のコントロールなど周術期に抱える問題点は多い.PCC/PGLの一般的な予後については再発や転移のリスクはあるものの,腫瘍が良性の場合には手術によって約90%完治するとされており,主な死因はカテコラミン過剰による急性心不全であることからも早期診断は重要である.本症例でも仮に,手術で腫瘍の切除ができたら,心症状や入院回数の減少,クリーゼの回避など様々な効果が期待できたであろう.手術以外の内照射,化学療法については明らかな奏功は示さないことが多いとされているし,何よりも循環動態の変動というリスクも大きい.そのため本症例では見合わせ,心不全と高血圧のコントロールに終始せざるをえなかった.PCC/PGLの診断の遅れは高血圧クリーゼ,心筋症,心不全,不整脈,脳血管合併症など重篤な合併症をもたらすため,CHD患者におけるPCC/PGLにおいても早期診断を行い,周術期のリスクが低いうちに外科治療に結びつけることが重要であると思われた.
CHD患者で心疾患に起因する症状だけでは説明のつかない頻脈や高血圧などが出現した際には,PCC/PGLも鑑別疾患として念頭に置くべきである.また,CHDに合併したPCC/PGLの治療にはCHDによる全身状態を勘案した治療方針の決定が不可欠であり,より適切な管理・治療を確立するためにもさらなる症例の蓄積が望まれる.