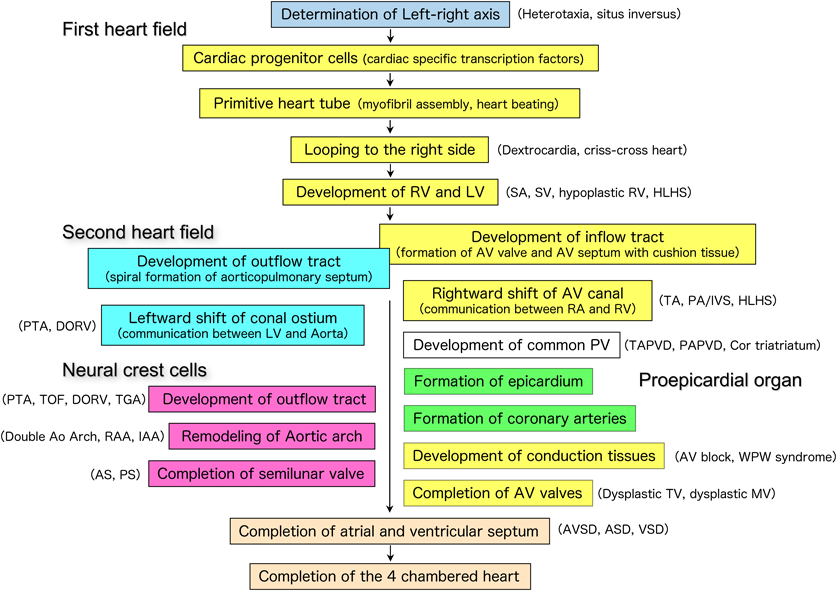
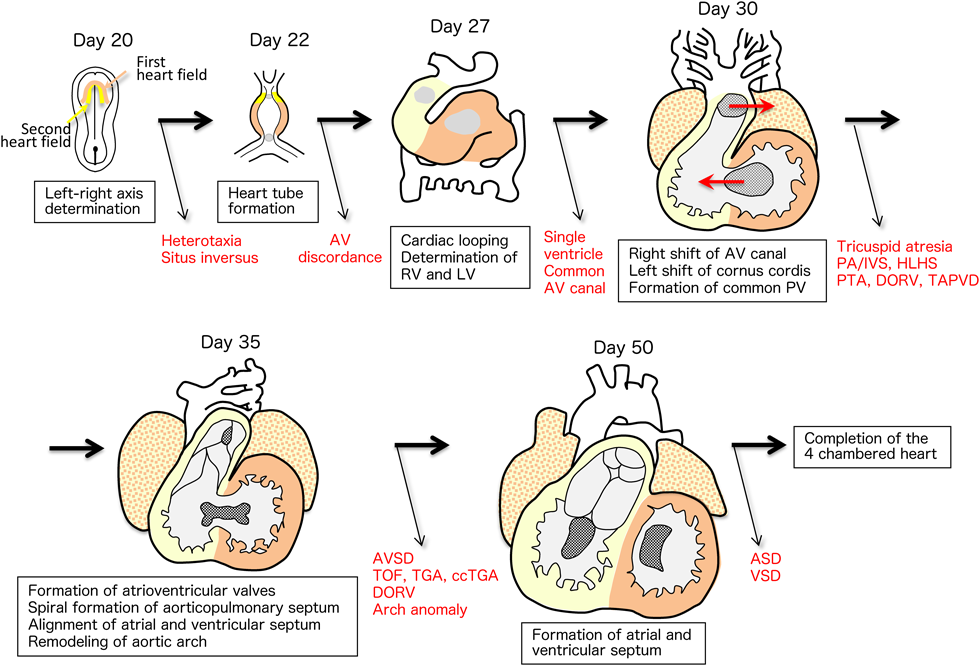
胎生期の心臓発生は,まず原始結節における左右軸の決定に始まり,その情報が左右の側板中胚葉に伝達される.頭側部分の心原基(予定心臓領域,cardiogenic region)では,未熟な中胚葉細胞が,心筋特異的な転写因子を発現する心筋前駆細胞(cardiac progenitor cells)へと分化する.心筋前駆細胞はさらに分化を進めながら次第に胚の中央に移動して心筋細胞(cardiac myocytes)となり,正中で1本の原始心臓管(primitive heart tube)を形成する.原始心臓管は蠕動様に収縮し,次第に律動的な収縮を開始するとともに,胚の右方へ屈曲ルーピング(cardiac looping)して心臓の外形を形成する.原始心臓管では,尾側から頭側に向かって,静脈洞(sinus venosus),原始心房(atrium),原始心室(ventricle),心球(bulbus cordis),動脈幹(truncus arteriosus)の順に各コンポーネントがセグメント状に決定される.これらの前後方向のセグメントは,心ループの形成に伴って,特に心室部分では左右の位置関係に変換する.同時に心臓管の伸長に伴って心室が下方に垂れさがり,心房心室の上下関係が入れ替わる.一方,原始心臓管の内部では,房室管部分において上下左右の4つの心内膜床(endocardial cushion)が発達し,2つの房室弁と心室心房中隔の一部が形成される.また流出路では,2つ(初期は4つ)の円錐動脈幹隆起(conotruncal swelling)が発達し,肺動脈と大動脈をらせん状に分割する.さらに心房中隔および心室中隔が発達完成し,最終的にヒトでは胎生50日頃に2心房2心室の心臓が完成する1–5)(Fig. 1).
このような心臓形態形成には,主に左心室と心房筋の一部を形成する一次心臓領域(first heart field)の心筋細胞,右心室と心房筋の一部を形成する二次心臓領域(second heart field)の心筋細胞,大動脈と肺動脈を分割する動脈幹中隔(aorticopulmonary septum)の間質細胞および大動脈肺動脈の平滑筋に分化する心臓神経堤細胞(cardiac neural crest cell),心臓の下部で肝臓との境界に発端し,心外膜を形成して心臓を包んだのち心筋層内に陥入し,線維芽細胞,血管内皮,平滑筋細胞に分化する心外膜前駆組織(proepicardial organ)から構成される5)(Fig. 2).
先天性心疾患の多くは,胎児の遺伝子異常や児および母体の環境要因が原因となって,これらの心臓形態形成の過程が一部停止するか,もしくはわずかに逸脱した結果で生じる.
左右軸の決定とその情報伝達:内臓心房錯位(無脾症,多脾症),内臓逆位,Kartagener症候群など
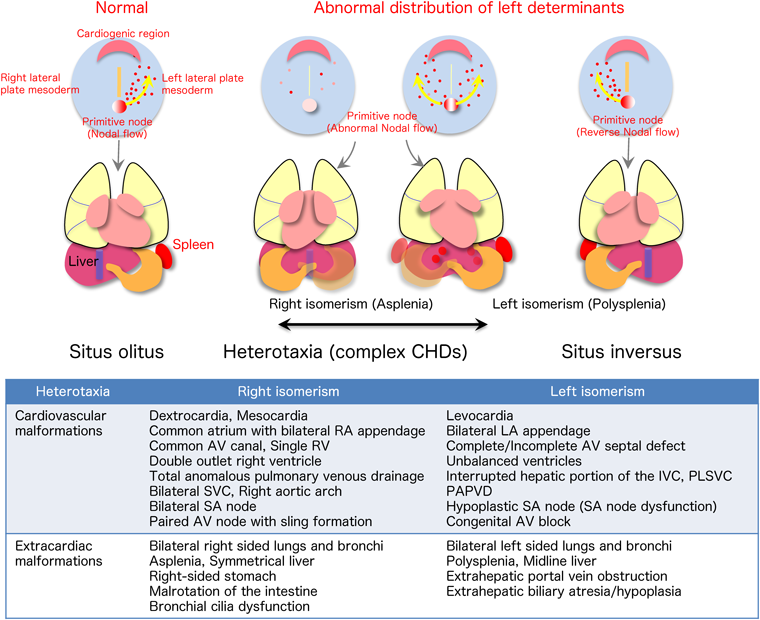
三層性胚盤の中央に位置する原始結節(primitive node)の結節細胞(node pit cells)は一本の繊毛(cilia)を持ち,反時計方向にらせん回転している.繊毛は尾側に傾いているため,上部では左向きの定常流(nodal flow)が生じる.この流れを原始結節周辺の細胞(node crown cells)が感知し,カルシウムイオンの上昇を介してNodal, Lefty2, Pitx2などの成長因子や転写因子が左側側板中胚葉(left lateral plate mesoderm)に優位に発現し,最終的に左側の心原基(予定心臓領域,cardiogenic region)に伝達される.このような左右軸を決定する情報伝達物質が原始結節で十分に産生されない,もしくは左向きのnodal flowに異常があると,心臓を含む臓器の左右情報が成立しないもしくはランダム化し,内臓錯位(heterotaxy:右側相同(right isomerism:無脾症),左側相同(left isomerism:多脾症))が発症する6)(Fig. 3).
胚の頭側に位置する予定心臓領域(precardiac mesoderm, cardiogenic region)の中胚葉細胞において,Nkx2.5やGAT A4などの心筋特異的転写因子(cardiac specific transcription factors)が発現するようになり,未熟な中胚葉細胞は心筋前駆細胞(cardiac progenitor cells)へと決定および分化する.心筋前駆細胞には,一次心臓領域(両心房,左室)と二次心臓領域(両心房,右心室)に各々分化する領域が予め決定付けられている.心筋前駆細胞はやがて左右の心原基を形成し,各々中央へと移動して癒合し原始心臓管(primitive heart tube)を形成する.同時に心筋前駆細胞には筋原線維(myofibrils)が発達して心筋細胞(cardiac myocytes)へと分化し,心臓管の律動的な収縮が開始する1, 2).
原始心臓管の完成と心ループ形成:房室不一致,修正大血管転位,右胸心,上下心,十字心など
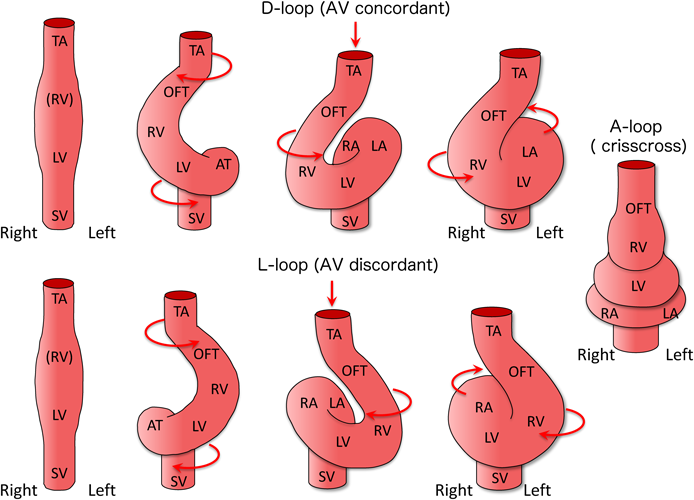
収縮を開始した原始心臓管は,伸長しながら右方へ屈曲ループするとともに,左右心室の原基は大きく膨隆し,心臓の外観ができあがる(Fig. 4).原始心臓管がループ屈曲を強め,心房心室中隔および両大血管の分割が完成すると,1本の心臓管からなる直列循環から,肺循環と体循環が分離独立した交叉循環ヘと移行する(Fig. 4).左方向に心ループ形成が進むと,内臓心房の左右と心室の左右が不一致となり,房室錯位となる.また左右でなく前方にループ形成が起きると,心房と心室関係は左右と上下のねじれの関係になり上下心室配列(superior inferior ventricle)に,さらにその状態から心室の位置関係がねじれると,房室弁交叉(十字心,crisscross heart)が形成される5).
房室管の右方移動:三尖弁筋性閉鎖,一側房室弁閉鎖による単心室など
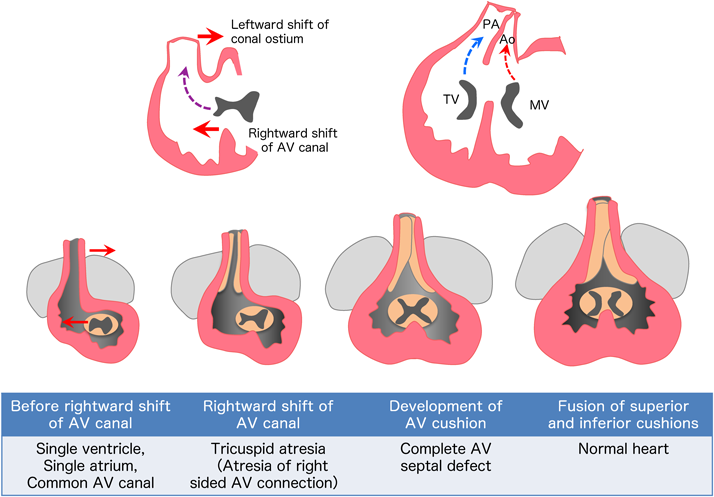
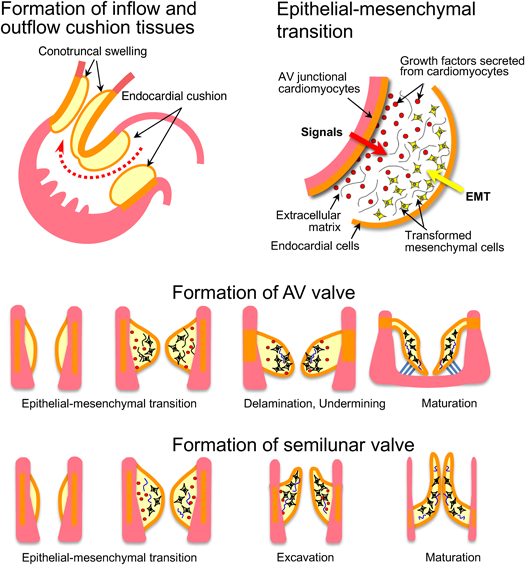
心ループ形成が進行すると両心室は次第に膨隆し,中央に筋性部心室中隔が形成され上方へと発達する.右心室の発達により心室中隔は相対的に左方に移動し,その結果,房室管(atrioventricular canal:共通房室弁口)は心室中隔を越えて右心室側と連続性を持つようになる(房室孔の右方移動:rightward shift of atrioventricular canal).最終的に上下心内膜床組織が中央で癒合して共通房室弁口を左右2つの弁口に分け,右側部分は右心房と右心室との間に新たな交通を作り三尖弁となる.もともと心房心室間で連続性のある左側部分は,僧帽弁へと発達する5)(Fig. 5).
心内膜床組織の発達と房室弁の形成:共通房室弁口,完全型房室中隔欠損,不完全型房室中隔欠損,流入部心室中隔欠損など
心臓管のループ形成が進行すると,房室管および円錐部の心筋細胞には,心筋への分化抑制シグナルが発現するとともに,対側の心内膜組織に向かって,上皮–間葉転換(epithelial–mesenchymal transition; EMT)を促すシグナル分子が放出される.その結果,その部分に豊富な間質が発達し,心内膜床組織,円錐動脈幹隆起が形成される(Fig. 6).流入路には上下左右の心内膜床組織(endocardial cushion tissue)が隆起し,リモデリング,特に侵食(undermining)の過程を繰り返して,僧帽弁,三尖弁,心房中隔下部,心室中隔流入部の形成に関与する.一方,流出路においては,2つ(初期は4つ)の円錐隆起と動脈幹隆起(conotruncal swelling)が発達し,近位部の隆起と遠位部の隆起が空間的にねじれた位置関係で癒合するため,肺動脈と大動脈はらせん状に分割される2–6).
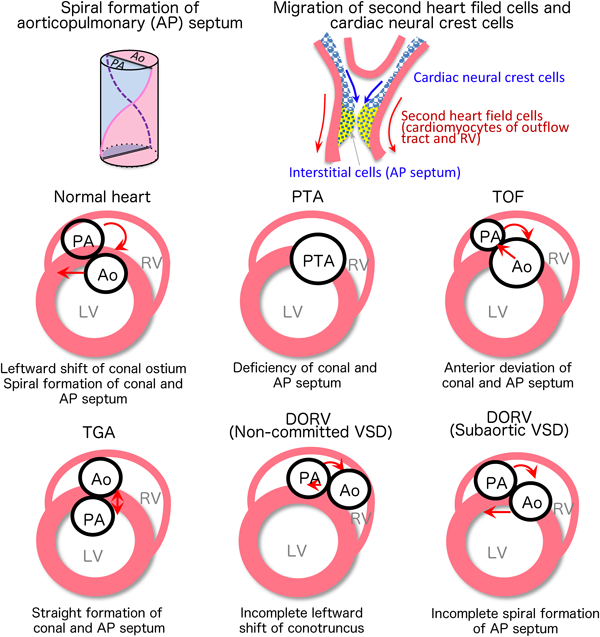
円錐口の左方移動(両大血管右室起始)と円錐動脈幹中隔のらせん形成:総動脈幹遺残,両大血管右室起始,完全大血管転位,ファロー四徴症,大動脈–肺動脈窓など
房室口が右方向へ移動するのと時期を同じくして,流出路および動脈幹は左側へ移動する(円錐口の左方移動:leftward shift of conal ostium).胎生28日頃,原始心臓管の流出路に円錐動脈幹が形成される.その内部には一対の円錐動脈幹隆起が発達し,ねじれの位置関係において癒合し,肺動脈と大動脈をらせん分割する.その結果,流出路の円錐中隔と筋性中隔は接続するとともに,動脈幹中隔によりらせん状に分割された肺動脈と大動脈のうち,後方大血管である大動脈は新たに左心室と交通するようになる.円錐動脈幹隆起の下部にあたる漏斗部中隔は最終的に心室中隔と結合し,肺動脈と大動脈はそれぞれ右心室と左心室に整列する.このような右室流出路の心筋層の形成には,臓側中胚葉から遊走し分化する二次心臓領域の心筋細胞(Tbx1, Isl1陽性)が大きく関わっている.また,動脈幹中隔のらせん分割は,頸部神経堤から遊走する心臓神経堤細胞(Pax3, Wnt1陽性)の関与により形成される2–5)(Fig. 7).
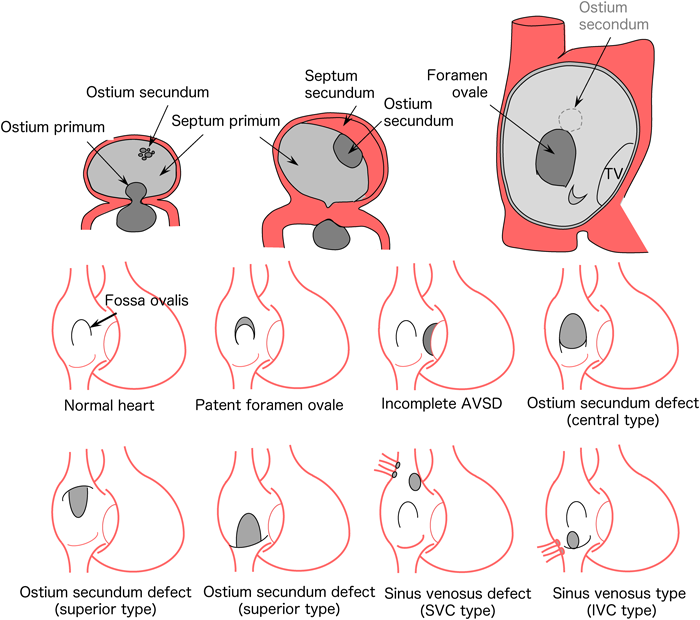
心房および心室中隔の形成:房室中隔欠損,心房中隔欠損,心室中隔欠損
胎生30日頃に心房上端中央が下方に陥凹するとともに,その部分から心房一次中隔が形成される.心房一次中隔は下方に伸長し下端に欠損孔を残す(一次孔)が,後に心内膜床組織により閉鎖される.心房一次中隔の上方には複数の欠損孔が形成され,それらが合わさって二次孔となる.胎生35~37日になると,心房一次中隔の右房側上方より心房二次中隔が形成される.二次中隔も一次中隔と同様に,中央から下端にかけて欠損孔を残す(卵円孔).最初にできた薄い一次中隔は弁様構造となり,胎盤から右房に還流した血液が二次孔と卵円孔の間を通り抜けて左房へ一方向性に向かうようになる.生後呼吸が始まると大量の肺静脈血が左心房へ還流するため,一次中隔は左房から圧迫され,最終的に閉鎖する(Fig. 8).心房中隔欠損には,卵円孔開存,一次孔欠損,二次孔欠損(上縁欠損型,中心窩型,下縁欠損型),静脈洞欠損(上大静脈型,下大静脈型)が存在する.静脈洞欠損は,右上下肺静脈が上大静脈および下大静脈とそれぞれ交差する際に,両者が癒合して形成すると考えられている2–5).
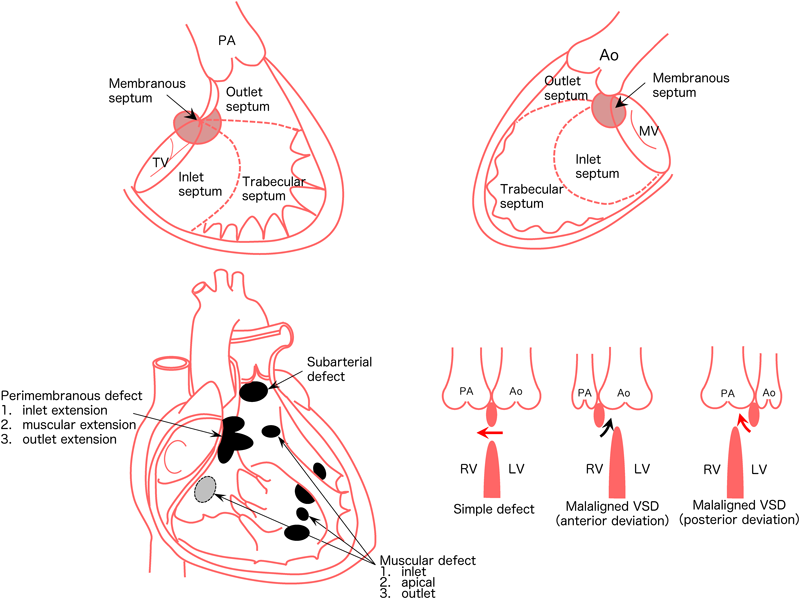
心室中隔は発生学的起源より,1. 流入部中隔(心室洞部平滑性中隔:心内膜床組織由来),2. 筋性部中隔(心室洞部筋性中隔),3. 漏斗部中隔,4. 膜様部中隔,以上の4つのコンポーネントから成り立つ.こられの形成に異常があると,心室中隔欠損が発症する(Fig. 9).
心室中隔欠損の分類としては,
- 1. 膜様部型(perimembranous defect)
- 流入路進展(inlet extension)
- 筋性部進展(muscular extension)
- 流出路進展(outlet extension)
- 2. 筋性部型(muscular defect)
- 流入部型(inlet muscular)
- 心尖部型(apical muscular)
- 流出路型(outlet muscular)
- 3. 大血管下型(subarterial defect)
があり,頻度としては,1, 2, 3の主要コンポーネントが重なり合う部分である膜様部欠損が最も多く,約半数を占める.
欠損孔の分類には,各々のコンポーネントが十分に発達せず到達しないために発症する単純型(simple defect),二つの中隔が空間的にずれて形成されたために発症する並列異常(malalignment)型にも分類される1, 5).
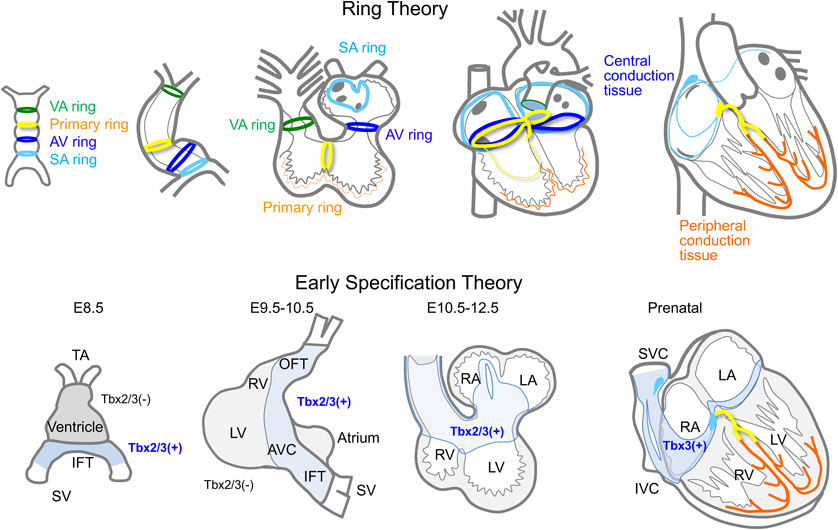
心臓刺激伝導系は,発生と分化に重要な役割を果たす様々な因子が,時間的かつ空間的に制御される形で発現および消退し,洞結節からPurikinje線維までの一連の組織が形成される.古くから,原始心臓管の前後軸方向のセグメントに沿って,静脈洞から総動脈幹までの部分に将来刺激伝導系に発達する輪状の組織が存在し,それらが心ループ形成の進行とともに複雑に捻れて中枢側の刺激伝導系を形成すると考えられてきた(Ring theory)7).最近では,心房心室筋の特異的な部分にあらかじめNotch, Bmpなどの形態形成因子やT-box型転写因子が発現し,原始心臓管の特定の部位の未熟な心筋細胞が作業心筋へと分化することを抑制する形で制御し,洞房結節からHis束までの小型細胞から成る中枢側の刺激伝導系組織を形成すると考えられている(Early specification theory)8).一方,末梢のPurkinje線維は,周囲の血管組織や間質組織から分化シグナルを受けて(recruitment),細胞体が大きくグリコーゲンに富んだ特殊心筋へと分化発達する.最終的にHis束末端で中枢側の刺激伝導系組織と連続する(Fig. 10).
肺静脈の形成:総肺静脈還流異常,部分肺静脈還流異常,三心房心,肺静脈閉鎖など
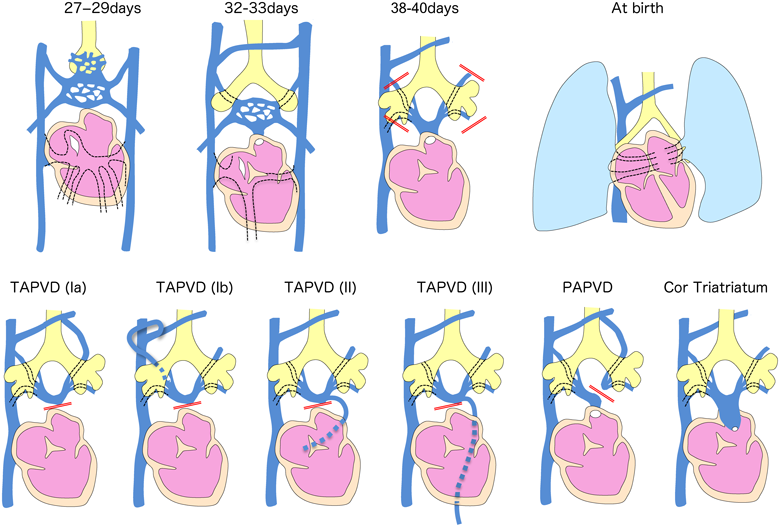
原腸の前方より出芽した肺原基の周囲には肺静脈叢が発達し,発生当初は体静脈系である原腸静脈叢と交通している.胎生28日頃に左心房後壁より共通肺静脈が後方に向かって萌出し,肺静脈叢と結合するようになる.肺静脈が左心房と交通するようになると,体静脈である原腸静脈叢との交通は消失する.これ以前に肺静脈–左心房間の結合が遮断されると,肺静脈血は還流する場を失い,やむを得ず近傍の体静脈である原腸静脈叢(上大静脈や冠状脈洞)を経て右心房に還流し,総(もしくは部分)肺静脈還流異常が発症する2–5)(Fig. 11).また,原始的な共通肺静脈腔が遺残し,左心房との間に十分に広い交通孔を形成しない場合,三心房心が発症する.最近では,心臓流入路心筋前駆細胞と肺血管叢の細胞は共通した前駆細胞(心肺前駆細胞:cardiopulmonary mesoderm precursors; CPPs細胞)に由来することが明らかになり,肺静脈還流異常の病因との関連が示唆されている9).
大動脈弓のリモデリング:大動脈弓離断,鎖骨下動脈起始異常,血管輪など
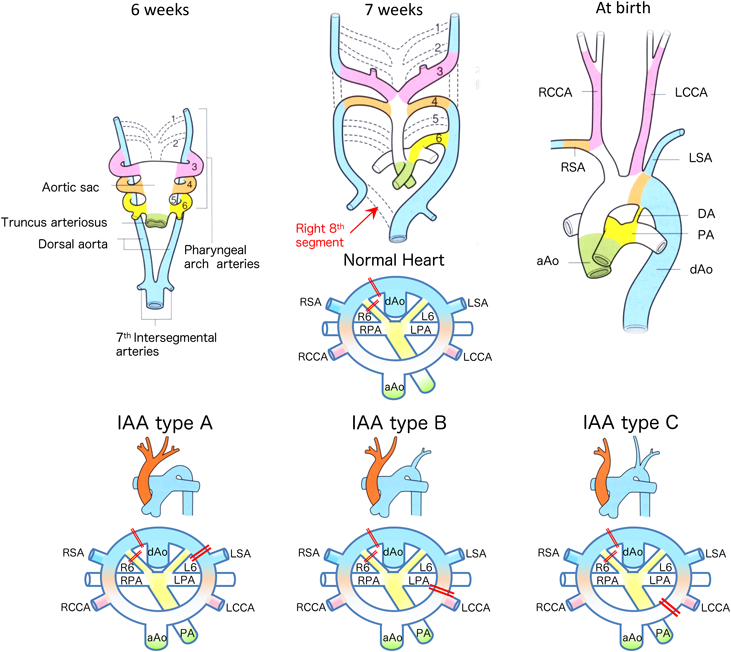
胎生期に心臓から駆出された血液は,総動脈幹,大動脈嚢,6対の咽頭弓脈,および背側大動脈を経て全身へ供給される.ヒトでは大動脈–肺動脈系を形成するのは第3, 4, 6咽頭弓動脈のみであり,その他はリモデリングの過程を経て消失する.ヒトの正常左大動脈弓では,右背側動脈の遠位部に当たる第8セグメントと右の動脈管が消退することで形成される.Edwardらは,重複大動脈弓(double aortic arch)を基本形態として,正常大動脈弓の発達と大動脈弓異常の各種疾患を説明できる模式図を提唱した2–5)(Fig. 12).本模式図により,大動脈弓の発生異常はほぼ全て説明が可能である.
以上のような過程を経て胎生期の心臓は完成する.これらの知識を整理して,今後は,先天性心疾患の原因解明と発症予防をさらに推し進めるとともに,患者の生涯にわたる生活の質の向上をめざし,心臓発生学の基礎知識を内科的診療および外科的治療に応用して行く必要がある.また同時に,心臓大血管の臓器再生のために不可欠な基礎知識として,心臓発生学を再生医療にも応用発展させてゆくことが重要と考えられる.
利益相反
本稿について開示すべき利益相反(COI)はない.
略語
- CHD
- congenital heart disease
- RA
- right atrium
- RV
- right ventricle
- LA
- left atrium
- LV
- left ventricle
- TV
- tricuspid valve
- MV
- mitral valve
- AV canal
- atrioventricular canal
- TA
- truncus arteriosus
- SV
- sinus venosus
- IFT
- inflow tract
- OFT
- outflow tract
- RSA
- right subclavian artery
- RCCA
- right common carotid artery
- LCCA
- left common carotid artery
- LSA
- left subclavian artery
- DA
- ductus arteriosus
- aAo
- ascending aorta
- dAo
- descending aorta
- PA
- pulmonary artery
- LPA
- left pulmonary artery
- RPA
- right pulmonary artery
- SA ring
- sinoatrial ring
- AV ring
- atrioventricular ring
- VA ring
- ventriculoarterial ring
- AVC
- atrioventricular canal
- ASD
- atrial septal defect
- VSD
- ventricular septal defect
- AVSD
- atrioventricular septal defect
- SA
- single atrium
- SV
- single ventricle
- AV concordant
- atrioventricular concordant
- TA
- tricuspid atresia
- PA/IVS
- pulmonary atresia with intact ventricular septum
- HLHS
- Hypoplastic left heart syndrome
- TOF
- tetralogy of Fallot
- PTA
- persistent truncus arteriosus
- DORV
- double outlet right ventricle
- TGA
- transposition of the great arteries
- ccTGA
- congenitally corrected transposition of the great arteries
- PAPVD
- partial anomalous pulmonary venous drainage
- TAPVD
- total anomalous pulmonary venous drainage
- IAA
- interrupted aortic arch
- RAA
- right aortic arch
- AS
- Aortic stenosis
- PS
- pulmonary stenosis
- WPW
- Wolf-Parkinson-White
引用文献References
1) Sizarov A, Baldwin HS, Srivastava D, et al: Development of the heart: Morphogenesis, growth, and molecular regulation of differentiation, in Allen HD, Shaddy RE, Penny DJ, et al (eds): Moss and Madams’ Heart Disease in Infants, Children, and Adolescents Including the Fetus and Young Adult, 9th edition. Philadelphia, Wolters Kluwer, 2016, pp 1–54
2) Sadler TW: Cardiovascular system. Langman’s Medical Embruyology, 13th edition. Philadelphia, Wolters Kluwer, 2015, pp 175–217
3) Moore KL, Persaud(瀬口晴彦,小林俊博訳):TVN心臓循環器系.ムーア人体発生学.8th edition. Gracia del Saz E. pp 271–318
4) Dews U(塩田浩平訳):発生学アトラス.東京,文光堂,1997, pp 132–205
5) 山岸敬幸,白石 公:先天性心疾患を理解するための臨床心臓発生学.メディカルビュー社,2007
6) Shiraishi I, Ichikawa H: Human heterotaxy syndrome: From molecular genetics to clinical features, management, and prognosis. Circ J 2012; 76: 2066–2075
7) Jongbloed MR, Mahtab EA, Blom NA, et al: Development of the cardiac conduction system and the possible relation to predilection sites of arrhythmogenesis. Sci World J 2008; 8: 239–269
8) Christoffels VM, Moorman AF: Development of the cardiac conduction system: why are some regions of the heart more arrhythmogenic than others? Circ Arrhythm Electrophysiol 2009; 2: 195–207
9) Peng T, Tian Y, Boogerd CJ, et al: Coordination of heart and lung co-development by a multipotent cardiopulmonary progenitor. Nature 2013; 500: 589–592

 =一次心臓領域由来の心筋
=一次心臓領域由来の心筋  =二次心臓領域由来の心筋.左右心房筋は両者に由来する.
=二次心臓領域由来の心筋.左右心房筋は両者に由来する.