2003年4月から2017年3月までの期間,心外導管再建例を除くPVR施行した32例(男23例,女9例)を対象とした.臨床症状,心電図,胸部レントゲン,心エコー,MRI,心臓カテーテル検査などの精査を行って手術適応を決定した.心臓超音波検査で逆流到達距離が10 mm以上の中等症のPRを認め,1. 有症状,2. RVEDVI≧160 mL/m2,3. 右室駆出率(right ventricular ejection fraction: RVEF)≦45%,4. 不整脈の出現,5. 有意な遺残短絡を伴う症例のうちいずれか2つ以上を満たすものを手術適応とした.不整脈の合併した症例に関しては,電気生理学的検査(Electro Physiological Study: EPS)を施行して評価した.
患者データをTable 1に示す.PVR時の平均年齢は32.3±11.3歳(13~60歳)であった.
Table 1 Patient characteristics| No | sex | age (PVR) | age (ICR) | NYHA | Arrythmia | PS | RVEDVI (mL/m2) | Operation |
|---|
| 1 | M | 37 | 3 | I | | | — | PVR (#23 CEP), RVOT Enlarge, Cryoablation On RV |
| 2 | M | 22 | 3 | I | AFL | | 145.3 | PVR (#23 CEP), Cryoablation Of RA |
| 3 | F | 22 | 3 | I | | | 75 | PVR (#21 CEP), L-PA Plasty, Tumor Resection |
| 4 | M | 13 | 5 | I | AF | | — | PVR (#23 CEP), Bilateral Extensive PA Plasty |
| 5 | M | 23 | 4 | I | | | 196.1 | PVR (#25 CEP), Cryoablation On RV and Isthmus |
| 6 | F | 35 | 0 | I | | + | 160.2 | PVR (#25 CEP), L-PA Plasty, Cryoablation On Isthmus |
| 7 | M | 40 | 2 | I | | | 277.7 | PVR (#23 CEP), RV Reduce, Cryoablation On Isthmus |
| 8 | M | 45 | 4 | I | VT | | 171.9 | PVR (#25 CEP), RV Reduce, Cryoablation On Isthmus |
| 9 | M | 24 | 4 | I | | + | 165 | PVR (#25 CEP), Resection Of R-PA Fold |
| 10 | F | 28 | 6 | I | | + | 96 | PVR (#23 CEP), TV Plasty, L-PA Plasty |
| 11 | M | 20 | 3 | I | | | 128 | PVR (#25 CEP), L-PA Plasty |
| 12 | M | 30 | 3 | I | A-V block (1), AFL (PM) | | 157 | PVR (#25 CEP), Resection Of Muscular Band |
| 13 | M | 41 | 3 | I | | | 174 | PVR (#25 CEP), PFO Closure, Cryoablation On Isthmus |
| 14 | M | 41 | 1 | I | | | 164 | PVR (#25 CEP), RV Reduce, Cryoablation On Isthmus |
| 15 | M | 36 | 2 | I | AFL | | 180.6 | PVR (#25 CEP), ASD Closure, RA MAZE, Cryoablation On Isthmus |
| 16 | M | 43 | 2 | II | | | 155.5 | PVR (#23 CEP), PFO Closure, Cryoablation On RVOT, RV Patch Removal |
| 17 | M | 20 | 1 | I | | + | 106 | PVR (#21 CEP), Patch Augumentation Of RVOT and L-PA |
| 18 | M | 21 | 3 | II | | + | 140 | PVR (#23 EPIC), AVR (#23 ON-X), AAo Replacement (28 mm TRIPLEX) |
| 19 | M | 36 | 1 | I | VT(syncope), AFL | | 145 | PVR (#23 EPIC), Patch Augumentation Of M-PA, TVP, Cryoablation on RA and RV |
| 20 | F | 60 | 18 | III | AF | | 193.7 | PVR (#23 EPIC), ASD Closure, TAP (#28 MC), MAZE |
| 21 | M | 43 | 3 | I | | | 192 | PVR (#25 EPIC), Cryoablation of RA |
| 22 | M | 49 | 3 | II | AF(PM), VT | | 268.5 | PVR (#23 CEP), TVP (#30 MC3), RVOT Resection, PFO closure, Cryoablation On RV |
| 23 | M | 41 | 7 | III | | | 319.5 | PVR (#23 EPIC), TAP (#30 MC3) |
| 24 | M | 46 | 5 | I | | | 173.7 | PVR (#25 EPIC), AAo Replacement (#30 MM), TVP (#30 MC3), Cryoablation On RA |
| 25 | F | 51 | 3 | I | NSVT | | 156 | PVR (#25 EPIC), ASD Closure, Cryoablation On RV and RA |
| 26 | M | 23 | 2 | I | AFL | | 212 | PVR (#25 EPIC), PFO Closure, Cryoablation On RA |
| 27 | F | 25 | 4 | II | | | 241 | PVR (#25 EPIC), RVOTR |
| 28 | F | 22 | 1 | I | | | 283 | PVR (#23 EPIC), TAP (#28 TAP RING), Cryoablation On RA and Isthmus |
| 29 | F | 32 | 3 | II | VF | | 239 | PVR (#25 EPIC), Cryoablation On RVOT and Isthmus |
| 30 | F | 22 | 2 | I | | | 168 | PVR (#23 EPIC), PFO Closure, Cryoablation On Ishmuus |
| 31 | M | 22 | 2 | I | | | 161 | PVR (#25 EPIC), PFO Closure, Cryoablation On RA |
| 32 | M | 21 | 1 | I | | + | 74.4 | PVR (#25 EPIC), PFO Closure, Cryoablation On RA |
| M=male; F=female; AAo=ascending aorta; AF=arterial fibrillation; AFL=arterial flutter; ASD=atrial septal defect; AVR=aortic valve replacement; CEP=Carpentier-Edwards PERIMOUNT; ICR=intra-cardiac repair; NSVT=non sustained ventricular tachycardia; PA=pulmonary valve; PFO=patent foramen ovale; PM=pace maker; PVR=pulmonary valve replacement; RA=right atrium; RV=right ventricle; RVEDVI=right ventricular end-diastolic volume index; RVOT=right ventricular outflow tract; TAP=tricuspid annuloplasty; TV=tricuspid valve; TVP=tricuspid valve plasty; VF=ventricle fibrilation; VT=ventricular tachycardia |
追跡期間5.4±4.2年(8か月~14年6か月)は,心内修復術(intracardiac repair: ICR)の平均年齢は3.3±3.8歳(3か月~18歳4か月)で,ICRからPVRの平均期間は29.0±10.3年(8~48年)であった.PVR前のNYHA分類はIが25例,IIが5例,IIIが2例であった.不整脈は心室頻拍(ventricular tachycardia: VT)が2例,心房細動(arterial fibrillation: Af)が2例,心房粗動(arterial flutter: AFL)が4例であった.25例にEPS施行を施行し,24例にcryoablationを行った.6例にPS合併症例を認めるが,全例Max-PG 20 mmHg以下の軽症の症例であった.
全例生体弁を選択し,人工弁はCarpentier-Edwards PERIMOUNTウシ心のう膜生体弁が18例,ST. JUDE MEDICAL EPIC生体弁が14例であった.人工弁は体格よりやや大きなサイズを選択し,必要に応じて肺動脈弁輪-右室流出路をpatchで拡大した.弁サイズの内訳は21 mmが1例,23 mmが9例,25 mmが22例であった.
PVR前後(PVR前,術後中期~遠隔期)の心電図,心エコー,カテーテル検査を比較して評価した.計測ソフトはCAAS Workstation 7.5を使用し,Simpson法を使用して計測した.
PVR術後中期~遠隔期の心臓超音波検査は平均3.82±3.89年(1週間~12年8か月)であった.人工弁機能不全は,中等症以上のPRまたは最大圧較差40 mmHg以上のPSとした.術後中期~遠隔期のカテーテル検査は19例に施行しており,平均2.4±2.2年(4か月~8年4か月)に行った.
結果は平均値±標準偏差で示した.統計処理は解析ソフトJMPを使用してt検定を用いた.危険率5%未満を有意差ありとした.
手術は基本的には心拍動下に行った.①遺残短絡,②併施手術,③末梢肺動脈の修復,④術中に循環動態が不安定になった症例に関しては心停止下に手術を行った.体外循環時間は221±97.1分(114~388分)であった.12例で心停止下に手術を行い,遮断時間は89±49.1分(9~158分)であった.
PVR術後周術期に死亡例はみられなかった.観察期間中に死亡例は2例で,1例は22q11.2欠失症候群(CAT CH)の染色体異常があり術後10年で尿路感染を契機に死亡,1例は他因死で術後46日に十二指腸潰瘍出血で死亡した.術後合併症として,1例に術後出血・心タンポナーデを認め再開胸止血術施行した.1例は術前から2度房室ブロックを認め,術後に高度房室ブロックになったためペースメーカ埋め込み術を施行した.1例に感染性心内膜炎を発症したが,保存加療で軽快した.20例に周術期の輸血を必要とした.
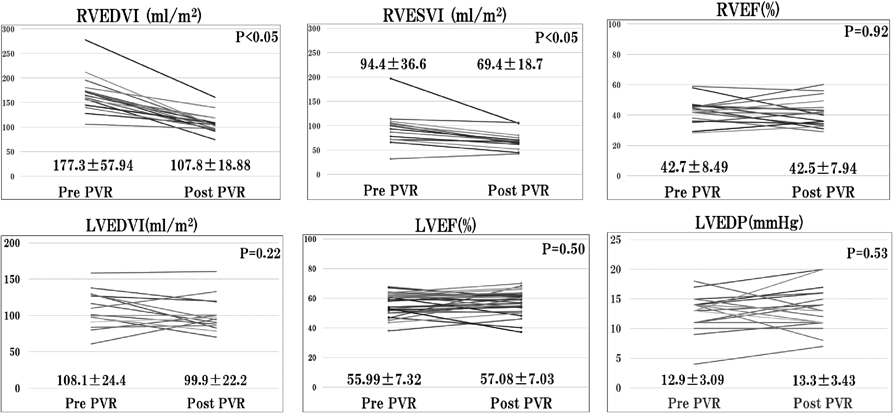
Fig. 1に心臓カテーテル検査の結果を示す.右心機能評価ではRVEDVIは術前177.3±57.94 mL/m2,術後107.8±18.88 mL/m2,RVESVIは術前94.4±36.63 mL/m2,術後69.4±18.7 mL/m2と有意に改善した(p<0.05).RVEFは術前42.7±8.49%,術後41.5±7.94と有意差はみられなかった(p=0.92).左心機能評価ではLVEDVI(left ventricular end-diastolic volume index)は術前108.1±24.4 mL/m2,術後99.9±22.2 mL/m2(p=0.22)と有意差はみられなかった.LVEF(left ventricular ejection fraction)は術前55.9±7.32 mL/m2,術後57.1±7.03 mL/m2と有意差はみられなかった(p=0.50).LVEDP(left ventricular end-diastolic pressure)は術前12.9±3.09 mmHg,術後13.3±3.43 mL/m2と有意差はみられなかった(p=0.53).
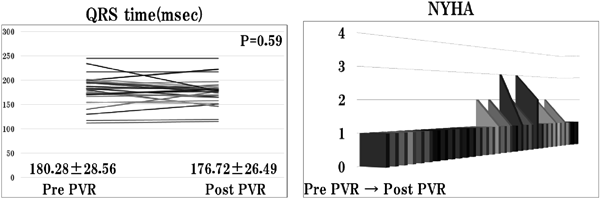
NYHA分類とQRS幅の結果を示す(Fig. 2).PVR前のNYHA分類はIが25例,IIが5例,IIIが2例であったが,術後中期のNYHA分類はIIIからIIに改善したのが1例,IIIからIに改善したのが1例,IIからIに改善したのが5例,残り25例は観察期間中を通じてNYHAIで経過した.QRS幅は術前180.3±28.6 msec,術後176.7 msec±26.5 msecと有意差はみられなかった(p=0.59).
RVEDVI>160 mL/m2(進行群)とRVEDVI≦160 mL/m2(早期群)の2群に分けて比較した(Fig. 3).進行群は10例,早期群は9例であった.進行群のRVEDVIは術前198.4±39.9 mL/m2,術後110.7±20.6 mL/m2,早期群は術前142.1±16.2 mL/m2,術後100.3±12.3 mL/m2と両群とも有意に改善した(p=0.05).進行群のRVEFは術前41.3±5.41,術後43.5±6.84,早期群は術前44.3±9.89%,術後41.3±11.3%と有意差はなかった.
進行群のLVEFは術前57.0±7.06%,術後56.3±8.92%,早期群は術前55.3±8.03%,術後58.5±4.95%と有意差はなかった(p=0.12).進行群のLVEDVIは術前114.2±29.6 mL/m2,術後97.5±27.4 mL/m2と有意差はなし(p=0.09),早期群は102.8±17.1 mL/m2,術後102.4±14.9 mL/m2と有意差はなかった.
進行群のLVEDP(left ventricular end-diastolic pressure)は術前14.0±2.14 mmHg,術後15.2±2.78 mmHg,早期群は術前11.4±3.57 mmHg,術後11.2±2.81 mmHgと術前・術後で有意な変化はみられなかったが,術後のLVEDPを2群で比較すると早期群より進行群が有意に高かった(p<0.05).
不整脈治療の概要と術後経過をTable 2に示す.術前EPSを施行した25例中17例に不整脈が誘発された.誘発例に関しては術中冷却凝固法(cryoablation)を行った.
Table 2 EPS Charactertics, mapping, and cryoablation date| No | EPS | Cryoablation | Arrhythmia related event |
|---|
| 1 | VT | RV | (—) |
| 2 | AFL, VT | RA Isthmus | (—) |
| 3 | (—) | (—) | (—) |
| 4 | (—) | (—) | (—) |
| 5 | AF, VT | RVOT and RA Isthmus | (—) |
| 6 | AF | RA MAZE | AT (drug medication, ablation) |
| 7 | NI | RVOT and RA Isthmus | (—) |
| 8 | VT, VF, AVNRT | IVC-TV Isthmus and RA Isthmus | (—) |
| 9 | (—) | (—) | (—) |
| 10 | (—) | (—) | (—) |
| 11 | (—) | (—) | (—) |
| 12 | AFL | RA MAZE and RA Isthmus | (—) |
| 13 | AFL | RA Isthmus | (—) |
| 14 | AFL | RA Isthmus | (—) |
| 15 | AFL, AF | RA MAZE, RA Isthmus | AT (drug medication) |
| 16 | (—) | RVOT | (—) |
| 17 | NI | (—) | (—) |
| 18 | IART | SVC-IVC, IVC-TV Isthumus | (—) |
| 19 | VT, AFL | IVC-TV Isthumus, RVOT | (—) |
| 20 | AF | RA MAZE | IART (drug medication, ablation) |
| 21 | AFL | IVC-TV Isthmus | (—) |
| 22 | AF,VT | RV | (—) |
| 23 | (—) | (—) | (—) |
| 24 | NI | IVC-TV Isthumus | (—) |
| 25 | NSVT | RV and RA Isthmus | (—) |
| 26 | AFL | RA Isthmus | (—) |
| 27 | NI | (—) | (—) |
| 28 | NI | RA Isthmus and RVOT | (—) |
| 29 | VT, VF | RA Isthmus and RVOT | (—) |
| 30 | NI | RA Isthmus | (—) |
| 31 | NI | RA Isthmus and TV-RA | (—) |
| 32 | NI | RA Isthmus | (—) |
| AF=atrial fibrilation; AFL=atrial flutter; AT=atrial tachycardia; AVNRT=atrioventricluar nodal reentrant tachycardia; IART=intaraatrial reentrant tachycardia; NI=not inducible; RA=right atrium; RV=right ventricle; RVOT=right ventricular outflow tract; TV=tricuspid valve; VF=ventricle fibrilation; VT=vntricular tachycardia |
部位の内訳は右心房解剖学的峡部(right atrial isthmus)が15例,右室壁が3例,右室流出路(right ventricular outflow tract: RVOT),right side MAZEが4例であった.3例が遠隔期に再発しており,2例が心房頻拍(atrial tachycardia: AT),1例が心房内リエントリー性頻拍(intaraatrial reentrant tachycardia: IART)であった.1例は薬物治療でコントロール可能であったが,2例は薬物コントロール不良にてradiofrequency ablationを追加し不整脈は消失している.
人工弁機能不全(Prosthetic valve failure: PVF)に至った症例はなく,観察期間中に再手術(re-PVR)を必要とした症例はなかった.1例に大動脈弁逆流,大動脈弁輪拡張を認めたため,PVR後3年でBentall手術を行った.
TOF心内修復術の手術成績上昇に伴い,術後遠隔期合併症による再手術症例が増加している.TOF術後遠隔期における問題点として,PRによる右室容量負荷,PS,右室流出路狭窄や肺動脈狭窄がある.RVEDVIやRVESVIが増大することで右心負荷となり,心筋の線維化が進行することで致死性不整脈やRVEF低下による右心不全の原因となり突然死の危険性がある8).
TOF術後遠隔期におけるPVRは安全かつ右心機能を改善させる5–7)と多数の文献で報告されている.PVRにおける弁の選択として,機械弁は出血の合併症が多く生体弁が推奨されているが6),生体弁は長期耐久性に問題がありre-PVRの可能性があるため,PVRの適切な時期は議論の余地がある.若年者の場合,カルシウム代謝や免疫反応により早期に石灰化や弁機能不全が生じることが報告されている9, 10).
Jangら10)は,Medtronic HancockII, Carpentier-Edwards PERIMOUNT(CEP), St Jude Medical(SJM)Biocorを比較して,CEPのPVFの発生頻度が多かったと報告している.しかしCEPの再手術率が少なくなったとの文献も報告されており11, 12),PVRにおける生体弁の選択は確立されていない.
当院では2003~2010年はCEP, 2011~2017年はSJM EPICを使用しているが,追跡期間5.43±4.15年(8か月~14年6か月)中に弁関連イベント発生率は0%であり,比較的長期間の安全性が期待できる可能性がある.
近年,海外では経皮的肺動脈弁置換術(Transcatheter Pulmonary Valve replacement: TPVR)が施行されるようになり,valve in valveを行った症例に関しても短期成績が良好であったとの報告もある13).当院では将来的にvalve in valveによるTPVRを行う可能性も考慮して,女性で23 mm,男性で25 mmと体格に見合ったサイズの生体弁を選択している.TOF術後遠隔期にPVRを施行した文献は20代後半が多く,我々の検討した症例は諸家の報告と比較して高齢かつICRからPVRまでの期間が長かった.
PVRの中期成績は良好であり生体弁を使用することから,今後PVR術後遠隔期にre-PVRを行う症例が増加してくることが予想される.症状が出現せず右室拡張や右心機能低下が進行しないtimingでPVRを行うことが重要であるが,患者が手術に踏み切れず症状が進行してから手術を行う症例も多々ある.当院でも,RVEDVIが200 mL/m2以上になってから紹介された症例が7例あった.
RVEDVI>160–170 mL/m2, RVESVI>80–90 mL/m2と右室拡張が進行した症例や有症状の場合,PVRを施行しても右室容量や右心機能が正常化しなかったとの報告もあり2–4),RVEDVI>160–170 mL/m2を基準にPVRに踏み切る適応としている文献が多くみられる.我々の検討では,PVR術後周術期死亡率は0%であり,追跡期間5.43±4.15年(8か月~14年6か月)の生存率は93.8%と良好な成績であった.周術期の重篤な合併症もみられず,諸家の文献同様に安全かつ有効な中期成績であり,手術適応範囲内はもちろん症状が進行した症例に関しても手術を検討するのが望ましい.ただし,進行例に関しては右心機能が不可逆性な変化をきたしPVRが無効であったケースも報告されており,手術適応に関しては注意深く検討する必要がある.
心臓カテーテル検査ではPVR後にRVEDVIは有意に改善したものの,RVEFの有意な改善はみられなかった.RVEFが改善しなかった原因として,RVEDVIと比較してRVESVIの改善が乏しかったこと,術後中期のカテーテル検査で比較しており時期が一定ではなかったことが影響していると考えられる.またPVR時の平均年齢が32.3±11.3歳(13~60歳),ICRからPVRまでの期間が29.0±10.3年(8~48年)と諸家の文献と比較して,高齢かつICR後の期間が長かったことから,右室の線維化が進行していた可能性も考えられる.
Davlourosら14)によると,TOF術後の成人85例を対象にMRIで左室と右室の動きを解析したところ,左室の収縮機能不全と右室機能不全と相関関係があると述べている.右室拡張による心室中隔の圧排が解除されることで左室の拡張が要因と考察されている.またFrigiolaら15, 16)によると,PRが消失することで肺血流が増加し,LVEDVが充填することで左室の収縮能も改善すると報告している.しかし,RVEDVIが進行した症例に対するPVRが左室収縮能を改善させるかは明らかではない.
RVEDVIが進行した症例では右心機能や右室容量が改善はするものの正常化はしなかったとも報告されており2–4),RVEDVI≧160 mL/m2を目安に手術を行っている施設が多く当院でも1つの指標としている5–7).左心機能に関してもRVEDVIが一定の水準を超えると左心機能が改善しない可能性を検証するため,当院の手術指標の1つであるRVEDVI 160 mL/m2を基準に進行群と早期群の2群に分けて検証した.RVEDVIは両群ともに有意な改善がみられた.RVEFに関しては両群とも有意差な改善はみられなかった.右心機能に関しては早期群と進行群での有意差はなかったが,進行群の10例中4例はRVEDVIが正常化しない結果となった.左心機能に関しては,LVEF, LVEDVIは進行群と早期群で有意差はなかった.LVEDPに関しては進行群と早期群で術前・術後の有意な変化はみられなかったが,進行群と早期群の術後のLVEDPを比較すると,進行群が有意に高い結果となった.術前に関しては右室拡張によるRV-LV interactionにより左室拡張能に影響が推測される.PVR術後に右室拡大が改善されても進行群のLVEDPが高い結果を考慮すると,RVEDVIが進行するとPVRを行っても左室拡張能が改善されない可能性が考えられる.
また軽症ではあるもののPS合併症例が6例あり,pure PRのみの検証ではないことはstudy limitationであり今後の課題である.
より早期のPVRを推奨する報告もみられるが14),早期劣化が多くPVFによるre-PVRが多い.生涯におけるre-PVRの回数を減らすこと,右心機能はもちろん左心機能低下をきたさず両心機能維持を目指すことを踏まえる必要がある.上記を考慮すると右室容積の正常化,左室拡張能の維持の観点から,RVEDV 160 mL/m2が手術時期として妥当と考えられる.
不整脈治療に関しては,TOF術後患者におけるPVRがVT減少効果を望めるとの報告7)や,EPSに基づくカテーテルアブレーション,不整脈治療の有効性が報告されている17, 18).当施設でも準緊急手術を除き,術前不整脈の有無にかかわらず原則術前EPSを行っており,術中cryoablationを併施することで良好な中期成績を得られた.右心房解剖学的峡部や三尖弁輪,心房切開線を中心としたAFLのマクロリエントリーが多く確認され,cryoablationによって術後不整脈発生が抑制された.
PRによる右心不全は進行しても無症状で経過することが多く,依然不整脈出現や有症状になってから手術を行う症例も少なくない状況である.非可逆的な心機能低下をきたす前に,術前検査を行ってPVRを検討する必要があり,TOF術後長期にわたるfollow upと定期的に心臓超音波検査,心電図などの非侵襲的検査を行い,必要に応じてMRI,心臓カテーテルなどの精密検査に進むことが重要と考える.