2014年4月以降,われわれが診療を行い6か月以上の経過観察を行った患者12名を対象とした.いずれも4週以上の内科治療で効果が限定的であったために外科治療を要した患児である.日齢30日~2歳(平均月齢9か月,中央値8か月),男女比6 : 6,うち5名は心疾患以外の基礎疾患があった(21 trisomy 3名,難治性水頭症1名,Noonan症候群1名).単心室,極型Fallot四徴症,Ebstein奇形などの重症先天性心疾患が多く含まれている(Table 1).リンパ流の検査・治療として主にリンパ管造影法(インドシアニングリーン(ICG),リピオドール®(LG)),リンパ管静脈吻合術(LVA)を施行した.治療法の選択として右左シャントがない場合にリピオドールリンパ管造影法を行い,右左シャントを有する場合や先天性を疑う場合・浮腫を伴う症例にはリンパ管静脈吻合術を適応とした(Fig. 1).手術は全例,全身麻酔下に行った(Total IntraVenous Anesthesia: TIVA).ICG, LG, LVAはいずれも当院倫理委員会で認可を得て施行した.
Table 1 Patient list| No | Age (month-old) | Sex | Weight at lymph surgery (g) | Diagnosis | Cardiac anomaly | Other Comorbidities | Previous Cardiac/Vascular surgery | Treatment | Post-op course | Outcome |
|---|
| 1 | 1 | Male | 2.8 | CT | Single ventricle | | PA banding | LVA | PR | Death due to respiratory distress |
| | | | | Vertical vein stenosis | | Vein stent | | | 3 months post-surgery |
| | | | | AVSD | | | | | |
| 2 | 1 | Female | 0.86 | CT | | ELBWI (518 g), hydrocephalus | | LG | CR | Hospitalization due to hydrocephalus |
| 3 | 1 | Male | 2.9 | CTA | TAPVR | | PA banding | LG | PR | |
| | | | | AVSD | | | | | |
| 4 | 2 | Female | 2.5 | CT | | | | LVA | CR | |
| 5 | 4 | Female | 3.3 | CT | | | | LVA | CR | |
| 6 | 6 | Female | 4.6 | CTA | TOF | 21 trisomy | | LVA | PR | Death due to sepsis |
| | | | | | | | | | 1 year post-surgery |
| 7 | 11 | Female | 3.5 | CT, PLE | | Noonan synd. | | LVA | PR | |
| 8 | 12 | Male | 3.3 | CTA | Ebstein, TAPVR | 21 trisomy | Starnes | LVA | PR | Death due to respiratory distress |
| | | | | | | | | | 1 year post-surgery |
| 9 | 13 | Male | 3.8 | CA, PLE | TAPVRASD | | ASD direct closure | LVA | NR | Death due to respiratory distress |
| | | | | | | | | | 2 months post-surgery |
| 10 | 14 | Female | 5.2 | CT | TOF | 21 trisomy | B-T shunt | LVA | NR | Death due to sepsis |
| | | | | | | | | | 8 months post-surgery |
| 11 | 15 | Male | 7.3 | CTA | | Lymphang iomatosis | | LG | PR | |
| 12 | 30 | Male | 10 | CT | Aortic stenosis | | Aortic plasty | LG | CR | |
| Case result in death were more likely on patients with refractory chylothorax due to congenital severe heart diseases. We perform surgical treatment only in cases with medical treatments at least 1 month did not cure the chyle leakage. CT: chylothorax, CTA: chylothorax and abdomen, CA: chyloabdomen, PLE: protein loosing enteropathy. AVSD: atrioventricular septal defect, TAPVR: total anomalous pulmonary venous return, TOF: tetralogy of Fallot, PA: pulmonary artery, ELBWI: extremely low body weight infant. LVA: Lymphatic venous anastomosis, LG: Lymhangiography with Lipiodol. PR: partial response, CR: complete response, NR: no response. |
インドシアニングリーン蛍光造影法
ジアグノグリーン®・注射用液25 mg(第一三共,日本)を付属の溶液または5%ブドウ糖液10 mLで希釈し,足背,手背に各1箇所ずつ,0.05 mLを皮下注射する.注射後,赤外線カメラを用いて体表をくまなく観察する.線状のリンパ流が確認できた部位やリンパ節を示す鼠径部の円形集積部には,それぞれの直上である体表に油性ペンで印をつける.
リピオドールリンパ管造影法
片側または両側の鼠径リンパ節をエコーガイド下または皮膚切開を加えたのち直視下に,27G注射針で穿刺する.リピオドール480注10 mL®(富士製薬工業株式会社,日本)をきわめてゆっくりと徒手的に注入し,透視下に先進部を確認する.特に小さな患児の場合,顕微鏡も用いた拡大視野下で操作する.0.2 mL程度を注入し可及的に胸管本幹が描出されたところで注入を終了する.前述した通り,右左シャントを有する症例では脳梗塞の危険性が報告されているためエコー検査で確認したのち適応外とした(Fig. 1).
リンパ管静脈吻合術
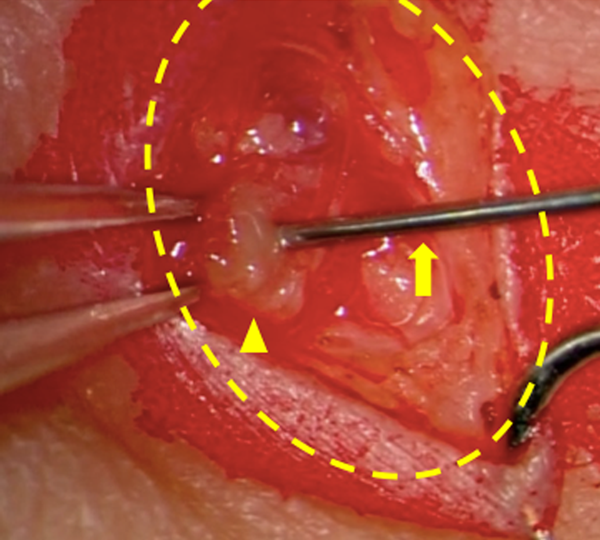
ICGで描出されたリンパ経路のうち,大伏在静脈近傍で近接した部位を術野とする.20万倍ボスミンを加えた0.5%リドカイン液を0.1 mL程度皮下注射することで局所麻酔を行い,1~2 cmの皮膚切開を加える.顕微鏡下に慎重な皮下組織の剥離を行い,集合リンパ管と静脈を露出させる.11-0または12-0ナイロンを用い,2~6針程度縫合し吻合する.吻合部の開通を確認し,皮膚を5-0 PDSで縫合閉鎖する.
乳び胸腹水の発生原因としては以下の3つの病態が考えられている.実際にはこれらの病態が複雑に関与しあうために難治化することも少なくない.治療方針は施設と担当医,患者の状態により異なるが,内科治療が奏功することもあるため,保存加療を行った上で治癒しない場合に外科治療を行う2).発症後早期より,絶食(またはMCTミルク,または脂肪制限食)に加えオクトレオチド,ステロイド,フィブロガミンを段階的に投与する3, 4).われわれは1か月の保存加療で漏出が止まらなければ外科治療を考慮しているが,病態を把握するためにリンパ流の検査は内科治療と並行して行っている.また臨床所見のバリエーションとして,体表浮腫や蛋白漏出性胃腸症,心嚢液貯留などの症状を呈することもある5, 6).
外傷性リンパ管(胸管)損傷
医原性または外傷性に発症する.胸部外科術後に発症することもあり,診断は比較的早期につくことが多い7).保存的に止まることもあるが,長期化することも少なくない8).リピオドールリンパ管造影法のよい適応である.
先天性乳び胸腹水
先天性のリンパ管未熟性または異形成された流路が関与していると考えられる.リンパ管奇形(リンパ管腫)が腹腔・胸腔内に併発していることも少なくない.胎児期より胎児水腫などとともに指摘されていることもあるが,出生後しばらくしてから発症することもある9).
静脈うっ滞に伴う胸腹水
特にFontan手術やGlenn手術のように術後に静脈圧が上昇する場合や総肺静脈還流異常症(TAPVR)で肺静脈狭窄を呈する場合などに考慮される10).循環動態を考えると静脈圧を低下させることが現実的には不可能で,胸腹水の治療にも難渋することがある.そのほか長期間の中心静脈カテーテル留置に伴う石灰化や静脈血栓が原因となることもある.
検査法
形態学的な評価としてMRIやCTを行うほか,リンパ流の評価としてリンパ管造影検査(シンチグラフィー,インドシアニングリーン蛍光造影法,造影剤を用いたリンパ管造影)がある.
リンパ管シンチグラフィーは分解能が低く近年使用頻度は減少しつつある.SPECT-CTも深部リンパ管評価目的に成人で使用されることが増えてきたが11),放射能被曝の問題や後述するMRIなどに比べると感度が劣るため頻用されてはいない.
ICGは手技が容易であり,即時に観察可能なこと,放射線暴露がないこと,ピンポイントでリンパ流路がわかること,体表への逆流がわかる点がよい.注入後1週間程度は皮下注射なく追加観察が可能であり,特に小児・新生児での有用性は高い(Fig. 2).ドレーン排液の観察で深部情報を得ることは可能だが,胸腹水の治療にあたっては他の検査法をしばしば併用する.
リンパ管造影検査はリンパ管システム内に直接造影剤などを注入する方法で,直接造影法と呼ばれる.成人の足背リンパ管へ直接穿刺する方法が従来から行われてきた12, 13).小児における同法は特に困難であったが,鼠径リンパ節の直接穿刺で中枢リンパ流が評価可能となった(Fig. 3).ただし手技に多少の習熟を要するほか,小児例では全身麻酔下陽圧換気で行うために胸腔内におけるリンパ管本幹の描出が悪いこともある14).近年MRIを用いたDynamic MR Lymphangiographyにより動的評価が可能となり,さらに詳細な病態把握が可能となってきた15–17).先天性乳び胸水として診断されてきたもののなかに,漏出部位やパターンが異なることが報告され,診断的価値が高い18).
治療法
下肢からのリンパ流は腹部乳び槽,胸管を通り静脈角へ注ぐ.中枢リンパ流に障害をきたすとリンパ漏が起こり胸水,腹水,心嚢液,蛋白漏出性胃腸症,乳び尿,浮腫など各症状をきたす.各々の病態に対して外科的治療があるが,しばしば複合療法を要する.
貯留した胸腹水に対する治療として胸腔・腹腔ドレナージや胸腔–腹腔シャント作成術19),漏出部位へのアプローチとして胸膜癒着術,胸管結紮術などが行われてきた.リンパ外科としての特徴的な方法にLG20),LVAがある(Fig. 4).
LGはリンパ管を通じて粘性の高い造影剤が胸腔内に流出する.直接的な塞栓または漏出部位で周囲組織に炎症反応を惹起することで,選択的な癒着術を起こすと考えられている.合併症としてリンパ浮腫の発症に注意が必要とされる.われわれはリンパ管造影に先行させてICGを併用する方法(ICG-LG)を頻用する20).LG後の下肢浮腫を早期診断するにあたり,追加の造影剤注入を必要とせず小児に適した方法と考えられる.またLGは右左シャントがある場合に脳血流へ造影剤が混入し脳梗塞を起こすことがあり21),当院ではシャントを有する患児は対象外としている.肺塞栓を起こす可能性は否定できないが,自験例における術後呼吸状態の悪化は見られなかった.静脈流入後はLGの追加注入をしないように注意している.
LVAはわれわれが好んで用いる,リンパ流再建の主要な方法である.主に成人の二次性リンパ浮腫に対して,本邦を中心に発展してきた22).小切開,浅層操作で完了し低侵襲であり,成人では局所麻酔で施行できる23).リンパ液は正常解剖でも静脈へ流れ込むため,比較的自然な再建法である24)(Fig. 5).機序として下肢から中枢リンパ路へ回収される経路を静脈へ逃すほか,体表へ逆流したリンパ液を静脈系へ回収すること,静脈系の止血因子を有した血液が少量リンパ路へ混ざることで漏出部に癒着を起こすこと,などが考えられる25).
本研究ではCR 33%,PR 50%,NR 17%と有効例は少なくないものの,軽快50%,入院継続加療8%,死亡例42%と経過中の死亡例が目立つ傾向にあった.全てLVA症例ではあったが,一方でLGの適応が外傷性を強く疑う状態や右左シャントを有しないなど比較的軽傷症例であったことは特筆すべきである.LVA術後の死亡例はTAPVRやTOFなどを有し静脈圧が高かった.病態として純粋な外傷性リンパ損傷や先天性乳び胸腹水だけでなく,静脈圧の影響が難治化させた可能性が疑われる.また半年以上に及ぶ術後経過中に胸腹水が止まりきらず低栄養が持続・悪化したことが,予後悪化の一因となったと考えられた.本研究では追加治療を行わなかったが,PRで追加治療可能な全身状態では考慮してもよいと考えられた.LGに対して有効性があれば再LG,有効性がない場合や初回からLVAを行った場合には再LVAが可能である.
われわれはこれまでの臨床研究から他のリンパ管疾患もリンパ浮腫と同様に,閉塞(狭窄)とそれに伴う逆流が重要なファクターであると考えている26).例えばリンパ管奇形(いわゆるリンパ管腫)は硬化療法や外科的切除で治療されてきたが,リンパの流れは治療にあたってあまり意識されてこなかった27).一方,ICG造影法を用いてそれぞれに適した吻合形態をとると,難治性とされるmicro cystic typeリンパ管奇形(小さい嚢胞が集簇したタイプ:いわゆる海綿状リンパ管腫)でも比較的良好にリンパ流が再建され,治療効果を期待できることが明らかとなってきた28, 29).胸腹水に対してもリンパ流評価をもとにした治療が有効なことがある.特に閉塞などを起点として大腿部皮下までリンパ液の逆流が見られる症例が良い適応と考えている.
胸腹水に対して近年注目される方法として,胸管塞栓術がある14, 17, 30, 31).胸管を造影したのち直接穿刺し,カテーテルを留置した上で塞栓物質(NBCAやコイルなど)を用いて漏出部または胸管本幹を内部から塞栓する方法である.米国のグループが比較的良好な治療成績を報告しているが,小児や心疾患があるケースでは成功率は成人に比べて低い32).また胸管本幹を塞栓した場合に行き場を失ったリンパ液が腸管や大腿部でうっ滞し,難治性の蛋白漏出性胃腸症や下肢浮腫をきたすことがあり,注意を要する.
胸腹水が完治した症例では,退院後数か月のうちに発育・発達は正常曲線内まで成長することが多い.一方で先天性のリンパ管拡張症を伴う場合,臨床上は胸水や浮腫が完治していても,のちに悪化し症状が顕在化することがある5).したがって当院では内科治療のみで軽快した症例に関してもリンパ専門外来での長期的なフォローアップをルーチン化し,適宜検査や治療を加えている.
リンパ管疾患は大きな変革期を迎えている.新たな技術が台頭し直接リンパ管に操作が加えられるようになったことで,詳細な診断や有効な治療法が開発されるようになってきた.他の脈管がそうであるようにリンパも流れを持った管である.リンパ液は透明で他の脈管に比べて流れは遅く,いわば“おとなしい”ために,これまであまり語られてこなかったのかもしれない.今後はリンパ管疾患も流れに着目し,これを改善することを旨とした外科治療が必要である.Flow Oriented Surgical Strategy(またはFlow Oriented Super-micro Surgery)=FOSS法は低侵襲にリンパ流を評価・再建する治療戦略である25).
われわれは循環器科,心臓血管外科,集中治療科,放射線科,外科,小児科,小児総合診療科,形成外科など多部門がそれぞれの専門性を活かしたチームアプローチで本疾患の治療にあたっている.症例数は未だ少なく,今後さらなる症例と知見の集積を行い,さらに確実な療法を開発する必要がある.
引用文献References
1) Hwang JH, Kim JH, Hwang JJ, et al: Pneumonectomy case in a newborn with congenital pulmonary lymphangiectasia. J Korean Med Sci 2014; 29: 609–613
2) Nadolski G, Crucitti P, Mangiameli G, et al: Nontraumatic chylothorax: Diagnostic algorithm and treatment options. Tech Vasc Interv Radiol 2016; 19: 286–290
3) Schild HH, Strassburg CP, Welz A, et al: Treatment options in patients with chylothorax. Dtsch Arztebl Int 2013; 110: 819–826
4) Lopez-Gutierrez JC, Tovar JA: Chylothorax and chylous ascites: Management and pitfalls. Semin Pediatr Surg 2014; 23: 298–302
5) 平野春人,守義 明,武内健一:Chylopericardiumから十数年後にchylothoraxとChylous ascitesをきたした1例.岩手県立病院医学会雑誌 2000; 40: 81–84
6) Rosa GM, Campisi C, Bioccardo F, et al: Chylopericardium: A case report demonstrating utility of lymphography combined with 3D computed tomography for corrective surgical treatment using VATS. Lymphology 2014; 47: 40–43
7) Pillay TG, Singh B: A review of traumatic chylothorax. Injury 2016; 47: 545–550
8) Choh CT, Rychlik IJ, McManus K, et al: Is early surgical management of chylothorax following oesophagectomy beneficial? Interact Cardiovasc Thorac Surg 2014; 19: 117–119
9) Scalzetti EM, Heitzman ER, Groskin SA, et al: Developmental lymphatic disorders of the thorax. Radiographics 1991; 11: 1069–1085
10) Dori Y, Keller MS, Rychik J, et al: Successful treatment of plastic bronchitis by selective lymphatic embolization in a Fontan patient. Pediatrics 2014; 134: e590–e595
11) Yang J, Codreanu I, Zhuang H: Minimal lymphatic leakage in an infant with chylothorax detected by lymphoscintigraphy SPECT/CT. Pediatrics 2014; 134: e606–e610
12) Kinmonth JB: Lymphangiography in man: A method of outlining lymphatic trunks at operation. Clin Sci 1952; 11: 13–20
13) Kinmonth JB: A review of some technical points. Lymphology 1977; 10: 102–106
14) Itkin M, Kucharczuk JC, Kwak A, et al: Nonoperative thoracic duct embolization for traumatic thoracic duct leak: Experience in 109 patients. J Thorac Cardiovasc Surg 2010; 139: 584–589, discussion, 589–590
15) Dori Y, Zviman MM, Itkin M: Dynamic contrast-enhanced MR lymphangiography: Feasibility study in swine. Radiology 2014; 273: 410–416
16) Chavhan GB, Amaral JG, Temple M, et al: MR Lymphangiography in children: Technique and potential applications. Radiographics 2017; 37: 1775–1790
17) Itkin M: Magnetic resonance lymphangiography and lymphatic embolization in the treatment of pulmonary complication of lymphatic malformation. Semin Intervent Radiol 2017; 34: 294–300
18) Itkin MG, McCormack FX, Dori Y: Diagnosis and treatment of lymphatic plastic bronchitis in adults using advanced lymphatic imaging and percutaneous embolization. Ann Am Thorac Soc 2016; 13: 1689–1696
19) Nowakowska D, Gaj Z, Grzesiak M, et al: Successful treatment of fetal bilateral primary chylothorax: Report of the two cases. Ginekol Pol 2014; 85: 708–712
20) Kato M, Nomura K, Ko Y, et al: The use of indocyanine green lymphography for the treatment of postoperative chylothorax with lipiodol lymphangiography in a 2-year-old child. J Pediatr Surg Case Rep 2017; 23: 46–49
21) Kirschen MP, Dori Y, Itkin M, et al: Cerebral lipiodol embolism after lymphatic embolization for plastic bronchitis. J Pedod 2016; 176: 200–203
22) 光嶋 勲,田代絢亮,加藤 基,ほか:リンパ浮腫に対する手術.臨床婦人科産科 2014; 68: 704–712
23) Kato M, Yamamoto T: Simple wire retractor for supermicrosurgical lymphaticovenular anastomosis. Microsurgery 2015; 35: 335–336
24) 加藤 基:リンパ浮腫の外科的治療.東京,ぱーそん書房,2017, pp 53–62
25) 加藤 基:小児リンパ管疾患とリンパ外科.医学のあゆみ 2017; 262: 1162–1166
26) Kato M, Watanabe S, Kato R, et al: Spontaneous regression of lymphangiomas in a single center over 34 years. PRS Global Open 2017; 5: e1501
27) Kato M, Watanabe S, Iida T, et al: Peri-orbital lymphangioma treated by lymphatic-venous anastomosis with indocyanine green lymphography analysis. J Pediatr Surg Case Rep 2017; 23: 9–14
28) Kato M, Watanabe S, Iida T: Diagnostic imaging for lymphatic disorders: Indocyanine green lymphangiography. Jpn J Ped Surg 2016; 48: 1270–1274
29) Kato M, Watanabe S, Iida T, et al: Venous anastomosis procedure for treatment of lymphatic malformation in Klippel–Trenaunay syndrome. J Pediatr Surg Case Rep 2017; 20: 1–3
30) Itkin M: Lymphatic intervention is a new frontier of IR. J Vasc Interv Radiol 2014; 25: 1404–1405
31) Nadolski GJ, Itkin M: Thoracic duct embolization for nontraumatic chylous effusion: Experience in 34 patients. Chest 2013; 143: 158–163
32) Dori Y, Keller MS, Rome JJ, et al: Percutaneous lymphatic embolization of abnormal pulmonary lymphatic flow as treatment of plastic bronchitis in patients with congenital heart disease. Circulation 2016; 133: 1160–1170