危険因子の検討
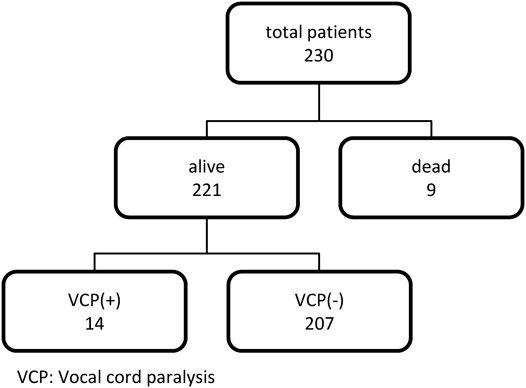
患者背景をFig. 1およびTable 1に示した.男女比は1.6 : 1,手術施行時の日齢は平均19.9±14.2,手術施行時の平均体重は2,616±845 g,平均手術時間は247±161分,平均術後挿管期間は9.6±11.7日であり,術後声帯麻痺は221症例中14例(6.3%)に認めた.人工心肺による開心術は101件(45.7%),胸骨正中切開は120件(54.3%)であった.P群とN群で2群間比較をすると,術後挿管期間が長いほど声帯麻痺の合併率は有意に高かった(P群;14.1±9.3日,N群;9.3±11.8日,p=0.008).性別,手術施行時の日齢,手術施行時の体重,開心術か否か,胸骨正中切開か側開胸か,手術時間,術前挿管の有無での比較では,2群間に有意差を認めなかった.
Table 1 Risk factors of vocal cord paralysis (Univariate Analysis)| Variable | Statistics | total (n=221) | Group P (n=14) | Group N (n=207) | p |
|---|
| Sex | Male | 136 | 8 | 128 | ns |
| Female | 85 | 6 | 79 |
| Age (days) | Mean (SD) | 19.9 (14.2) | 20.7 (15.1) | 19.8 (14.2) | ns* |
| Body weight at operation (g) | Mean (SD) | 2,616 (845) | 2,661 (897) | 2,614 (844) | ns* |
| Procedure with CPB | | 105 | 9 | 96 | ns |
| Median sternotomy | | 125 | 9 | 116 | ns |
| Operation time (min) | Mean (SD) | 247 (161) | 356 (223) | 232 (148) | ns* |
| Preoperative intubation | | 101 | 7 | 94 | ns |
| Postoperative intubation period (days) | Mean (SD) | 9.6 (11.7) | 14.1 (9.3) | 9.3 (11.8) | 0.008* |
| SD: standard deviation, ns: not significant, *Mann–Whitney U test |
疾患内訳をTable 2に示した.動脈管開存症が29例と最も多く,大血管転位症24例,大動脈縮窄複合23例,総肺静脈還流異常症22例,Fallot四徴症20例,単心室症17例,心室中隔欠損症16例,房室中隔欠損症13例,左心低形成症候群12例,両大血管右室起始症11例,純型肺動脈閉鎖症9例,大動脈離断症8例,三尖弁閉鎖症5例,総動脈幹症3例などが続いた.開心術では総肺静脈還流異常修復術が27件と最も多く,Jatene手術24件,Norwood手術13件,大動脈修復術13件,心室中隔欠損閉鎖術11件,Rastelli手術4件などが続いた.非開心術では動脈管結紮術とBlalock–Taussig(BT)シャント手術が51件と最も多く,肺動脈絞扼術32件,大動脈修復術14件(重複あり)が続いた.
Table 2 Diagnosis of underlying CHD| Diagnosis | | VCP (+) |
|---|
| Patent ductus arteriosus (PDA) | 29 | 2 |
| Transposition of the great arteries (TGA) | 24 | 2 |
| Complex coarctation of the aorta (CoA complex) | 23 | 4 |
| Total anomalous pulmonary venous connection (TAPVC) | 22 | |
| Tetralogy of fallot (TOF) | 20 | |
| Single ventricle (SV) | 17 | |
| Ventricular septal defect (VSD) | 16 | |
| Atrioventricular septal defect (AVSD) | 13 | |
| Hypoplastic left heart syndrome (HLHS) | 12 | |
| Double outlet right ventricle (DORV) | 11 | |
| Pulmonary atresia with intact ventricular septum (PA/IVS) | 9 | 1 |
| Interrupted aortic arch (IAA) | 8 | 3 |
| Tricuspid atresia (TA) | 5 | |
| Persistent truncus arteriosus (PTA) | 3 | 2 |
| Others | 9 | |
| total | 221 | 14 |
| CHD: Congenital heart disease, VCP: Vocal cord paralysis |
術式別では,BTシャント手術,動脈管結紮術,肺動脈絞扼術,大動脈修復術,総肺静脈還流異常修復術,Jatane手術,Norwood手術,Rastelli手術,心室中隔欠損閉鎖術,心房中隔欠損閉鎖術の10項目でP群,N群の2群間で比較検討した結果をTable 3に示す.検討を行った10項目のうち,大動脈修復術(p<0.0001, OR 32.48, 95%CI 8.39–125.78),Rastelli手術(p=0.006, OR 8.458, 95%CI 1.41–50.89),心室中隔欠損閉鎖術(p<0.0001, OR 8.00, 95%CI 2.57–24.85)の3項目で有意差を認めた.
Table 3 Operative procedure-related risk factors of vocal cord paralysis (Univariate Analysis)| Variable | Group P (n=14) | Group N (n=207) | p | OR | 95%CI |
|---|
| Blalock–Taussig shunt (BTS) | 1 | 50 | ns | | |
| Patent ductus arteriosus (PDA) ligation | 12 | 120 | ns | | |
| Pulmonary artery banding (PAB) | 0 | 38 | ns | | |
| Arch repair | 11 | 21 | <0.0001 | 32.48 | 8.39–125.78 |
| Total anomalous pulmonary venous connection (TAPVC) repair | 0 | 27 | ns | | |
| Jatene procedure | 2 | 23 | ns | | |
| Norwood procedure | 0 | 13 | ns | | |
| Rastelli procedure | 2 | 4 | 0.006 | 8.458 | 1.41–50.89 |
| Ventricular septal defect (VSD) closure | 7 | 23 | <0.0001 | 8.00 | 2.57–24.85 |
| Atrial septal defect (ASD) closure | 6 | 58 | ns | | |
| ns: not significant, OR: odds ratio, CI: Confidence interval |
単変量解析で2群間に有意差を認めた4項目(術後挿管期間,大動脈修復術,Rastelli手術,心室中隔欠損閉鎖術)で多変量解析を行った結果,大動脈修復術が唯一の独立した術後声帯麻痺の危険因子であった(p=0.0005, OR 76.57, 95%CI 6.62–885.25)(Table 4).
Table 4 Risk factors of vocal cord paralysis (Multivarariable Analysis) | p | OR | 95%CI |
|---|
| Postoperative intubation period (days) | ns | | |
| Arch repair | 0.0005 | 76.57 | 6.62–885.25 |
| Rastelli procedure | ns | | |
| Ventricular septal defect (VSD) closure | ns | | |
| ns: not significant, OR: odds ratio, CI: Confidence interval |
なお,未熟児動脈管開存症は,必然的に手術施行時の体重が小さくなることや,術前挿管症例が多くなることが予測され,解析結果に影響を及ぼす可能性があるため,未熟児動脈管開存症29例を除いた192例を対象としても,同様の検討を行った.未熟児動脈管開存症を除く術後声帯麻痺の合併は192症例中12例(6.3%)に認めた.術後声帯麻痺を合併した症例を-PP群,合併しなかった症例を-PN群とした.術後挿管期間が長いほど声帯麻痺の合併率は有意に高く(-PP群;14.1±9.3日,-PN群;9.1±11.6日,p=0.007),性別,手術施行時の日齢,手術施行時の体重,開心術か否か,胸骨正中切開か側開胸か,手術時間,術前挿管の有無での比較では有意差を認めなかった.(Table 5)術式別の検討においても,有意差を認めたのは大動脈修復術(p<0.0001, OR 83.29, 95%CI 10.23–678.14),Rastelli手術(p=0.005, OR 8.80, 95%CI 1.43–53.93),心室中隔欠損閉鎖術(p<0.0001, OR 9.56, 95%CI 2.80–32.64)であった.単変量解析で有意差を認めた4項目で多変量解析を行った結果,未熟児動脈管開存症も含めた場合と同様,大動脈修復術が唯一の独立した術後声帯麻痺の危険因子であった(p=0.0006, OR 73.47, 95%CI 6.38–846.45).
Table 5 Risk factors of vocal cord paralysis (Except for PDA in premature infants, Univariate Analysis)| Variable | Statistics | total (n=192) | Group-PP (n=12) | Group-PN (n=180) | p |
|---|
| Sex | Male | 124 | 7 | 117 | ns |
| Female | 68 | 5 | 63 |
| Age (days) | Mean (SD) | 19.3 (14.7) | 19.3 (15.2) | 19.3 (14.7) | ns* |
| Body weight at operation (g) | Mean (SD) | 2,839 (608) | 2,971 (459) | 2,830 (617) | ns* |
| Procedure with CPB | | 101 | 9 | 92 | ns |
| Median sternotomy | | 114 | 9 | 105 | ns |
| Operation time (min) | Mean (SD) | 264 (152) | 407 (199) | 255 (144) | ns* |
| Preoperative intubation | | 66 | 5 | 61 | ns |
| Postoperative intubation period (days) | Mean (SD) | 9.5 (11.6) | 14.1 (9.3) | 9.1 (11.6) | 0.007* |
| PDA: Patent ductus arteriosus, SD: standard deviation, ns: not significant, *Mann–Whitney U test |
続いて,多変量解析で有意に術後声帯麻痺が高いと考えられた大動脈修復術について,追加検討を行った.大動脈修復術を要した症例は32例であり,大動脈修復術後声帯麻痺を合併した症例をAP群,合併しなかった症例をAN群として分けたところ,AP群は11例,AN群は21例であった.新生児期に大動脈修復術を要する症例には,大きく①単純型大動脈縮窄症に対して大動脈修復術を施行する例,②大動脈縮窄複合や大動脈離断症に対して大動脈修復術に加え,肺動脈絞扼術などの姑息手術を施行する例,③大動脈縮窄複合や大動脈離断症に対して一期的修復術を施行する例に分けられる.今回①および②に該当する症例はいずれも非開心術および側開胸アプローチで,③に該当する症例はいずれも開心術および正中切開アプローチであった.Table 6に示す通り,開心術か否か,胸骨正中切開か側開胸かで,術後声帯麻痺の合併率に有意差を認めなかった.また,心室中隔欠損閉鎖術を伴うか否かにおいても,術後声帯麻痺の合併率に有意差を認めなかった.大動脈修復術の修復法は,32例中27例でExtended directanastomosis(EDA)法,5例でSubclavianflap(SCF)法が施行され,EDA法27例中11例に術後声帯麻痺を認めたが,SCF法5例には術後声帯麻痺を認めなかった.しかし,統計学的には修復方法による声帯麻痺の合併率に有意差はなかった(p=0.08).
Table 6 Risk factors of vocal cord paralysis post arch repair| Variable | total (n=32) | Group AP (n=11) | Group AN (n=21) | p |
|---|
| Procedure with CPB | 18 | 9 | 9 | ns |
| Median sternotomy | 18 | 9 | 9 | ns |
| Ventricular septal defect (VSD) closure | 13 | 7 | 6 | ns |
| ns: not significant |
声帯麻痺の臨床像
術後声帯麻痺を呈した14例をTable 7に示す.男女比は男児8例,女児6例とほぼ同等であった.疾患内訳は大動脈縮窄複合4例,大動脈弓離断症3例,大血管転位症2例,総動脈幹症2例,動脈管開存症2例,純型肺動脈閉鎖症1例であった.14例中11例で大動脈修復術を要した.また,Jatene手術2例,動脈管結紮術12例,BTシャント手術1例(重複あり)と,いずれも大血管の操作を要する手術であった.14例中1例は,11か月時に死亡(自宅で急変し,当院救急搬送時には心肺停止状態であり死因は不詳)したが,残りの13症例に関しては,現在も外来で経過観察中である.
Table 7 Clinical and postoperative data of patients with vocal cord paralysis| Case | Diagnosis | Sex | Age (Days) | Procedure | BW (g) | Preoperative intubation | Postoperative intubation periods (Days) | Paralyzed side | Difficulty swallowing | Stridor | Hoarseness | Intervention at discharge | F/U laryngoscope | Clinical prognosis |
|---|
| 1 | IAA VSD | M | 6 | arch repair, VSD closure, PDA ligation | 2,156 | (+) | 10 | Bil | ○ | ○ | | NG feeding NPPV | exacerbation | exacerbation (GT, Tracheostomy) |
| 2 | CoA VSD | F | 34 | arch repair, VSD closure, PDA ligation | 3,400 | (−) | 25 | Lt | ○ | | | NG feeding | no change | Improvement (5 m NG off) |
| 3 | TGA VSD CoA | M | 10 | Jatene, arch repair, VSD closure, PDA ligation | 3,224 | (−) | 10 | Lt | ○ | ○ | ○ | (−) | (−) | improvement |
| 4 | CoA VSD | M | 16 | arch repair | 3,100 | (−) | 4 | Lt | | | ○ | (−) | (−) | improvement |
| 5 | PTA IAA | M | 51 | Rastelli, arch repair, PDA ligation | 2,700 | (−) | 28 | Lt | ○ | | ○ | NG feeding | no change | 11 m dead |
| 6 | CoA VSD | M | 41 | arch repair, PDA ligation | 2,250 | (−) | 3 | Lt | | ○ | | NPPV | no change | improvement (8 m NPPV off) |
| 7 | CoA VSD | F | 20 | arch repair, VSD closure, PDA ligation | 2,760 | (+) | 11 | Lt | ○ | | ○ | NG feeding | (−) | improvement (4 m NG off) |
| 8 | TGA VSD CoA | F | 7 | Jatene, arch repair, VSD closure, PDA ligation | 3,470 | (−) | 17 | Lt | | | ○ | (−) | improvement | improvement |
| 9 | PTA IAA | M | 10 | Rastelli, arch repair, PDA ligation | 3,620 | (+) | 31 | Lt | | | ○ | (−) | no change | improvement |
| 10 | PA/IVS | F | 19 | RMBTS | 3,116 | (−) | 12 | Bil | ○ | | | (−) | improvement | improvement |
| 11 | IAA VSD | F | 6 | arch repair, VSD closure, PDA ligation | 3,100 | (−) | 12 | Lt | ○ | | ○ | NG feeding | no change | improvement (1y2 m NG off) |
| 12 | IAA VSD | M | 7 | arch repair, VSD closure, PDA ligation | 2,759 | (−) | 6 | Lt | ○ | | | (−) | (−) | improvement |
| 13 | PDA | M | 40 | PDA ligation | 1,000 | (+) | 61 | Lt | | ○ | | NPPV | (−) | improvement (6 m NPPV off) |
| 14 | PDA | F | 23 | PDA ligation | 604 | (+) | 82 | Lt | ○ | ○ | | NG feeding | no change | improvement (1y NG off) |
| GT: gastrostomy, NG: nasogastric tube, NPPV: noninvasive positive pressure ventilation, IAA: Interrupted aortic, VSD: Ventricular septal defect, CoA: Coarctation of the Aorta, TGA: Transposition of the great arteries, PTA: Persistent truncus arteriosus, PA/IVS: Pulmonary atresia with intact ventricular septum, PDA: Patent ductus arteriosus, RMBTS: Right sided modified Blalock–Taussig shunt |
再手術を要した症例を3例認めた.Case 1は大動脈離断症(IAA type B+perimembranous VSD+ASD+mild SAS)に対し,日齢6に一期的修復術を施行した.術後,左肺動脈狭窄症を合併したため,バルーン血管形成術を施行するも効果不十分であり,日齢50に肺動脈形成術を要した.Case2は大動脈縮窄複合(CoA+perimembranous VSD+SAS)に対し,日齢34に一期的修復術を施行した.術後,下行大動脈による左主気管支の圧排・閉塞を合併し,日齢36に大動脈吊り上げ術を要した.Case 10は純型肺動脈閉鎖症に対し,日齢19に右BTシャント手術を施行した.術後Lipo-PGE1を投与中止とするも,動脈管は閉鎖せず,肺血流増多が進行したため,日齢24に動脈管結紮術を要した.
手術施行時の平均日齢は20.7±15.1,平均体重は2,661±897 gであった.声帯麻痺の症状に関して,9例(64%)に嚥下障害を,5例(36%)に喘鳴を,7例(50%)に嗄声を認めた.声帯麻痺側は12例(86%)が左側麻痺,2例(14%)が両側麻痺であった.
術後嚥下障害を呈した9例のうち,1回哺乳量の調整や哺乳時の体位などを工夫することで経管栄養管理を要さず経口摂取のみで退院できたのは3例のみで,6例(Case 1, 2, 5, 7, 11, 14)で退院時経管栄養を要した(3例は経口併用,3例は全注入).ただし,経過中に死亡した1例(Case 5)を除いた5例のうち,4例はその後,経管栄養管理から離脱できた.離脱できなかったCase 1は,経過中徐々に嘔吐が頻回になり,その後の精査で食道機能麻痺の診断となり,2歳時に胃瘻造設術を施行し,現在も胃瘻管理となっている.経管栄養管理が離脱できたCase 2, 7, 11, 14では,経口摂取量を徐々に漸増し,それぞれ5か月,4か月,14か月,12か月時に経管栄養管理から離脱できた(Table 8).
Table 8 Rate of patients on various feeding regimens at discharge and at latest follow up | Hospital discharge status (n=14) | Latest follow up (n=13*) |
|---|
| Normal oral | 8 (57.1%) | 12 (92.3%) |
| Oral/GT or NG combination | 3 (21.4%) | 0 |
| All GT or NG | 3 (21.4%) | 1 (7.7%) |
| *One died, GT: gastrostomy, NG: nasogastric tube |
術後喘鳴を呈した5例のうち,2例(Case 3, 14)は退院時呼吸管理を要さず,3例(Case 1, 6, 13)で非侵襲的陽圧管理(NPPV)を要した.Case 1は喘鳴の改善がなく,3か月時に気管切開術が施行されたが,以降は呼吸器サポートを要さなかった.Case 6は8か月時に,Case 13は6か月時にNPPV管理から離脱できた.なお,Case 6は喉頭軟化症を合併していた.
術後,嗄声を呈した7例は,いずれも自然に改善した.
術後声帯麻痺を発症した14例のうち,退院時に経管栄養管理やNPPVなどによる呼吸管理など,何らかの治療介入を要した症例は8例(57%)であった.経過中死亡した1例を除いた7例のうち,6例で声帯麻痺症状の改善を認め,経管栄養管理やNPPV管理から離脱できた.フォローアップの喉頭鏡検査は,経過中死亡した症例(Case 5)も含め,9例(64%)で施行された.症状が増悪し,胃瘻造設および気管切開術を要した1例(Case 1)とCase 5を除いた7例は,全例声帯麻痺症状の改善を認めたが,7例中5例では声帯可動制限の残存を認めた.
声帯麻痺は嚥下障害や呼吸障害,嗄声など術後の経過に影響を与えうる.反回神経は迷走神経から分岐した後,右は鎖骨下動脈を,左は動脈管索の位置で後方を回って気管食道溝を上行し,輪状軟骨上縁に達する前に前枝と後枝に分かれる.声帯麻痺発生のメカニズムは様々あり,医原性麻痺の原因としては,手術操作による反回神経の直接障害の他,長期挿管による声帯の障害,経食道超音波検査による反回神経の障害などがある2).
成人領域の報告では,術後声帯麻痺の合併率は一般の手術で0.077%である3)が,心臓血管手術後では1.9~6.9%と高く4, 5),特に大血管手術でのリスクが高い6)とされる.その他にも長時間の手術6),長時間の体外循環7)などが術後声帯麻痺の危険因子として報告されている.心臓血管手術後の声帯麻痺に関して,小児領域においても過去に様々な報告が散見されるが,術後声帯麻痺の合併率は1.7~58.7%と報告によって大きく異なる2, 8).また,術後声帯麻痺の危険因子として,超低出生体重児9)などの報告がある.
新生児期に手術が必要となる疾患の代表として未熟児動脈管開存症がある.Rukholmら10)は111例の未熟児動脈管開存症を対象とした,動脈管結紮術後の左声帯麻痺について検討しており,左声帯麻痺の合併率は17.1%であったと報告している.
術式でまとまった報告として,Averin8)は63例を対象としたNorwood手術後の声帯麻痺に関して検討している.この検討では,声帯麻痺症状の有無にかかわらず術後全例に喉頭鏡検査を施行した結果,声帯麻痺の合併率は58.7%と高値であった.その一方で,実際に嚥下障害を呈したのは15.9%であったと報告している.今回の我々の検討とは異なり,Norwood手術に限定された検討ではあるが,術後半数以上の症例で声帯の可動制限を認め,声帯の可動制限を呈した症例のうち,約7割では声帯麻痺症状を呈していないことは非常に興味深い.Srinivasanら11)もNorwood手術後の検討ではあるが,ある時期を境に術後にルーチンで喉頭鏡検査を施行したことで,その前後で声帯麻痺の合併頻度は10%から45%に上昇したと報告している.今回の検討においても,術後声帯麻痺症状の改善を認めた症例のうち,少なくとも半数では麻痺の残存(声帯の可動制限)を認めており,過去の報告も考慮すると,実際に声帯の可動制限を認めていても,臨床症状が明らかでなく,声帯麻痺の存在を気がつかれていなかった症例は多く存在していた可能性が考えられる.
術後声帯麻痺の危険因子として,性別,手術施行時の日齢,手術施行時の体重,開心術か否か,胸骨正中切開か側開胸か,手術時間,術前挿管の有無,術後挿管期間,術式に関して検討を行った.単変量解析では術後挿管期間が長い症例で,術式別では大動脈修復術,Rastelli手術,心室中隔欠損閉鎖術施行例で,有意に声帯麻痺の合併率が高かった.サブグループ解析として,未熟児動脈管開存症を除いた対象でも検討を行ったが,同様の結果であった.ただし,心室中隔欠損閉鎖術に関しては,心室中隔欠損症単独での術後声帯麻痺症例はなく,いずれも大動脈縮窄複合や大動脈離断症において一期的修復術を施行した症例である.新生児期・乳児期早期に心室中隔欠損症単独で心内修復術を施行する症例は限られており,本検討における単変量解析では統計学的に有意差が生じたと考える.同様に,Rastelli手術単独で術後声帯麻痺を生じた症例はなく,いずれも大動脈修復術も要した症例であった.つまり,心室中隔欠損症閉鎖術やRastelli手術が術後声帯麻痺の危険因子になるとは言いがたく,そのことを支持するように,多変量解析では大動脈修復術が唯一の独立した危険因子あった.大動脈修復術施行例32例のみを対象としたサブグループ解析においても,より侵襲的な手技を要する開心術と,非開心術との比較で,声帯麻痺の合併に有意差を認めなかった.また,心室中隔欠損閉鎖術を併せて施行したか否かの比較でも,声帯麻痺の合併率に有意差を認めなかった.このことは,大動脈修復術が術後声帯麻痺合併の危険因子であることを示唆すると考える.
心臓血管手術後声帯麻痺の発生機序に関して,大動脈修復術が有意な危険因子であることは,手術操作による反回神経麻痺の直接障害が大きな要因であると考えられる.EDA法とSCF法とでは,統計学的に声帯麻痺合併率に有意差はなかった.ただし,本検討ではSCF法が施行されたのは大動脈修復術のうち16%のみで,術後声帯麻痺を合併した症例はすべてEDA法であった.このことより,より広範囲にわたる血管周囲組織の剥離操作と,術後声帯麻痺の合併とが関係している可能性が考えられる.
前述した未熟児動脈管開存症を対象とした,Rukholmら10)の報告では,低出生体重であることが左声帯麻痺の有意な危険因子であり,その他,在胎週数や手術施行時の修正週数・日齢・体重に関しては有意差を認めなかったと報告している.Zbarら9)は未熟児動脈管開存症を施行した68例について検討しており,超低出生体重児や,より在胎週数が早い児ほど声帯麻痺の合併率が高いと報告している.今回の検討では,成熟児・未熟児を問わず,生後2か月以内に手術を要した先天性心疾患全例を対象とし,手術施行時の体重および日齢に関しては,2群間に有意差を認めなかった.また,対象から未熟児動脈管開存症を除いたサブグループ解析においても,手術施行時の体重および日齢に関しては,2群間に有意差を認めなかった.このことは,成熟児においては,手術施行時の体重や日齢は,術後声帯麻痺の合併には寄与しないと考えられる.
小児の報告ではないが,Itagakiら6)は982例の成人を対象とした心臓血管手術後の声帯麻痺に関して検討し,手術手技を冠動脈バイパス手術,弁手術,大動脈手術に分けた際,大動脈手術で有意に声帯麻痺の合併率が高かったと報告している.今回は術式にかかわらず,生後2か月未満に手術介入を要した症例を対象とし,様々な危険因子を検討したが,声帯麻痺を呈した14例は,動脈管結紮術を含めると全例大動脈の操作を有しており,成人に限らず,新生児期・乳児期早期においても大動脈手術は術後声帯麻痺の危険因子であると考えられる.さらに大動脈修復術は,今回の検討において唯一の独立した術後声帯麻痺の危険因子であり,注意深い経過観察が必要である.
術後声帯麻痺の合併率や危険因子に関して述べてきたが,声帯麻痺の症状やその程度・予後に関しても,患児およびその家族の今後の日常生活の質を左右する要素となり,重要な事項である.喘鳴の程度が強く,呼吸障害を伴う症例に対してはNPPVなどの呼吸管理が必要となり,嚥下障害により十分な哺乳ができない場合は経鼻胃管などによる経管栄養管理が必要となる.嗄声に関しても,新生児期・乳児期早期に問題になることはないかもしれないが,将来的に構音障害につながる可能性も十分考えられ,重要な症状であると考える.
今回の検討では,臨床的に声帯麻痺が疑われ,喉頭鏡検査で声帯の可動制限を確認し診断確定となったのは14例であった.それぞれの臨床像は,嚥下障害を呈したのが9例(64%),喘鳴を呈したのが5例(36%),嗄声を呈したのが7例(50%)で,3症状とも呈したのは1例のみであった.
実際に声帯の可動制限を認めるも,麻痺症状を呈していない症例が存在することを考えると,声帯麻痺の臨床像は様々である.また,経管栄養管理や呼吸管理を要するか否かも症例によって様々であり,声帯麻痺の症状やその程度を予測することは非常に困難である.
予後に関しては,声帯麻痺を合併した14例のうち,経過中に死亡した1例を除いた13例中12例(92.3%)で経管栄養管理や呼吸管理が必要なくなっており,その改善率は非常に高かった.唯一改善しなかった症例(Case 1)は,嘔吐症状が遷延し,その後の精査で声帯麻痺の増悪所見ならびに食道機能麻痺を認め,最終的に気管切開術および胃瘻造設術を要した症例である.食道機能麻痺の原因として,心臓血管手術の影響は考えにくく,喉頭鏡検査での増悪した声帯麻痺所見を考慮すると,手術の影響ではなく,先天的な異常による可能性が高いと考える.
Truongら12)は,心臓血管手術後に声帯麻痺を呈した80例のうち,平均観察期間6.6か月(1.8~65か月)に麻痺の改善を認めたのは28例(35%)であり,特に在胎28週未満の早産児において回復率は16%と低いと報告している.その一方で,Khariwalaら13)は,心臓血管手術後に片側声帯麻痺を合併した11症例のうち,82%の症例で発症10か月以内に喉頭鏡検査で声帯可動の改善を確認できたと,非常に高い回復率を報告しており,術後声帯麻痺の合併率同様,声帯麻痺の回復率も様々である.そもそも,過去の報告において,心臓血管手術後の声帯麻痺合併率は過小評価されていることが多いと予想され,声帯麻痺の回復の定義を,「喉頭鏡検査による声帯可動の改善」とするか,「声帯の可動にかかわらず症状の改善」とするかでも,回復率は大きく変わる.今回の検討を踏まえると,仮に術後声帯麻痺を合併して何らかの治療介入を要した場合も,将来的には麻痺症状が改善して,経管栄養管理や呼吸管理から離脱できる可能性は高いと考えられる.その一方で,声帯の可動制限が残存しながらも,健側声帯が代償的に可動することで声帯麻痺症状の改善を認めている症例も多く存在することを忘れてはならない.
声帯麻痺症状を呈さない症例に対し,ルーチンで喉頭鏡検査を施行することに関しては,議論の分かれるところではあるが,「どのような症例に対して,どの時期に喉頭鏡を行い,評価を行うか」に関しては,今一度考える必要がある.少なくとも今回の結果を踏まえると,声帯麻痺症状を呈する症例以外にも,大動脈修復術を施行した症例や過去に声帯の可動制限を呈した症例に関しては,ルーチンで喉頭鏡検査を施行することで,より良い管理につながるかもしれない.今後,新生児期・乳児期早期に心臓血管手術を要した患児の,より良い術後管理を行うためには,さらなるデータの蓄積および,小児循環器科医,小児心臓血管外科医,耳鼻科医との連携も重要になってくる.
研究の限界
今回の検討では,声帯麻痺の定義を,“実際に”声帯麻痺症状を呈し,かつ喉頭鏡で声帯の可動制限を確認できた症例としたため,声帯麻痺の合併率を過小評価した可能性が高い.また,後方視的検討で,術後声帯麻痺を呈していた症例に関しては,その重症度については検討できていないほか,術前には麻痺がなかったかは確認できておらず,複数回手術を施行した症例に関しても,どの時点で麻痺を呈したかはわからなかった.術中経食道超音波検査施行の有無に関する検討もできていない.今後,疾患や術式ごとに分類した上で,全例ルーチンで喉頭鏡検査を行うことで,より正確な声帯麻痺の合併率や回復率,危険因子について検討できるかもしれない.