左心低形成症候群Hypoplastic Left Heart Syndrome(HLHS)に対する近年の手術成績向上は著しいものがある.しかしながら,生後すぐに低酸素血症や循環不全を呈し,治療介入を要するrestrictive ASD(atrial septal defect)症例やintact atrial septum(IAS)症例の予後は短期・長期ともに満足のいくものではない.HLHSにおいて肺うっ血を解除するためにBalloon Atrial Septostomy(BAS)を行うことは治療戦略の一つとして重要だが,HLHSでは,そもそも左房容積が小さいこと,形態学的な点では,ASDの大きさや開存位置,壁が厚いこともあり,Rashkind BASが困難なことも少なくない.今回我々は,当施設におけるHLHSに対するBASの現状について検討した.
当院におけるHLHSに対するBASの有効性を検討し,さらにcatheter BASを施行した群についてASD形態とBASの施行方法・効果について検討する.
対象患者
2006年1月から2015年12月までの10年間で,岡山大学病院でHLHSに対してカテーテル治療・手術を施行した患者について診療録を用いて後方視的に検討した.HLHSとは心房心室関係および心室大血管関係正常,心室中隔正常で,大動脈弁閉鎖(Aortic atresia: AA)または大動脈狭窄(Aortic stenosis: AS),および僧帽弁閉鎖(Mitral atresia: MA)または僧帽弁狭窄(Mitral stenosis: MS)を有し,左心室が低形成のものと定義し,同様の血行動態でも心室中隔欠損を有するものや両大血管右室起始症や大血管転位などの心室大血管関係不一致を伴うものなどのいわゆるHLHS variantsは除外した.
検討項目と方法
まずBASの有効性について検討した.対象患者を,心房間交通に対して介入した群と非介入群に分け,さらに介入した群については,開胸下でBASを施行したいわゆるopen BAS(IASに対するatrial septostomyも含む)を施行した群とcatheter BASを施行した群に分けて,非介入群,catheter BAS施行群,open BAS施行群の3群の比較を行った.検討項目は,各群のGlenn到達率,Glenn到達後の平均肺動脈圧,肺血管抵抗,pulmonary artery index(PAI)1)とした.
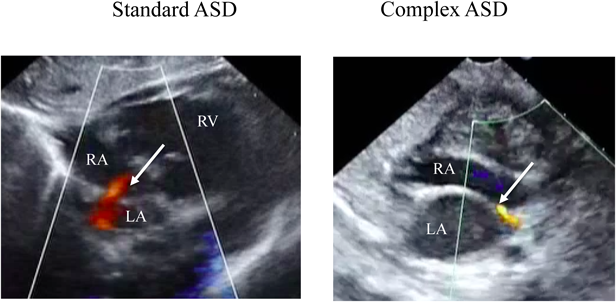
次にcatheter BASを施行した群について検討した.検討項目はASDの形態,BAS施行方法,BAS施行前後の経胸壁エコーによるASDのサイズ,カラードップラー法で算出されるASDを通過するpeak flow velocity(m/s),SpO2およびBASに伴う合併症とした.ASDについては,その形態学的特徴からHolzerらの報告2)に基づきstandard atrial anatomyとcomplex atrial anatomyに分類した.standard atrial anatomyとは,1)心房中隔の中央付近に開存している,2)心房中隔壁の肥厚がないもの,またcomplex atrial anatomyとは,1)心房中隔の中央に開存せず上方(肺静脈に近い),あるいは下方(房室結節に近い)に開存しているもの,2)心房中隔壁が厚いもの,と定義した(Fig. 1).
BAS施行方法に関しては当科では可能な限り初回からRashkind法の施行を考慮するが,手技的に困難な場合にStatic法を行うことを原則としている.
心エコー検査の計測はBAS直前と直後に行った.使用機器はPhilips IE33 system(Phillips Medical Systems, Andover, MA, USA)を用い,ASDの径,ASDの位置,カラードップラーを用いたASDでのpeak flow velocityを計測した.なお,計測は心窩部断面(subcostal view, frontal)で行った.
統計学的解析
統計には,群間の比較はMann–Whitney U testとカイ2条検定を,前後の比較はpaired t-testを使用した.いずれもp<0.05を統計学的有意差ありと判断した.
症例
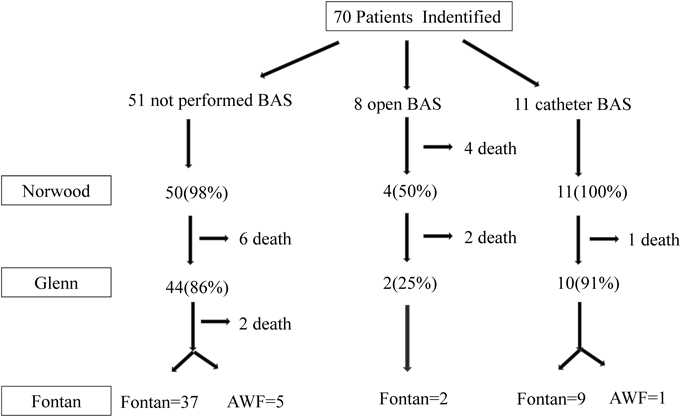
対象期間内に岡山大学病院で70例のHLHSに対して手術・カテーテル治療を施行した.Norwood手術前に心房間に介入した症例は19例,介入しなかった症例は51例だった.介入した19例のうちopen BASが8例(intact atrial septum 6症例,出生体重が2 kg未満の3症例,1例はintact atrial septumと2 kg未満の合併)でintact atrial septum 6症例に対してはatrial septostomyを施行し,他の2症例についてはバルーン拡張を施行した.catheter BASは11例だった(Fig. 2).
BAS有効性の検討(Glenn到達率・Glenn到達後の肺動脈圧・肺血管抵抗・pulmonary artery index(PAI)の比較)
全対象症例70例中のGlenn手術到達は57例(81%)であり(Fig. 3),Glenn手術到達月齢は7.0±2.6か月だった.BAS未施行症例は51例,catheter BAS症例は11例,open BAS症例は8例だった.3群の比較では,Glenn到達率は86%(44/51),91%(10/11),25%(2/8)で有意差を認めた(p=0.0002).各群の比較では,open BAS群とBAS未施行群(p=0.0008),open BASとcatheter BASで有意差を認め(p=0.0063),open BAS群ではGlenn到達率が有意に低かったが,BAS未施行群とcatheter BAS施行群では有意差を認めなかった(p=1.0).なお,open BAS群のうちBDGに到達できなかった6症例の内訳は,intact atrial septum4例,低出生体重児3例(1,650 g, 1,514 g, 1,100 g)(うち1例はintact atrial septumと低出生体重の合併)で,Bil PAB後死亡が4例,Norwood後死亡が2例だった.
Glenn手術後に失った1例を除く56例に対してカテーテル検査を行い,Glenn到達後の平均肺動脈圧,肺血管抵抗,PAIに関して検討した.全56症例のGlenn手術後カテーテル検査における平均肺動脈圧は11±2 mmHg,肺血管抵抗は1.7±1.0 Wood Unit(WU)・m2,PAIは216±62だった.BAS未施行群,catheter BAS施行群,open BAS施行群の平均肺動脈圧はそれぞれ11 mmHg, 11 mmHg, 12 mmHg(p=0.81),肺血管抵抗はそれぞれ1.6 WU・m2, 1.5 WU・m2, 1.5 WU・m2(p=0.7),PAIはそれぞれ204, 219, 237(p=0.76)で,3群間の比較で統計学的な有意差は認めなかった.
ASD形態別の比較
catheter BASを施行した症例の患者背景,BAS前後でのASD size, ASDにおけるpeak flow velocity(ASD flow),SpO2および前述したASDの形態的分類,BAS施行方法をTable 1に示す.なお,心房内に隔壁を認めたCor Triatriatumを合併した1例については狭窄部位が心房間交通のみではないため除外した.BAS施行時の患者背景は,日齢中央値3(0–50),平均体重2.9 kg(2.2–3.5),男8例/女2例であり,大動脈弁と僧帽弁から分類したsubtypeはMA/AA 6例,MS/AA 3例,MS/AS 1例であった.
Table 1 Clinical characteristic | Sex | Subtype | Age (days) | Weight (kg) | ASD type | BAS |
|---|
| 1 | f | MA/AA | 5 | 2.5 | standard | Rashkind |
| 2 | m | MS/AA | 10 | 3.4 | standard | Rashkind |
| 3 | m | MS/AA | 1 | 2.7 | standard | Rashkind |
| 4 | m | MA/AA | 41 | 2.2 | complex | Rashkind |
| 5 | m | MS/AS | 7 | 2.3 | standard | Rashkind |
| 6 | m | MA/AA | 1 | 3.5 | standard | Rashkind |
| 7 | m | MS/AA | 50 | 3.1 | complex | S→R |
| 9 | f | MA/AA | 1 | 2.5 | complex | S→R |
| 9 | m | MA/AA | 0 | 3.1 | complex | S→R |
| 10 | m | MA/AA | 0 | 3.5 | complex | S→R |
| AA=aortic atresia; AS=aortic stenosis; MA=mitral atresia; MS=mitral stenosis; S→R=Static→Rashkind |
また,10症例をBAS施行方法別に分けると,初回Rashkind BASを施行できたのが6例,Static BASを先行しその後Rashkind BASを施行したのが4例であった.
Rashkind BASには全例Miller Catheter(Edward-Baxter Healthcare Corporation, Irvine, CA, USA)を使用した.またStatic BASで用いた血管形成術用カテーテルのバルーンの平均サイズは7 mm(4–10 mm)であった.
BASの効果
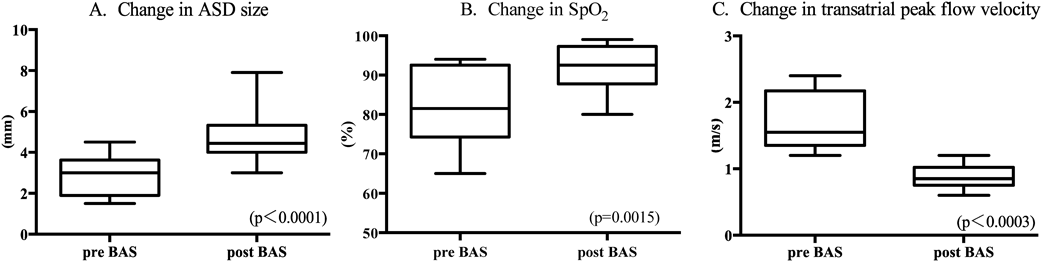
BAS前後でのASD sizeは平均3.2±1.1 mm→4.7±1.3 mm, peak flow velocity(ASD flow)は平均1.7±0.5 m/s→0.9±0.2 m/sに,SPO2は平均81±9%→92±6%に,いずれにおいても経胸壁心臓超音波検査におけるASDは有意に拡大し(p<0.0001),peak flow velocity(ASD flow)は有意に低下し(p<0.0003),SpO2は有意に上昇し(p=0.0015),全例有効なBASであった(Fig. 4).
ASD形態別比較
次にASD形態別で2群に分類し,各項目で2群間に有意差があるか比較検討した.前述したようにHolzerらの報告に従い10症例をASDの形態別に分けると,standard ASD 5例,complex ASD 5例であった.standard ASD群では,BAS前後でASD sizeは平均3.4±1.0 mm→5.3±1.5 mmに拡大し(p=0.0014),peak flow velocity(ASD flow)は1.6±0.4 m/s→0.8±0.2 m/sに軽減し(p=0.017),SpO2は83±8%→92±4%(p=0.001)に上昇した.complex ASD群では,BAS前後でASD sizeは平均2.4±0.7 mm→4.2±0.9 mmに拡大し(p=0.0011),peak flow velocity(ASD flow)は1.8±0.5 m/s→0.9±0.2 m/s(p=0.017)に軽減し,SpO2は81±12%→90± 8%(p=0.04)に上昇した.standard ASD群では初回Rashkind BASが可能であった症例は5例全例であり,一方complex ASD群では初回Rashkind BASが可能であった症例は5例中1症例のみで4症例はStatic BASを先行せざるをえなかった.ASD形態別での比較ではcomplex ASD群ではstandard ASD群と比較して有意に初回Rashkind BASが困難でありStatic BASを先行させていた(p=0.048).その他,BAS前後でのASD size, ASD flow, SpO2は2群間で統計学的有意差を認めなかった(Table 2).
Table 2 Comparison data between standard ASD group and complex ASD group | standard ASD group (N=5) | complex ASD group (N=5) | p-value |
|---|
| weight (kg) | 2.9 | 2.9 | >0.99 |
| pre ASD size(mm) | 3.4 | 2.4 | 0.071 |
| pre flow (m/s) | 1.6 | 1.8 | 0.44 |
| pre SPO2 (%) | 83 | 81 | 0.88 |
| Rashkind BAS | 5 | 1 | 0.048 |
| Static→Rashkind BAS | 0 | 4 | |
| post ASD size(mm) | 5.3 | 4.2 | 0.31 |
| post flow (m/s) | 0.8 | 0.9 | 0.47 |
| post SPO2 (%) | 93 | 90 | 0.76 |
合併症
合併症は全症例中2症例で認め,PSVT 1例,低酸素血症1例で,いずれも一過性に消退した.ASD形態別では,standard ASD群で2例であり,重篤な合併症は認めなかった.
HLHSは近年の周術期管理3)や手術法4)の改良などにより予後は著しく改善している.しかしながらintact/restrictive atrial septumを合併している場合,生後すぐに低酸素血症,アシドーシス,肺うっ血,肺血管抵抗上昇などにより,循環動態が極めて不安定となり依然として非合併症例に比べて悪い.HLHSにおけるintact septumの合併頻度は約6%,restrictive ASDは22%とも報告されており5),Hoqoeら6)の2003年から2010年までの141例のHLHSを生後72時間以内にカテーテルを施行した群と未施行群を比較した検討では,Norwood術後の退院率が80% vs 94%と統計学的にも有意差があることを報告している.一方で,Norwood施行後の生存症例についての検討では,長期生存率は2群間同等の結果と報告し,生後のatrial septostomyの成功の重要性について強調している.
HLHSにおけるintact/restrictive atrial septumが周術期やその後に与える因子として,左房圧の上昇が肺血管・リンパ系の構造異常をもたらし,予後規定因子となることが示唆されており,Canterら7)はHLHSにおけるrestrictive ASDの心移植前後の病理所見で,高圧の肺静脈所見と死亡リスクの相関を報告した.またGrazianoら8)はrestrictive ASDとnot restrictive ASDの肺動脈・リンパ組織の病理所見を比較し,restrictive ASD群で肺静脈の肥厚と,リンパ系の拡張の頻度が有意に高いことを示し,このことが周術期のリスクを高めると報告している.HLHSにおいて,intact/restrictive ASDに対する十分な心房間交通の確保が必要不可欠であり,intact/restrictive atrial septumに伴う早期の肺うっ血解除がNorwood到達だけでなく,長期生存に対して重要な因子となると考えられる.
当院でのHLHSに対する治療戦略は,初回手術は原則的にNorwood手術を行っており,低出生体重児,重度の三尖弁逆流,総肺静脈還流異常合併例などのいわゆるハイリスク症例ではlipoPGE1を投与して動脈管を開存させた上で両側肺動脈絞扼術を先行し,その後速やかにNorwood手術を行う方針としている.両側肺動脈絞扼術+動脈管ステント留置術のいわゆるhybrid procedure9–11)も含めたHLHSに対する新生児期の救命的第一期手術の目的は,狭窄のない体循環への流出路作製,適切な肺血流コントロールと狭窄のない心房間交通であるが,どの手術法を選択する場合でもintact/restrictive ASDは肺うっ血を惹起し予後不良因子となるため,我々は速やかにBASを行う方針とし,肺うっ血が改善され,高肺血流になった時点が適切な初回手術時期と考えている.当院では,1998年2月以降RV-PA shuntを用いたNorwood変法を施行しており,HLHS123例(classical HLHS; 95例,HLHS variants; 28例)でBVR施行した5例を除く118例のBDG到達・待機は91例(77%),Fontan到達・待機は83例(70%)であり,一定の成績を得ている12).
今回の対象患者における検討では,Norwood手術前に心房間について介入したのは70例のうちopen BAS 8例(11.4%),catheter BAS 11例(15.7%)で,合わせて19例(27%)だった.BAS施行群の中でもopen BASを施行せざるをえない患児(intact atrial septum症例や2 kg未満の低出生体重児)の治療成績が著しく悪いが,心房間交通が狭く,肺うっ血が存在してもcatheter BASが施行できた場合は,BASを要しなかった症例と同等の治療成績が得られることが示された.
Gossettら13)はASDに対してNorwood手術前に介入したHLHS症例のうちカテーテル治療介入を要したintact/restrictive ASD 30症例についてBDG到達率は43%,Fontan到達率は32%と報告し,うちIAS 7例についてはBDG到達3例(43%),Fontan到達2例(33%)であったと報告している.
Vlahosらの報告14)では,Norwood術前に心房間交通に対してinterventionを行ったintact/highly restrictive atrial septum 33症例について,Norwood手術到達率は38%で,生後1か月,6か月,12か月での生存率はそれぞれ52%, 42%, 34%であり,これはNorwood術前にinterventionを要さなかったコントロール群の91%, 79%, 72%に比べて有意に低い結果であったと報告している.一方で,intact/highly restrictive atrial septum群のGlenn後のカテーテル検査では,平均肺動脈圧は12.7±6.5 mmHg,平均肺血管抵抗は1.9±0.9 WUでコントロール群の平均肺動脈圧12.6±3.6 mmHg,平均肺血管抵抗1.9±1.0 WUであり,Glenn到達のコントロール群と統計学的な有意差は認めなかったと報告している.
今回の我々の検討でも,BAS未施行群と施行群の比較で,Glenn到達後のカテーテル検査結果では肺動脈圧,肺血管抵抗,PA indexいずれも同等の結果であった.また,restrictive ASD症例については,Norwood術前にcatheter interventionで心房間交通を確保できたことが,その後の生存率の維持に寄与し,Glenn到達率やGlenn後のカテーテル結果がBAS未施行群と同等の成果を得られているのだと考えている.
胎児期・新生児期のintact/restrictive atrial septumへの介入の成功は,長期予後の改善の可能性を示唆しているが,HLHSの心房中隔の形態によっては手技方法が限定されることも少なくない.我々の結果では,catheter BASの施行方法についてはRashkind BAS施行の前にStatic BASを先行しなければならない症例が11例中4症例(36%)に認めた.Cortiatriatum合併症例を除く10症例のASD形態をcomplex ASD, standard ASDに分類すると,standard ASDは10症例中5例(50%),complex ASDは5例(50%)であり,Holzerら2)が報告したstandard ASD67例中39例(58%),complex ASD 28例(42%)と類似した割合であった.今回の検討ではcomplex ASDに対しては初回のRashkind BASは困難な例が5例中4例(80%)と多かったが,Static BASを先行させることでRashkind BASを行うことができ,4例全例がFontan到達あるいは待機の状態であり,結果的に安全にかつ十分な心房間交通を得ることが可能であった.
近年著しく進歩している胎児治療に関してVidaら15)は胎児期にintact/highly atrial septumに対して施行した症例の6か月生存率は64%と報告している.この中で,新生児期を生存できた症例は,Glenn前およびTCPC前の肺動脈圧・肺血管抵抗がcontrol群と同等であり,胎児期の治療介入が,肺血管や肺組織の発育を促し,短期・長期予後の改善の可能性を示唆している.
BAS方法については施設によりdeviceの選択は様々だが,Atzら16)は,HLHSのrestrictive ASDに対してBrockenbrough atrial septostomy(stent留置を含む)を施行した16症例についてまとめ,SpO2は50%→83%に上昇し,平均心房間圧較差は16 mmHg→1 mmHgに低下した有効な結果を報告している.Hoqueら6)は,11例にRadio Frequency(RF)wireを用いた合計20例のatrial septostomyについて報告し,左房圧が21 mmHg→11 mmHgに,その後Static BAS, Rashkind BAS, stent implantationを行い,カテーテル治療前後で平均心房間圧較差が17 mmHg→4 mmHgに低下し,SaO2が72%→85%に優位に改善したと報告している.
今回の我々の検討ではRF wireは2014年に国内で認可されているものの,時間があまり経過していないこともありRF wireを使用した症例はなかったが,治療手技の選択肢が増えたことは喜ばしいことであり,その活用法に関しての検討は今後の課題である.
HLHSの狭小化した心房中隔に対する予後は不良とされるが,catheter BASを施行した群の予後は良好で,Glenn後のカテーテルデータでもBAS未施行群と有意差は認めなかった.またcatheter BASを2群に分けて検討すると,complex ASDの場合には初回Rashkind BASは困難だが,Static BASを先行することにより,心房内へのアプローチが容易となりRashkind BASを追加することで,standard ASD群と同等の効果を得ることができた.
利益相反
本論文に関し,開示すべき利益相反はありません.
引用文献References
1) Nakata S, Imai Y, Takanashi Y, et al: A new method for the quantitative standardization of cross-sectional areas of the pulmonary arteries in congenital heart diseases with decreased pulmonary blood flow. J Thorac Cardiovasc Surg 1984; 88: 610–619
2) Holzer RJ, Wood A, Chisolm JL, et al: Atrial septal interventions in patients with hypoplastic left heart syndrome. Catheter Cardiovasc Interv 2008; 72: 696–704
3) Baba K, Ohtsuki S, Morishima T, et al: Preoperative management for tricuspid regurgitation in hypoplastic left heart syndrome. Pediatr Int 2009; 51: 399–404
4) Sano S, Ishino K, Ohtsuki S, et al: Right ventricle-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2003; 126: 504–510, discussion, 509–510
5) Rychik J, Rome JJ, Collons MH, et al: The hypoplastic left heart syndrome with intact atrial septum: Atrial morphology, pulmonary vascular histopathology and outcome. J Am Coll Cardiol 1999; 34: 554–560
6) Hoque T, Richmond M, Vincent JA, et al: Current outcomes of hypoplastic left heart syndrome with restrictive atrial septum: A single-center experience. Pediatr Cardiol 2013; 34: 1181–1189
7) Canter CE, Moorehead S, Huddleston CB, et al: Restrictive atrial septal communication as a determinant of outcome of cardiac transplantation for hypoplastic left heart syndrome. Circulation 1993; 88: 456–460
8) Graziano JN, Heidelberger KP, Ensing GJ, et al: The influence of a restrictive atrial septal defect on pulmonary vascular morphology in patients with hypoplastic left heart syndrome. Pediatr Cardiol 2002; 23: 146–151
9) Baba K, Chaturvedi R, Benson LN, et al: Fate of the ductal stent after hybrid palliation for hypoplastic left heart syndrome. Ann Thorac Surg 2013; 95: 1660–1664
10) Baba K, Honjo O, Benson LN, et al: “Reverse Blalock-Taussig shunt”: Application in single ventricle hybrid palliation. J Thorac Cardiovasc Surg 2013; 146: 352–357
11) Baba K, Kotani Y, Honjo O, et al: Hybrid versus Norwood strategies for single-vantricle palliation. Circulation 2012; 126 (Suppl 1): S123–S131
12) Kasahara S, Ohtsuki S, Sano S, et al: Treatment strategy toward Fontan complection in hypoplastic left heart syndrome. Ped Cardiol Card Surg 2013; 29 (Suppl): 5160
13) Gossett JG, Rocchini AP, Lloyd TR, et al: Catheter-based decompression of thelLeft atrium in patients with hypoplastic left heart syndrome and restrictive atrial septum is safe and effective. Cathet Cardiovasc Intervent 2006; 67: 619–624
14) Vlahos AP, Lock JE, McElhinney DB, et al: Hypo- plastic left heart syndrome with intact or highly restrictive atrial septum: Outcome after neonatal transcatheter atrial septostomy. Circulation 2004; 109: 2326–2330
15) Vida VL, Bacha EA, Larrazabal A, et al: Hypoplastic left heart syndrome with intact or highly restrictive atrial septum: Surgical experience from a single center. Ann Thorac Surg 2007; 84: 581–586
16) Atz AM, Feinstein JA, Jonas RA, et al: Preoperative management of pulmonary venous hypertension in hypoplastic left heart syndrome with restrictive atrial septal defect. Am J Cardiol 1999; 83: 1224–1228