症例
13歳,女児
現病歴
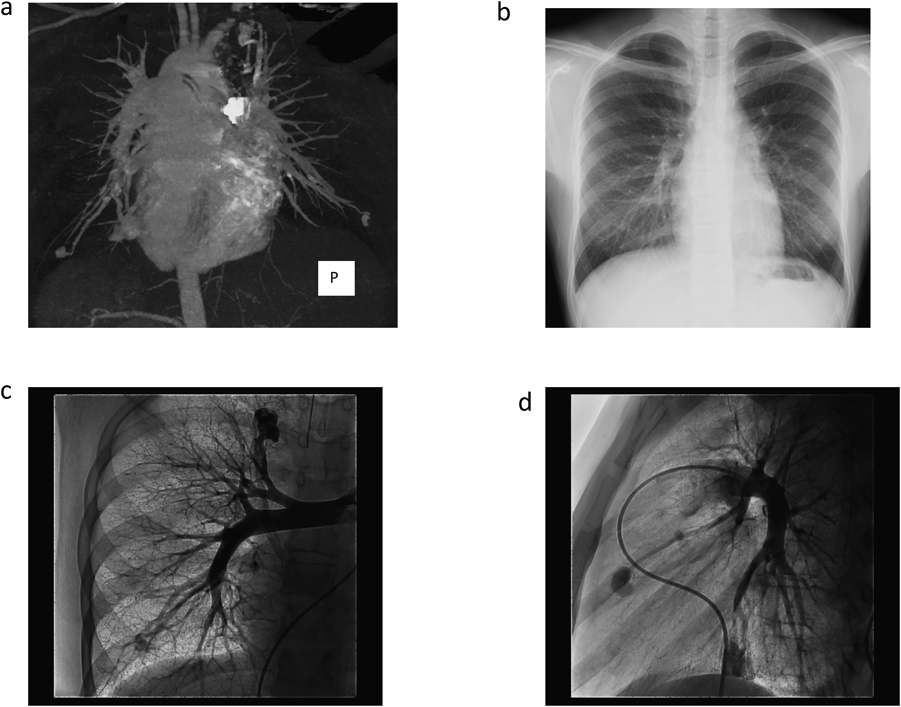
姉が頭痛,低酸素血症を契機に当院を受診し臨床所見,遺伝子検査にてHHT type 1と診断された.鼻出血や血管奇形の濃厚な家族歴が認められていたことから同胞のスクリーニング検査のため当院を受診した.家族歴,粘膜(舌)・頬部の毛細血管拡張,繰り返す鼻出血よりHHTと診断した.SpO2 93%と低酸素血症を認めたため短絡量のあるPAVMを疑い経胸壁コントラスト心エコー(Transthoracic contrast echocardiography: TTCE)ではなく造影CT(Fig. 2a)を施行し多発性PAVMの診断に至った.PAVMはいずれも1本の流入肺動脈と流出肺静脈が吻合する単純型で流入動脈径3 mm未満であったが瘻までのアクセスが可能と判断されたためコイル塞栓術(coil embolization: CE)を計画し加療目的にて入院となった.
既往歴
特記事項なし
家族歴(Fig. 1)
本児の同胞を含め,母方4世代の血縁者16名に鼻出血や肺・脳動静脈奇形の家族歴を認めた.姉がENG遺伝子変異まで同定され本家系において初めてHHTの診断となっている.
姉:ENG:Gly206ValfsX138(dup584_614(31nt:AGT GGC GGC CGC GTA CTC CAG CCT TGG TCC G)ex5)
入院時現症
身長157.8 cm,体重45.3 kg. SpO2 93%(room air)と低酸素血症が認められたが労作時の呼吸苦などの自覚症状は認められなかった.心音も整で雑音は聴取されなかった.粘膜(舌)・頬部の毛細血管拡張所見が認められた.
入院時検査所見
血液検査(Table 1)では異常所見なし.胸部レントゲン(Fig. 2b)では心胸郭比43%,両肺野に淡い腫瘤影を認めた.
Table 1 Laboratory data on admission| WBC | 5100 /µL | TP | 7.4 g/dL |
| RBC | 5.04 ×106/µL | Alb | 4.5 g/dL |
| Hb | 14.9 g/dL | AST | 23 U/L |
| Ht | 43.7 % | ALT | 16 U/L |
| Plt | 25.4 ×104/µL | LDH | 213 U/L |
| | BUN | 11.8 mg/dL |
| PT (INR) | 1.03 | Cr | 0.50 mg/dL |
| APTT | 31.7 sec | CRP | 0.00 mg/dL |
| | BNP | 7.2 pg/mL |
| pH | 7.32 | | |
| pCO2 | 44 mmHg | | |
| pO2 | 70 mmHg | | |
| HCO3 | 22.7 mEq/L | | |
| BE | −3.5 mmol/L | | |
| SO2 | 93 | | |
心臓カテーテル検査及び治療
全身麻酔挿管管理下にて施行した.
肺動脈圧17/7(10)mmHgと肺高血圧は認めなかった.
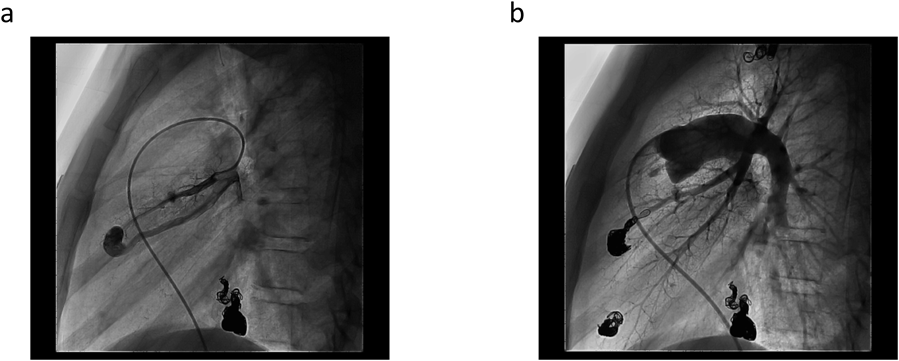
左右肺動脈造影(Fig. 2c, d)にてCTと同様のPAVMを確認した.左S8病変は2本以上の肺動脈が2本以上の肺静脈に流入する複雑型であった.大きな病変より順にCEを施行した.CEは基本的に瘻内より流入血管まで留置することとし,着脱式マイクロコイル:Micrus™microcoils(J&J, Codman)のPRESIDIOにてframing,DELTAMAXXにてfillingを行う方法で塞栓した(Fig. 3).カテーテルは複雑型で血流の多い左S8病変のみオクリュージョンカテーテル:OPTIMO 6F(Tokai Medical)を使用,その他病変に対してはコブラ4F(Terumo)とPROWLER SELECT PLUS45°(J&J, Codman)にて安定した留置が可能であった.
塞栓後SpO2 98%(room air)の改善が得られ,主だった残存PAVMの流入動脈径は1.5 mm未満であり,吻合部・瘻までのアクセスも困難と判断し終了とした.
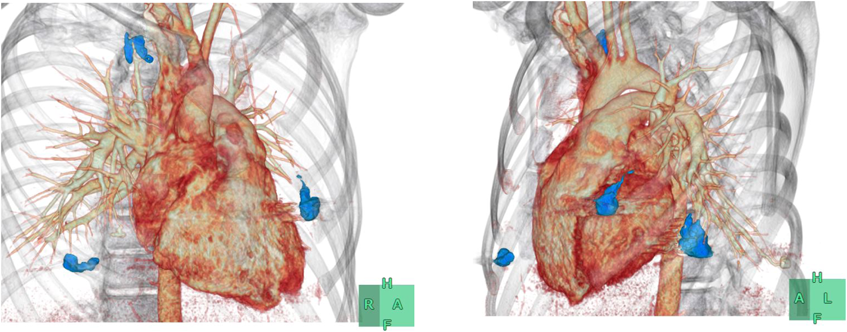
治療後半年にて施行したフォローアップCTではCE後の再潅流,残存PAVMの拡大は認められなかった(Fig. 4).術後1年経過した時点では酸素化の低下もなく経過している.
PAVMは病理学的に拡張した肺動脈と肺静脈が直接吻合する血管の異常である.吻合部は囊状血管の形をとるもの,薄い動脈瘤様の囊を形成するものがある.PAVMはその数から単発,多発,びまん性に分けられ,構造から単純型,複雑型に分類される2–5).この血管の異常のため肺動脈血が毛細血管床を介さないことから様々な生命を脅かし得る合併症を引き起こすこととなる.
治療の適応として低酸素血症に起因する運動耐容能低下などの症状や合併症の既往がある場合,3 mm以上の流入動脈径を有する場合が挙げられる.3 mm以上の流入動脈径を有する場合,重篤な中枢神経合併症が30~40%に認められるとの報告などから積極的介入が望まれるとされており,多発性病変においてはさらにその危険性が増すものとされている1, 7, 8).
流入動脈径3 mm未満の病変に対する治療適応に関してコンセンサスはないものの,合併症の報告,経年的な病変拡大に伴う合併症のリスク増加,デバイスの進歩などから治療適応の幅は拡がってきており,症例に応じた治療介入がなされるようになってきている5).
本症例は自覚症状のない低酸素血症が認められる多発性PAVMであり,流入動脈径は3 mm未満の病変であったが,症状進行,合併症リスクの軽減を目的に加療を行った.治療適応と判断した点は,低酸素血症を呈していたことから短絡量が多く合併症のリスクが高いこと,HHTに伴うPAVMであり経年的な病変の拡大が予想されたことにある.可能な限り塞栓することが合併症の軽減となることに疑いの余地はないが,可能な病変すべての塞栓術を施行した症例において再潅流(3~15%),残存病変の拡大(8~18%),奇異性塞栓(0.5~2%)が認められる報告9, 10),初回TTCEにて陰性であった症例において5年の経過のうちに12%は治療適応となる報告11)などからも,HHTに伴うPAVMは経年的に複数回の治療介入を要することが考えられる.またその加療に伴う合併症,被爆の問題,費用対効果も考慮する必要がある1).
これらの観点より,我々は,酸素化の改善を短絡量減少の基準とし短絡量が多いと考えられる病変より順に酸素化の改善が得られるまで加療を行った.
PAVMの塞栓術は正常血管床の保護,再潅流の予防が大切である.CEによる再潅流の要因として流入動脈径が大きい病変,対象血管に対してoversizeや少ない個数による不十分な塞栓,瘻からの距離が1 cm以上の位置での塞栓などが挙げられる12).特に瘻までの距離は流入動脈径3 mm以下の病変においても再潅流の要因となると考えられる.我々は対象病変の選択として吻合部・瘻までアクセスが可能であることとし,なるべく密に瘻内をコイルで充満,その後流入動脈まで塞栓する方針とした.瘻内での留置に適していると考えられる6面体を形成するPRESIDOにてframingを行うことで良好な塞栓が可能であり,コイルサイズの選択としては瘻の長径の120%前後もしくは短径の200%未満を基準としたところ無理のない形態にて留置可能であった.また流出静脈が太く吻合部径との口径差が小さい場合はコイル逸脱のリスクが高く,このような場合はなるべく吻合部近位にて確実にanchoringできる部位でのコイル留置を行うこととした.左S8複雑型の塞栓に際して1本のみ流入動脈での留置を行ったが,その他はすべて瘻内より留置可能であり合併症なく終了できている(Table 2).
Table 2 Summary of embolized PAVM| Location of PVM | Diameter of sac (Feeding artery) | Embolic coil |
|---|
| Lt S8: ① Complex type | ① 10.8×7.9 mm ((1) 2.5 mm, (2) 2.3 mm) | ① (1) #1 12 mm×40 cm |
| | #2 10 mm×40 cm, 8 mm×35 cm |
| | (2) #2 6 mm×25 cm, 5 mm×20 cm |
| ② Simple type | ② 5.8×3.5 mm (1.9 mm) | ② #2 7 mm×33 cm, 4 mm×15 cm, 3 mm×12 cm |
| Lt S5: simple type | 12.5×7.2 mm (1.9 mm) | #1 13 mm×43 cm |
| | #2 10 mm×40 cm ×2, 8 mm×35 cm, 4 mm×15 mm |
| Rt S1: simple type | 10.0×3.9 mm (1.9 mm) | #1 8 mm×30 cm |
| | #2 5 mm×20 cm, 4 mm×15 cm, 3 mm×12 cm |
| Rt S6: simple type | 6.0×4.2 mm (1.3 mm) | #1 8 mm×30 cm |
| | #2 8 mm×35 cm |
| #1: PRESIDO, #2: DELTAMAXX |
本症例においては瘻までのアクセス,血管径よりCEを選択したが,最近ではvascular plugの有用性を示す報告が多くみられるようになっている8, 13).多発性病変や流入動脈径の大きな病変など対象病変に応じたデバイスの選択も重要な点になると考える.
また本症例において検討すべきもう一つの点として,低酸素血症を来すPAVMでも自覚症状はなく,家族歴からスクリーニング検査を行い治療に至ることができたことにあると考える.PAVMの30~40%の患者はHHT関連で起こる2, 4).
HHTの診断は,2000年に示されたCuraçao criteriaにおいて,(1)繰り返す鼻出血,(2)粘膜・皮膚の血管拡張,(3)臓器症状(出血の有無によらない消化管の血管拡張,肺・肝・脳・脊髄動静脈瘻),(4)一親等以内のHHT家族歴がある.
これら4つの大項目のうち,3つ以上あると確定診断,2つある場合は疑い,1項目のみでは診断しない,とされている2–4).本症例ではすべてを満たしていることから確定診断に至った.またHHTの原因として遺伝子変異が発見されておりHHTの80%はENG遺伝子変異によるHHT type 1とACVRL1遺伝子変異によるHHT type 2によるものが占める3, 4).とくにPAVMはHHT type 1に多く認められる.本症例も,姉がENG遺伝子変異を認めていたことから,同遺伝子変異によるHHT type 1であることが予測された.ENG遺伝子改変マウスを用いた検討では血管内皮リモデリングの遅延と内皮細胞の異常増殖反応が起こることから,血管新生に異常を来す可能性が示唆されている14).
PAVMはいずれの年齢相においても,病変の大きさ・右左短絡量の程度によって症状・合併症を呈し得る15).しかしながら,HHTに合併するものを含め多くは経年的に症状を呈することから,早期診断が難しいとされる4, 10).
本症例ではCTにて確定診断および治療方針の決定と至ったが,より低侵襲で感度の高い検査としてTTCEがある.右左短絡の程度によってgrade分類がなされており,HHTのスクリーニング,フォローアップにおいてlow gradeの場合は合併症の危険性が低いとの報告もあり,治療適応の判断にも有用であると思われる11, 16).HHTの家族歴を有する場合は積極的に臨床評価,パルスオキシメトリー,TTCEにてスクリーニング検査を行うことが早期診断に繋がるものと考えられる.流入動脈径3 mm未満のPAVMにおいても合併症のリスクはあり,特にHHTに伴うPAVMの場合は多発性が多く,経年的に生命予後に影響する重篤な合併症を来すリスクも高まると考えられることから,症例に応じた適応の判断,より積極的な治療介入が望まれる.