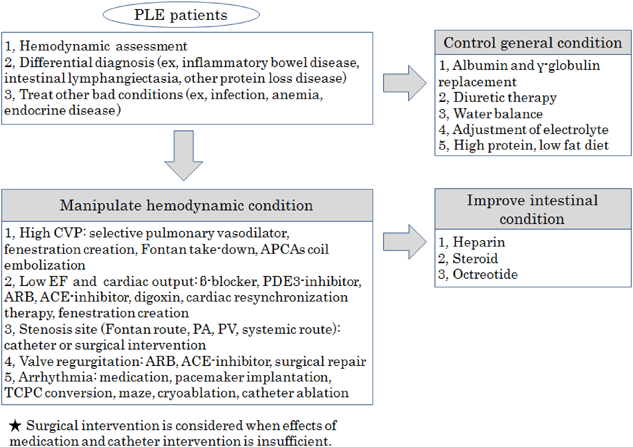
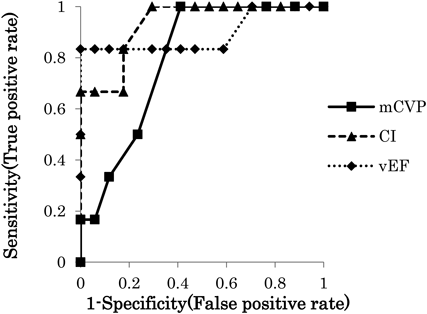
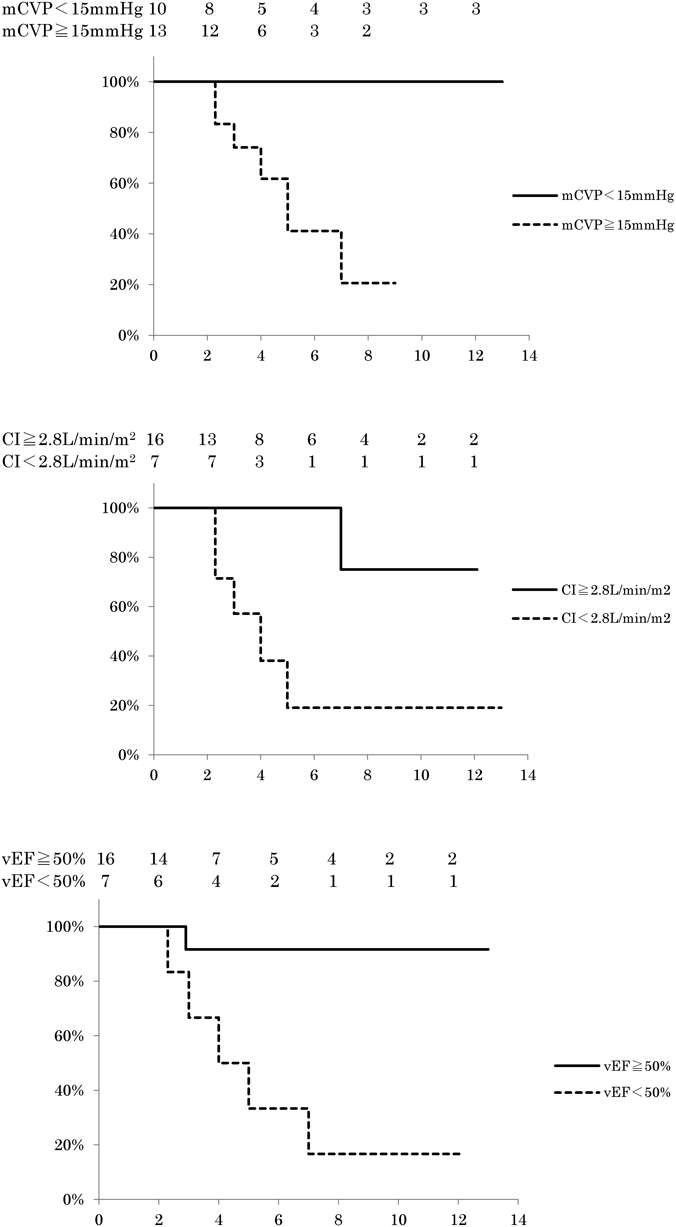
Fontan手術後に発症する蛋白漏出性胃腸症の予後に関する検討Treatment Outcomes for Patients with Fontan Associated Protein-losing Enteropathy
1 岡山大学大学院医歯薬学総合研究科 小児科Department of Pediatrics Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences ◇ Okayama, Japan
2 岡山大学大学院医歯薬学総合研究科 心臓血管外科Department of Cardiovascular Surgery Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences ◇ Okayama, Japan
3 岡山大学大学院医歯薬学総合研究科 麻酔・蘇生科Department of Anesthesiology and Resuscitology Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences ◇ Okayama, Japan
4 岡山大学大学院医歯薬学総合研究科 放射線科Department of Radiology Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences ◇ Okayama, Japan