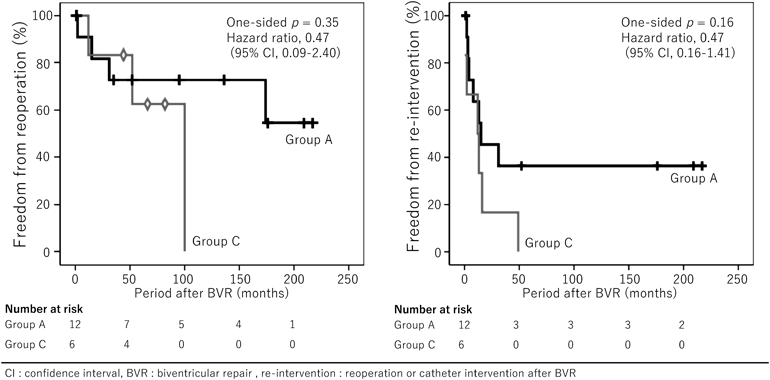
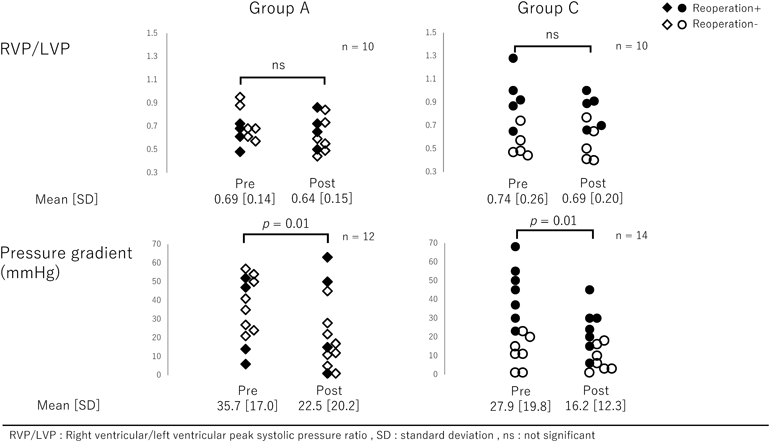
肺動脈閉鎖兼心室中隔欠損症の術後早期~遠隔期における治療介入の検討Early and Long-term Outcomes of Pulmonary Atresia with Ventricular Septal Defect after Biventricular Repair
1 あかね会土谷総合病院小児科Department of Pediatrics, Tsuchiya General Hospital ◇ Hiroshima, Japan
2 あかね会土谷総合病院心臓血管外科Department of Cardiovascular Surgery, Tsuchiya General Hospital ◇ Hiroshima, Japan