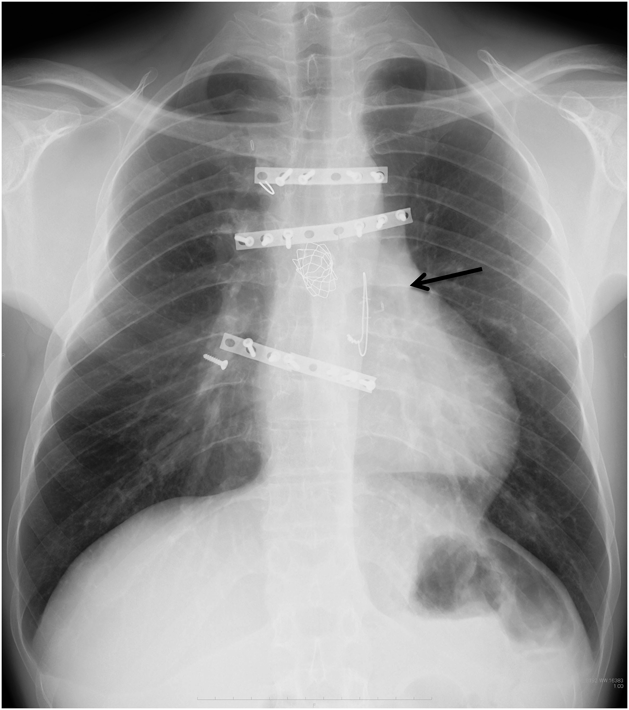
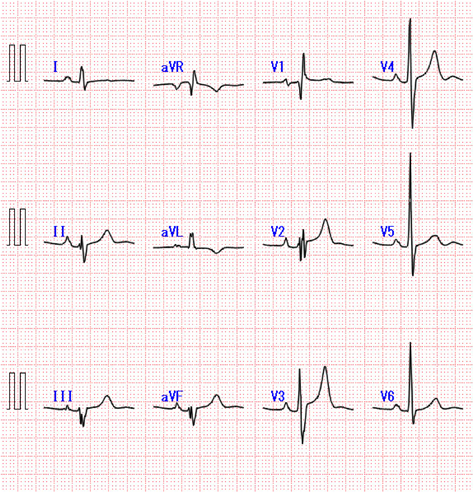
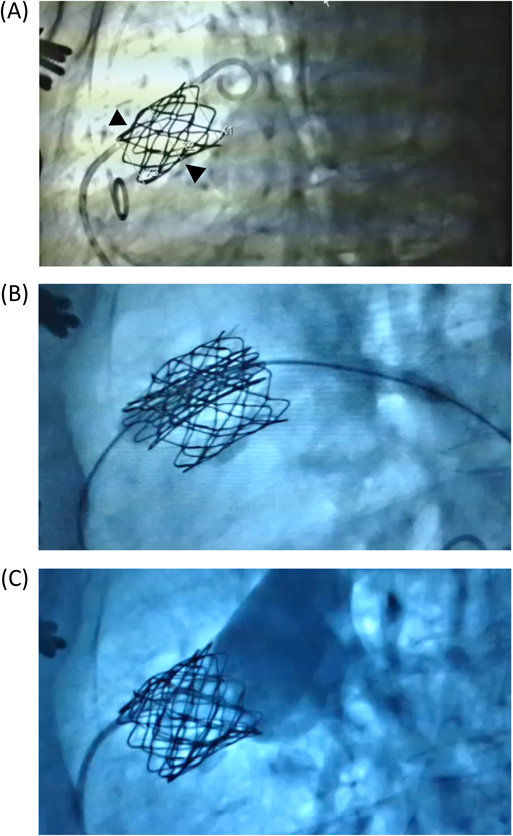
Melody valve留置術後9年目にvalve-in-valveを実施した一成人例A Case of Valve-in-valve Procedure 9 years after Initial Melody Valve Implantation
1 東邦大学医療センター大森病院小児科Department of Pediatrics, Toho University Omori Medical Center ◇ Tokyo, Japan
2 東邦大学医療センター大橋病院循環器内科Department of Cardiology, Toho University Ohashi Medical Center ◇ Tokyo, Japan
3 Cardiac Catheterization Lab, CHOC Children’s HospitalCardiac Catheterization Lab, CHOC Children’s Hospital ◇ Orange, CA, USA