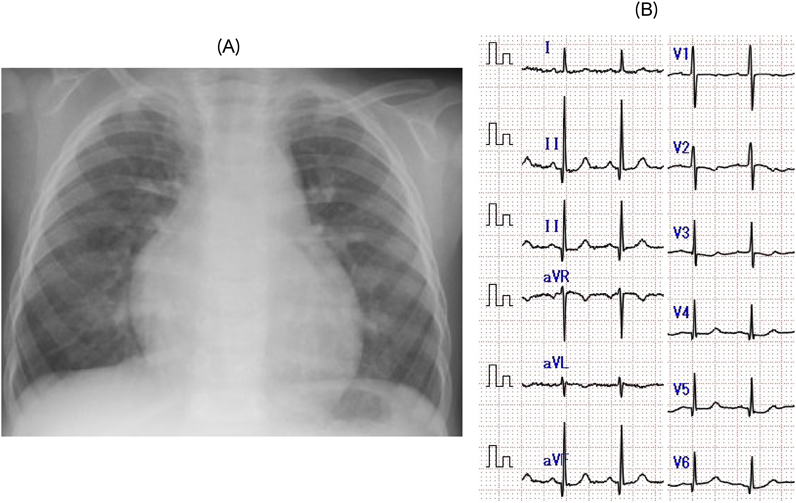
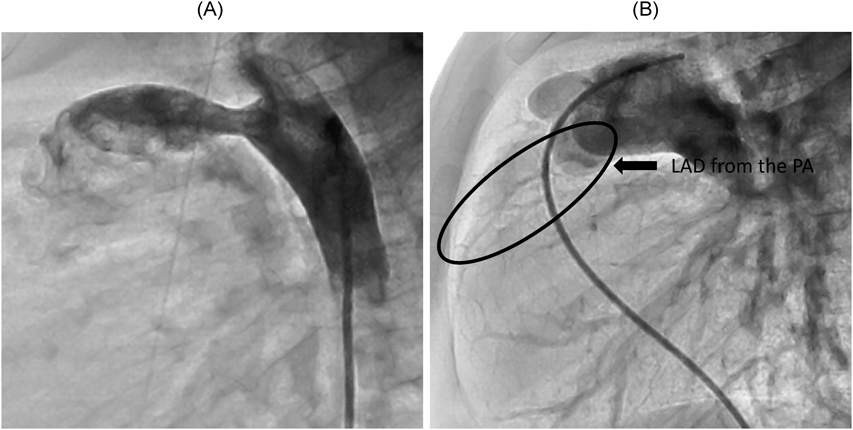
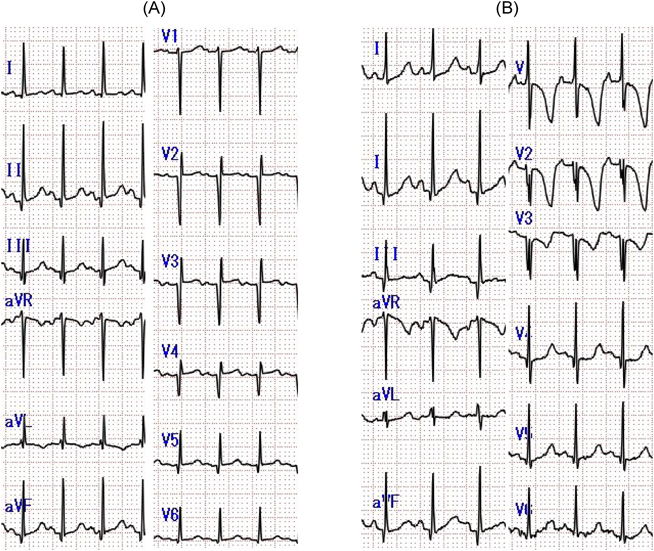
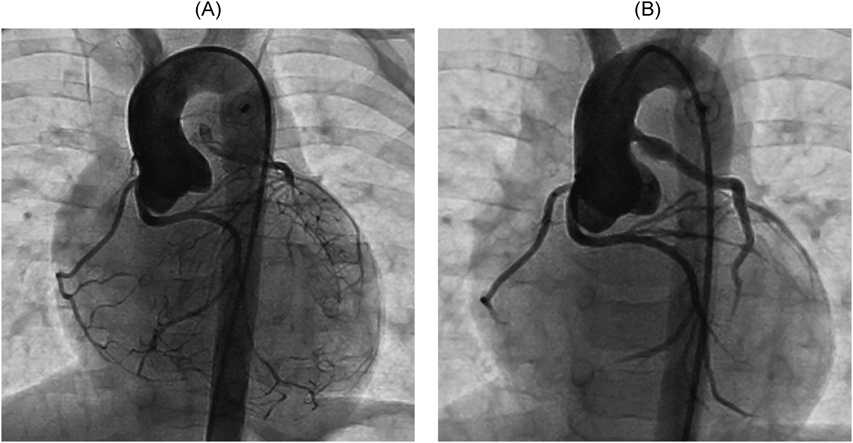
経皮的経カテーテル動脈管閉鎖術を契機に急性発症し診断に至った左冠動脈肺動脈起始症の1例A Case of Anomalous Origin of the Left Coronary Artery from the Pulmonary Artery Developed Acute Heart Failure by Transcatheter Ductus Arteriosus Closure
1 JCHO中京病院中京こどもハートセンター小児循環器科Department of Pediatric Cardiology, Chukyo Children Heart Center, Japan Community Healthcare Organization Chukyo Hospital ◇ Aichi, Japan
2 JCHO中京病院中京こどもハートセンター心臓血管外科Department of Cardiovascular Surgery, Chukyo Children Heart Center, Japan Community Healthcare Organization Chukyo Hospital ◇ Aichi, Japan