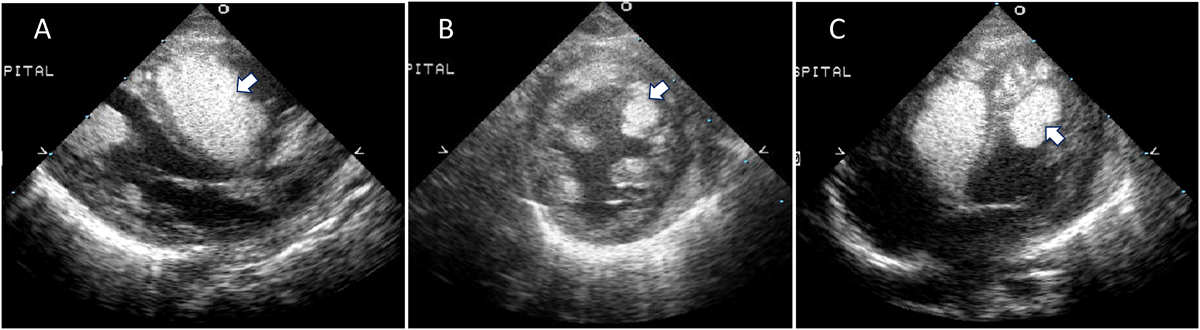
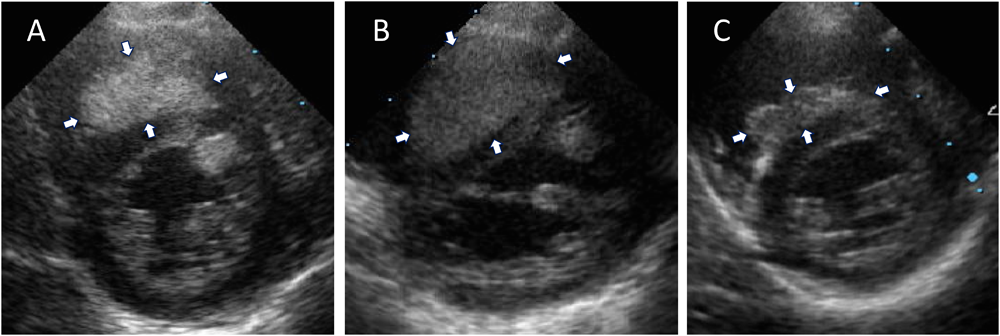
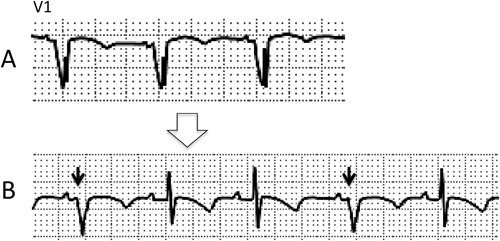
Everolimus投与後に心臓横紋筋腫が急速に退縮した結節性硬化症の1乳児例Rapid Regression of Cardiac Rhabdomyoma after Everolimus Administration in an Infant with Tuberous Sclerosis
1 大阪市立総合医療センター小児循環器内科Department of Pediatric Cardiology, Osaka City General Hospital ◇ Osaka, Japan
2 大阪市立総合医療センター小児不整脈科Pediatric Electrophysiology, Osaka City General Hospital ◇ Osaka, Japan
3 大阪市立総合医療センター小児神経内科Pediatric Neurology, Osaka City General Hospital ◇ Osaka, Japan