症例
女児
現病歴
37週,2,096 g,帝王切開で出生.出生直後からチアノーゼを認めた.心臓超音波検査で単心室,肺動脈閉鎖,総肺静脈還流異常(下心臓型)と診断され,プロスタグランディンE1投与下に,当院へ緊急搬送された.
入院時現症
体重2,048 g.心拍数155/分,血圧56/25 mmHg,SPO2 80~90%(room air)であった.LevineII度の連続性雑音を胸骨左縁第3肋間に聴取した.口唇口蓋裂を認めた.
血液検査
総ビリルビン6.9 mg/dl以外血液検査上,異常はなかった.末梢血液中にHowell-Jolly小体を認めた.
胸部単純X線写真
心胸郭比56%,すりガラス様の肺うっ血像を認めた.
心電図
洞調律,132/分で,右軸偏位(QRS axis +135度)であった.
心臓超音波検査
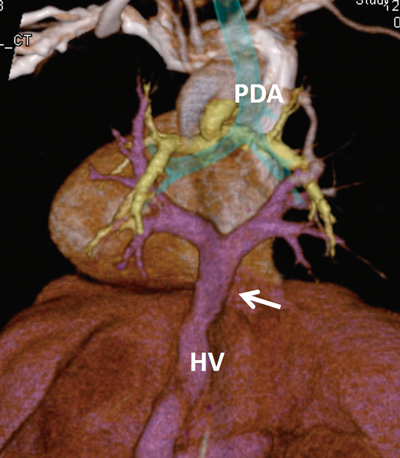
左側房室弁は閉鎖し,痕跡的左心室を認め,右室型単心室であった.肺動脈弁は閉鎖していた.肺静脈は共通肺静脈を介して垂直静脈となり,肝静脈へ合流していた.
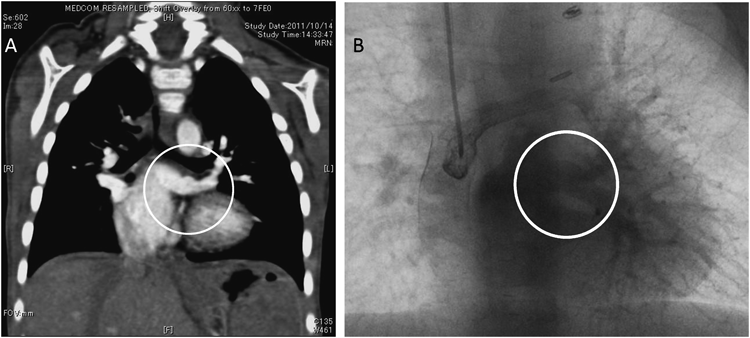
MDCT(multi-detector raw CT,multi-detector CT)検査(Fig. 1)
生後4日のMDCTでは,共通肺静脈は垂直静脈を経由して,肝静脈へ還流しており,この接続部位で軽度の狭窄を認めた.共通肺静脈径は7 mmで,左右肺静脈径は4 mmで左右差はなかった.また,右上気管気管支が観察された.脾臓は認めなかった.
診断,治療方針
以上より,無脾症,右室型単心室,肺動脈閉鎖,総肺静脈還流異常(下心臓型),肺静脈狭窄と診断し,総肺静脈還流異常の修復と体肺動脈短絡術変法(modified Blalock-Taussig shunt: BTシャント変法)を行う方針とした.シャントサイズは,体重2 kg台であり,3.0 mmφを吻合したうえで血行動態を確認してクリップで調整を行う予定とした.
初回手術(Fig. 2)と経過
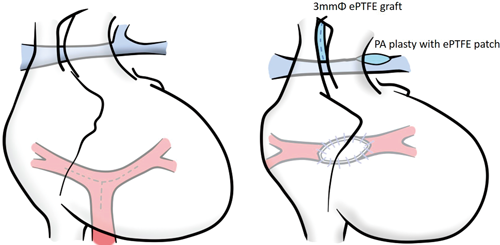
生後8日,体重2,097 g.胸骨正中切開で上行大動脈送血,右側心房脱血で人工心肺を確立した.動脈管を離断し,その肺動脈接続部から動脈管組織を切除してthin wall expanded polytetrafluoroethylene(ePTFE)graftをパッチとして形成した.循環停止(血液温23°C)として,垂直静脈を横隔膜直上で結紮離断した.共通肺静脈と心房との吻合は右側心房を切開して心房内側から行った(8-0 Prolene連続吻合).人工心肺を再開,大動脈遮断解除後心拍動下にBTシャント変法(3.0 mmφ ePTFE人工血管)を行った.血行動態は安定しており,FiO2 21%でSpO2 80~85%であったため,シャントサイズの調整は行わなかった.二期的胸骨閉鎖の方針として,手術を終了した.人工心肺時間:204分,大動脈遮断時間:64分,循環停止時間:57分であった.
生後22日(術後14日)に二期的閉胸した.SpO2はroom airで85%前後であったが,術後50日ごろよりSpO2が70%台へと低下した.心臓超音波検査で左右肺静脈入口部のPVOと診断した.
1回目PVO解除術(生後80日,体重2,439 g)と経過
胸骨再正中切開,上行大動脈送血,右側心房脱血で人工心肺を確立,循環停止(血液温18°C)として,右側心房を切開し肺静脈の入口部を観察した.左右肺静脈の入口部内膜が肥厚し,狭窄していた.肺静脈の走行に従って壁を切開し,8-0 Proleneを用いて心房壁と肺静脈壁の内膜固定を行った.人工心肺の離脱は順調で,閉胸し集中治療室に帰室した.人工心肺時間:145分,大動脈遮断時間:64分,循環停止時間:55分であった.術直後,SpO2は82%まで上昇したが,徐々に低下し,術後1ヵ月でSpO2 70%に低下した.心臓超音波検査で中心肺動脈(central PA)の狭窄と左PVOを認め,胸部レントゲンでも肺血管陰影の左右差を認めた.左BTシャント変法による左肺血流の増加と左PVOの外科的解除を近接二期に行うことを計画した.
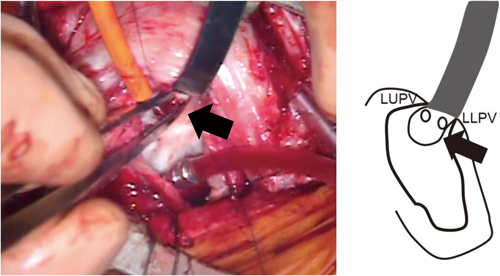
BTシャント変法,2回目PVO解除術(生後146日,体重3,403 g)と経過
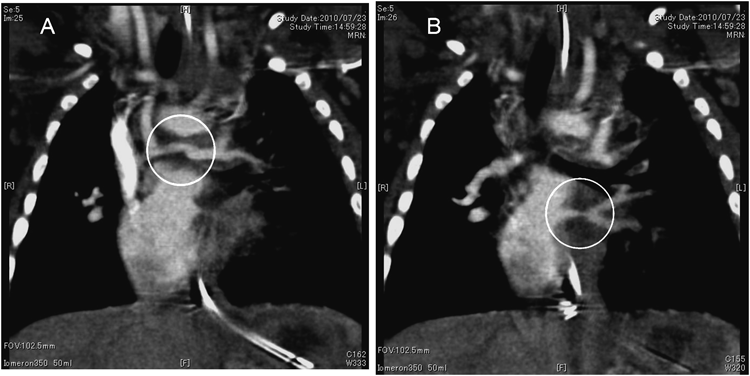
生後146日,左側方開胸でアプローチし,左BTシャント変法(3.5 mmφ)を行った.生後157日に撮影したMDCTでは左共通肺静脈は細いものの肺内PVの拡張を認めた(Fig. 3).生後163日(体重3,357 g)にPVO解除を行った.胸骨再正中切開,血液温21°Cで大動脈遮断して循環停止にした.右側心房を切開して肺静脈の入口部を観察した.右肺静脈の入口部には内膜の肥厚はなく,狭窄を認めなかった.左肺静脈入口部は肥厚し狭小化していた.鉗子を挿入し,注意深く内腔を確認しながら壁に切開を加えた.最も狭い部分を越えて瘢痕組織を全周性に切除すると,左肺静脈の内膜が外れ,瘢痕組織の腔を介して左上下肺静脈が観察された(Fig. 4).瘢痕組織のみのSuturelessとした.人工心肺の離脱に問題なく閉胸して手術を終了した.体外循環時間:116分,大動脈遮断時間:26分,循環停止時間:20分であった.術翌日に抜管し,抜管直後からSpO2は80%(room air)を示すようになった.その後の経過は良好で,生後245日(体重3,466 g)で自宅退院となった.1歳3ヵ月の心臓カテーテル検査では,右肺動脈圧12 mmHg,左肺動脈発17 mmHg,右肺動脈8 mm,左肺動脈5.7 mm,PA index 244 mm2/m2であり,MDCTで左肺静脈の開存が確認(Fig. 5A)できた.両方向性グレン手術を行うと,中心肺動脈狭窄があるため左肺への血流確保が困難と考えて,左BTシャントを残して上大静脈右肺動脈吻合を行う方針にした.
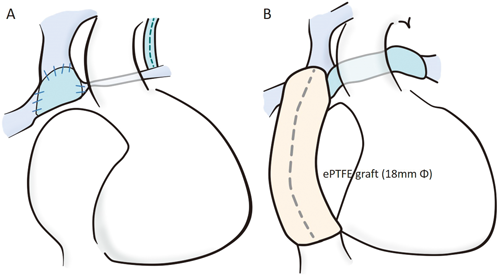
上大静脈右肺動脈吻合(Fig. 6A)と経過
1歳8ヵ月(体重6.7 kg)で手術を行った.胸骨再正中切開でアプローチし,人工心肺,心拍動下に上大静脈右肺動脈吻合を行った.吻合部前方はthin wall ePTFE graftパッチで形成した.体外循環時間:94分であった.その後発育も良好で,2歳3ヵ月時の心臓カテーテル検査では,上大静脈圧13 mmHg,右肺動脈圧13 mmHg,左肺動脈圧10 mmHgであった.
TCPC(Total cavopulmonary connection)手術(Fig. 6B)と経過
2歳5ヵ月(体重7.8 kg)で手術を行った.胸骨再正中切開人工心肺心拍動下に行った.中心肺動脈は大動脈背側を十分に剥離して,thin wall ePTFE graftをパッチとして拡大した.18 mmφ ePTFEグラフトを心外導管として用いて,TCPC手術を行った.体外循環時間:196分であった.現在4歳8ヵ月,PVOの再発なく(Fig. 5B)外来経過観察中である.
無脾症候群の単心室治療において房室弁逆流と総肺静脈還流異常は予後不良な合併症である2, 3).総肺静脈還流異常の型としては下心臓型,混合型が生命リスクとして挙げられており4),術後PVO発症の頻度が高いと報告されている.今回の症例も下心臓型の総肺静脈還流異常修復,BTシャント変法後にPVOを繰り返した例であった.総肺静脈還流異常修復後のPVO解除法としては,狭窄部の切開,パッチ拡大を基本とするconventional repair法5),癒着組織を利用したsnap back sutureless法6)や,心膜を用いたpericardial marsupialization法7)などの外科的治療のほか,ステントやバルーンによる狭窄解除などの報告もある8).しかし,カテーテルによるPVOへの介入は,バルーンによる拡大術は無効と報告されている9).また,ステント拡大術を行ってもステント内腔に内膜増殖をきたし,高率に再狭窄を生じる.そのため,われわれは総肺静脈還流異常修復後のPVOに対しては積極的に外科的拡大を行う方針としている.
今回の症例では,二度とも循環停止下に心房内から肺静脈入口部を外科的に広げる方法を取った.左房後壁は癒着しており,その癒着腔を利用してsutureless法で拡大することが可能であった.その後の再狭窄も現在のところ認めていない.この症例での経験をふまえ,当院では総肺静脈還流異常修復後のPVO,特に末梢肺静脈腔が十分な径を有する部分的再狭窄例に対してsnap back sutureless法を第一選択としている.
一方,単心室姑息術後では,肺動脈の左右血流不均衡が存在する場合があり,肺血流不足側では,肺静脈の血流もまた不足しており,PVOを助長する可能性がある.そのような場合,肺血流不均衡の肺動脈側の原因を是正する必要がある.自験例では血流不足側にBTシャント変法を行い,血流を増やしたうえでPVOの解除を行った.しかし,PVOが顕著な場合,BTシャント変法で血流を増やすと肺うっ血の増悪をきたすことがあり,注意が必要である.計画的に肺血流増加とPVO解除のタイミングを図ることが重要と考えられる.今回の症例では,姑息術後でのPVO発症であったが,グレン手術後に潜在的なPVOが顕在化する例も散見される.両方向性グレン手術後は肺動脈にかかる圧が比較的低値の定状流となることが関与していると考えられる.また通常両方向性グレン手術では片側肺動脈に上大静脈を吻合するため,中心肺動脈狭窄を合併している場合,片側肺血流が極端に低下する場合がある.
このような左右血流不均衡な症例に対して,Sakamoto10)は左右別々に肺動脈を成長させる方法としてintrapulmonary-artery septation(IPAS)の有用性を報告している.しかしBTシャントの太さやPVO解除時期は今後の課題である.今回の症例では,上大静脈肺動脈吻合計画時に左右BTシャントを有しており,中央肺動脈狭窄があった.中央肺動脈狭窄をあえて拡大形成せず,左BTシャントを残すことで血行動態的にIPASの状態を作り,これも左PVOの進行を予防するうえで有用であったと考えられる.
PVOに対しては,肺うっ血をきたし肺血管抵抗が上がってしまう前のできる限り早期に介入を行い,良好な肺条件を保つことでFontan型手術到達が可能になる症例があると考えられる.