症例
5ヶ月,女児
診断
HLHS, atrioventricular discordance, ventriculoarterial discordance, CoA, Mitral atresia, VSD, ASD, Subaortic stenosis, 左気管支軟化症
現病歴
38週,2,618 gで出生.日齢7日にチアノーゼ出現し他院でHLHSと診断された.人工呼吸開始し当院に救急搬送され,プロスタグランジン製剤持続投与を開始した.日齢12日に両側肺動脈絞扼術を施行し,日齢19日に人工呼吸器より離脱したが日齢22日に再挿管となった.日齢27日に再度離脱したが多呼吸,陥没呼吸が継続したためHigh flow nasal cannulaを使用し症状は改善した.4ヶ月時に心臓カテーテル検査およびCT,気管支鏡検査を施行して左気管支軟化症と診断した.5ヶ月時にNorwood,BDG手術を施行した.
現症
体重5.18 kg,身長56 cm,血圧76/37,心拍数142回/分,SpO2 84%,(High flow nasal cannula: FiO2 21%, 7L)で,呼吸音は整.心雑音は第2胸骨左右縁に収縮期雑音Levine II/IVを聴取し,肝臓を右季肋下に2 cm触知した.胸部単純X線では心胸郭比62%で,肺鬱血(−),心電図sinus rhythm.左室肥大所見を認めた.
心臓超音波検査
RVDd 41 mm,右室収縮不良でEF 40%,三尖弁閉鎖不全trivial.大動脈弁輪径4.6 mm,大動脈弁下狭窄部3.8 mm,右肺動脈絞扼部1.8 mm, flow 4.0 m/s,左肺動脈絞扼部1.2 mm, flow 4.2 m/s,心房中隔欠損孔8.4 mm.
血液生化学検査
WBC 8,570/mm3, Hb 12.5 g/dL, Plt 36.2×104/mm3, BUN 14 mg/dL, Cre 0.38 mg/dL, AST 24 IU/L, ALT 7 IU/L, BNP 266 pg/mL.
心臓カテーテル検査
左右のmPAPはそれぞれ17 mmHg, 15 mmHg, Rp 0.73 U·m2.RVP 64/28 mmHg, RVEDV 25.9 mL(217% of normal), RVEF 32%で,rudimentary LVはほとんど収縮なし.Qp/Qs 1.6, CI 3.96 L/min/m2.冠動脈に起始異常はなく,CoAのisthmusは2.3 mmであった.
造影CT
肺動脈弁から右肺動脈までの距離は4 mm,左気管支は大動脈と心臓間で圧排されている(Fig. 1a).
気管支鏡検査
左気管支内腔は50%以上の狭窄と後方から圧排されている所見(Fig. 1b).
手術
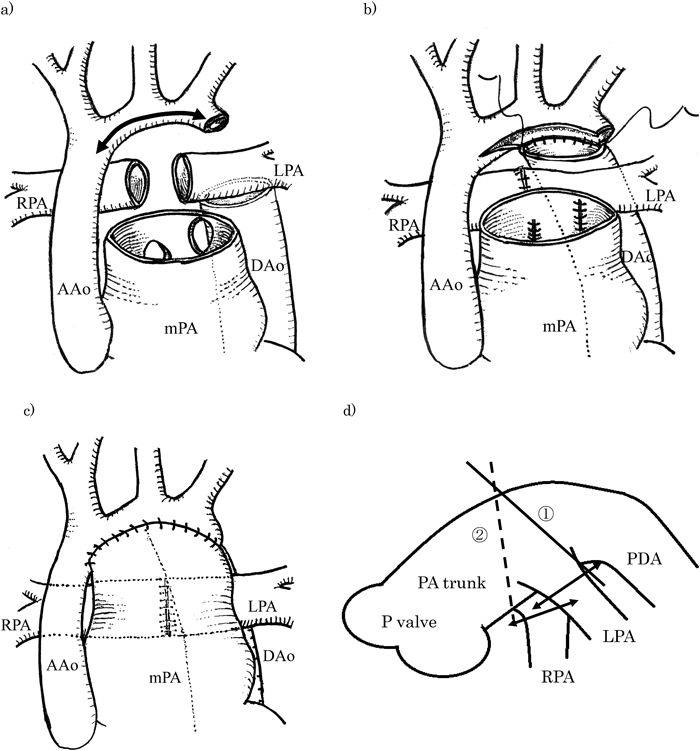
胸骨正中再切開.腕頭動脈にdirect cannulationして上半身への送血とし,横隔膜上下行大動脈には下半身への送血カニュレーションをした.上下大静脈脱血および右房ベントにより体外循環を確立した.心拍動下に動脈管を結紮離断し,左右肺動脈を剥離して,両側肺動脈の絞扼解除を行った.肺動脈は左右の起始部で離断して端々吻合を後面の2/3は7-0 PDS連続縫合で,前面1/3は7-0 polypropyleneによる単結節で行った.主肺動脈遠位と下行大動脈近位の動脈管組織を切除し,肺動脈幹に18 mmの長さを確保できたことから左気管支圧迫回避に有効と考えられた.弓部大動脈遠位部と下行大動脈近位を6-0 polypropyleneで吻合し,さらに肺動脈を上行から弓部大動脈に吻合して大動脈再建を行った.再建は上行大動脈にside clampをして大動脈弓部小弯側から上行大動脈遠位まで切開吻合し,心拍動下に行った.グレン吻合を行い体外循環から離脱した(Fig. 2).
術後経過
第2病日に2期的閉胸を行い,第4病日に人工呼吸器から離脱した.第7病日にICUを退室し,第14病日に呼吸症状の出現なくHigh flow nasal cannulaの使用を中止できた.
術後検査
造影CT
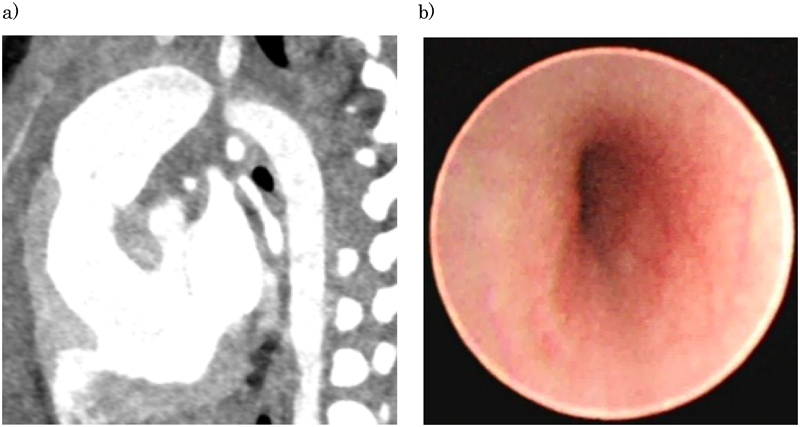
術前と比較して左気管支断面の変形は改善している(Fig. 3a).
術後の大動脈による気管支圧迫の評価として上行大動脈と下行大動脈間距離/体重(mm/kg)を計測すると3.26 mm/kgで,従来の大動脈再建方法のNorwood手術(自施設6例,自己心膜補填例を含む)1.15 mm/kgと比較して肺門部の開大が認められた.
心臓カテーテル検査
左右のPAP(15 mmHg), Rp 0.84 U·m2. RVP 70/8 mmHg, RVEDV 42.6 mL(278% of normal), RVEF 29%, Qp/Qs 0.85, CI 2.78 L/min/m2.
気管支鏡検査
後方の下行大動脈からの圧排が軽減し,左気管支内腔の扁平化が50%以下に改善している(Fig. 3b).
気管支軟化症は呼気時に気管支が虚脱して閉塞する病態で,軟骨支持組織の欠如が原因のprimaryなものと,血管輪のように近接した動脈による圧迫や先天性食道閉鎖症に合併したsecondaryのものに分類される.中等度までの症候性の多くは数年内に自然寛解するが,重篤なチアノーゼ発作を生じる重度の症例では,内科的もしくは外科的治療を必要とする疾患である1, 2).
先天性心疾患に気管支軟化症が合併することは決して稀でなく,気管支軟化症の20~58%に心血管病変を合併しているとされている2).その多くは重複大動脈,PA slingの血管輪が1/2~1/3を占め,VSD,PDAに次いで単心室,Fallot四徴症,修正大血管転位症とされているが5, 6),当症例のように左心低形成症候群との合併例の報告は少ない.機序として気管支外の圧が内腔支持圧を超えたときに生じることから呼気時に生じやすく,拡大した左房でも原因となりうる2).当症例では両側肺動脈絞扼術が及ぼした影響についても検討したが,CT検査で胸骨から椎骨への距離に占める主肺動脈幹の割合を計測すると術後にむしろ減少しており否定的であった.
確定診断は主に気管支鏡検査で,自発呼吸下での気管支内腔50%以上の狭窄で診断される.喘鳴や陥没呼吸など気管支病変が疑われるきには積極的に行うべきで,外部からの圧迫による気管支病変に対してはCTやMRIも有用な検査である2).当症例ではHigh flow nasal cannulaによるPEEP効果で症状は改善したが,一般には反復する上気道感染と喘鳴といった軽症から,dying spellといわれる啼泣や哺乳児の致命的な呼吸不全まで多彩で,重症例では人工呼吸器管理や大動脈胸骨固定術,外ステント術といった外科治療が必要となる7).
一方,左心低形成症候群に対するNorwood手術は,補填材料を使用しない大動脈再建術後の二次的な気道閉塞の報告が増えている8).左心低形成に対するNorwood手術は1982年に補填材料を使用しない大動脈再建を報告しているが9),自己大血管組織のみによる再建手術では,再建大動脈と下行大動脈間,いわゆる左肺門部狭窄による左気管支狭窄や肺動脈狭窄が問題となっている3, 4).本症例に対するNorwood手術では,左肺門部狭窄の回避を目的に,肺動脈幹を温存して自己肺動脈組織を大動脈再建に用いるPATS法を行った.両肺動脈を肺動脈幹の起始部で離断して端々吻合を行い,離断部は直接閉鎖することで大動脈再建に利用できる主肺動脈長軸距離を確保し,さらに短軸径を縮小することで左肺門部狭窄を回避した.術後に呼吸器症状は消失し,気管支鏡検査でも気管支内腔形状の改善を認めた.
Norwood手術における大動脈再建では欧米では補填材料を使う方法が一般化しているが,本邦ではホモグラフト入手困難なために自己組織のみによる修復方法が主流である10–12).補填材料を用いる方法では左肺門部狭窄は少ないが,遠隔期での大動脈再狭窄が多いことが報告されている13).一方,自己大血管組織のみによる方法では左肺門部狭小による左肺動脈狭窄,左気管支狭窄が少なくないことが報告されており,38.9%で気管支軟化症,肺動脈狭窄に対して大動脈再形成術や肺動脈バルーン拡大術などの再治療を必要としていた4).当症例でのPATS法は自己大血管組織のみによる方法で,異物の不使用と成長性といった点から遠隔期での再狭窄のリスクは小さく,さらに左肺門部の狭窄を回避する方法であると考えられる.同方法の自験例5例でも,従来のNorwood手術(6例,自己心膜補填例を含む)と比較して上行大動脈と下行大動脈間距離/体重(mm/kg)が2.76±0.73 : 1.51±0.27(p=0.003)と有意に大きく,左肺門部狭窄回避に有効であることが示唆されている.
本症例では術前から左気管支軟化症を合併しているため,従来の自己組織のみによるNorwood大動脈修復術によって左肺門部の狭小化による気管支軟化症のさらなる増悪が懸念されたが,PATS法を行うことで,大動脈胸骨固定術等を追加することなく左肺門部狭窄を回避し,さらに左気管支軟化症の改善を得ることができた.