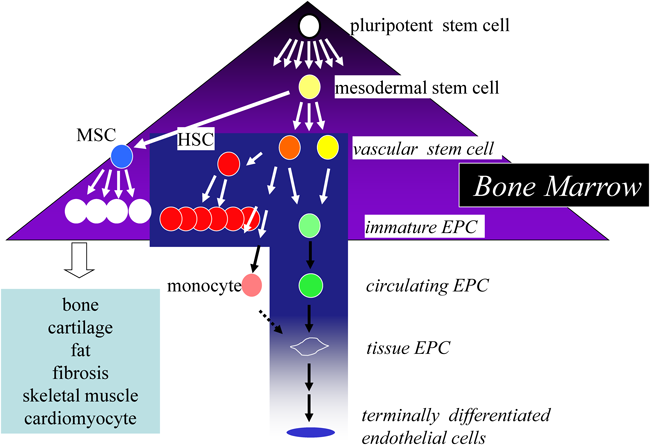
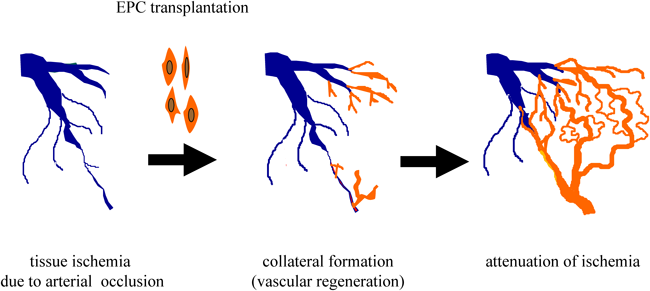
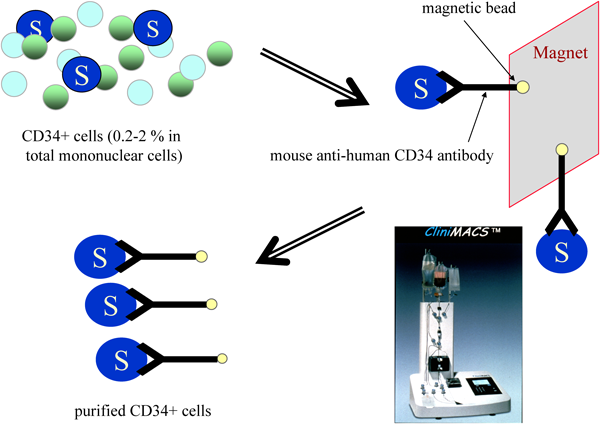
CD34陽性細胞移植による血管・組織の再生治療Vascular and Tissue Regeneration by CD34+ Cells
1 公益財団法人先端医療振興財団先端医療センター病院診療部再生治療ユニットUnit of Regenerative Medicine, Institute of Biomedical Research and Innovation Hospital, Foundation for Biomedical Research and Innovation ◇ 〒650-0047 兵庫県神戸市中央区港島南町二丁目2番2-2 Minatojima-Minami-machi, Chuo-ku, Kobe-shi, Hyogo 650-0047, Japan
2 公益財団法人先端医療振興財団先端医療センター研究所再生医療研究部血管再生研究グループRevascular Regeneration Research Group, Department of Regenerative Medicine Research, Institute of Biomedical Research and Innovation Laboratory, Foundation for Biomedical Research and Innovation ◇ 〒650-0047 兵庫県神戸市中央区港島南町二丁目2番2-2 Minatojima-Minami-machi, Chuo-ku, Kobe-shi, Hyogo 650-0047, Japan