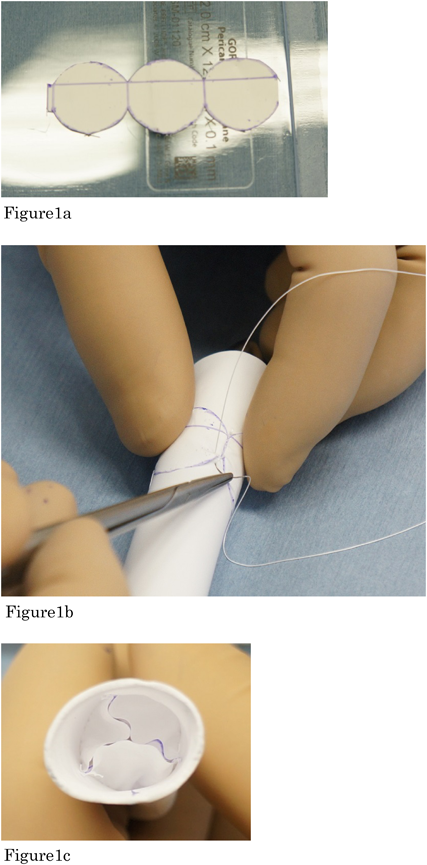
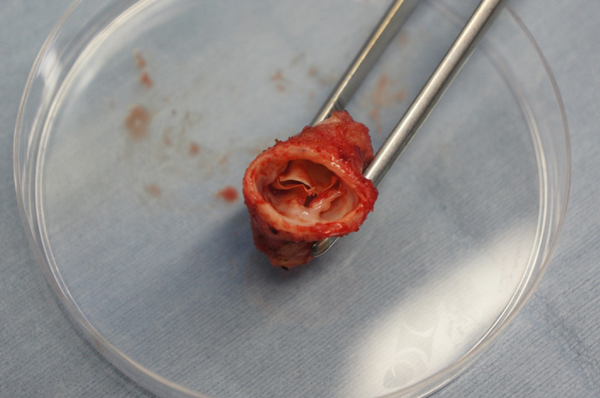
乳児期後期Rastelli型手術における16 mm自作3弁付きePTFE導管の中期遠隔成績Mid-term Results of Right Ventricular Outflow Tract Reconstruction using 16-mm Hand-made Trileaflet Expanded Polytetrafluoroethylene Conduits in Approximately 1-Year-Old Infants
1 岩手医科大学附属病院循環器医療センター心臓血管外科Department of Cardiovascular Surgery, Memorial Heart Center, Iwate Medical University Hospital ◇ 〒020-8505 岩手県盛岡市内丸19番1号Uchimaru 19-1, Morioka-shi, Iwate 020-8505, Japan
2 岩手医科大学附属病院循環器医療センター小児循環器科Department of Pediatric Cardiology, Memorial Heart Center, Iwate Medical University Hospital ◇ 〒020-8505 岩手県盛岡市内丸19番1号Uchimaru 19-1, Morioka-shi, Iwate 020-8505, Japan