1. 患者の背景と心疾患の内訳
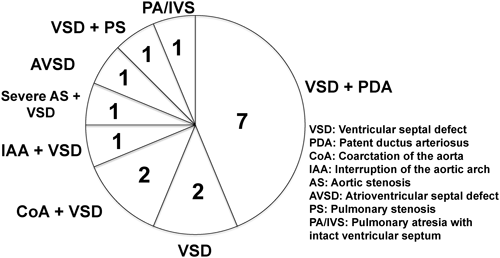
手術介入を行った16例(A群,B群)の臨床像をTable 1に示す.16例の在胎週数は35~41週(平均38週),出生体重は1,065~2,820 g(平均1,864 g)であった.在宅移行を目的に姑息術を行ったA群14例中,8例は院内出生,残り6例は院外出生で他院NICUより手術目的で転院して来た例である.B群は手術介入なしでいったん他院を退院後,心不全が増強し当院に紹介され心内修復術を行った例でいずれも院外出生であった.16例中8例は出生前に羊水染色体検査で18トリソミーと診断されていた.心疾患の手術直前で人工呼吸管理を要していたのは16例中10例(63%)であった.心疾患以外の主な合併奇形は小脳低形成6例,食道閉鎖2例,横隔膜弛緩症2例,臍帯ヘルニア2例,横隔膜ヘルニア,小顎,鎖肛,髄膜瘤各1例(重複含む)であった.16例の心疾患の内訳は,心室中隔欠損+動脈管開存が7例と最も多く,心室中隔欠損単独2例を合わせると全体の56%を占めた.また左心系狭窄病変が大動脈縮窄+心室中隔欠損2例,大動脈離断+心室中隔欠損1例,重症大動脈弁狭窄+心室中隔欠損1例あった.その他心内膜床欠損,心室中隔欠損+肺動脈弁狭窄,純型肺動脈閉鎖が各1例であった(Figure 2).
Table 1 Characteristics, cardiac surgery, and outcomes of patients in groups A and B| Case | GW (weeks) | BW (g) | Inborn/ outborn | CHD | Cardiac surgery | Days at surgery | Mechanical ventilation before surgery | Extubation after surgery (days) | Extracardiac anomaly | Hospital discharge | HOT at discharge | Final status |
|---|
| Group A | 1 | 40 | 2240 | O | IAA(B)+VSD | IAA repair+PAB | 2d | (+) | 7 | Eventration of the right diaphragm Umbilical hernia, Cerebellular hypoplasia | 139d | (+) | Death (203d) |
| *2 | 37 | 2597 | I | VSD+PDA | PDA ligation (→PAB) | 14d (6m) | (−) | 2 | Cerebellular hypoplasia | 77d | (−) | Alive (8y) |
| 3 | 39 | 1521 | I | VSD+PDA | PAB+PDA ligation | 13d | (+) | 5 | Cerebellular hypoplasia | 142d | (−) | Death (248d) |
| 4 | 35 | 1462 | I | VSD+PDA | PAB+PDA ligation | 9d | (+) | (−) | Eventration of the left diaphragm, Hypoplasia of the lungs | (−) | | Death (219d) |
| 5 | 40 | 2288 | I | VSD+PDA | PAB+PDA ligation | 6d | (−) | 4 | Umbilical hernia, Cerebellular hypoplasia | 107d | (−) | Death (1y6m) |
| 6 | 35 | 1527 | I | COA+VSD | bil-PAB | 42d | (+) | (−) | Esophageal atresia, Atresia ani | (−) | | Death (60d) |
| 7 | 36 | 1225 | O | VSD+PDA | PAB+PDA ligation | 6d | (−) | 11 | (−) | 178d | (−) | Death (182d) |
| 8 | 41 | 2180 | O | VSD+PDA | PAB+PDA ligation | 22d | (−) | 1 | (−) | 75d | (−) | Death (352d) |
| 9 | 41 | 2150 | O | VSD+PDA | PAB+PDA ligation | 28d | (−) | 2 | (−) | 69d | (+) | Alive (2y) |
| 10 | 36 | 1550 | I | COA+VSD | bil-PAB | 36d | (+) | (−) | Micrognathia, Contracture | (−) | | Death (57d) |
| 11 | 37 | 1490 | I | severe AS+VSD | bil-PAB | 30d | (+) | 6 | Meningocele | 121d | (+) | Alive (2y) |
| 12 | 35 | 1065 | I | AVSD | PAB | 40d | (+) | (−) | Esophageal atresia, Diaphragmatic hernia | (−) | | Death (167d) |
| 13 | 39 | 2086 | O | VSD | PAB | 29d | (+) | 19 | Cerebellular hypoplasia | 94d | (+) | Death (99d) |
| 14 | 36 | 1580 | O | PA/IVS | rt-m-BT+PDAligation | 167d | (+) | 25 | (−) | 223d | (+) | Death (283d) |
| Group B | 15 | 41 | 2820 | O | VSD+PS | ICR | 7m | (+) | 3 | Cerebellular hypoplasia | 8m | (+) | Alive (4y) |
| *16 | 40 | 2046 | O | VSD | PAB → ICR | 2m/5m | (−) | 1/3 | Polydactyly | 3m/6m | (−) | Alive (3y) |
| GW: Gestational week, BW: Birth weight, CHD: Congenital heart defects, HOT: Home oxygen therapy. VSD: Ventricular septal defect, PDA: Patent ductus arteriosus, CoA: Coarctation of the aorta, IAA: Interruption of the aortic arch, AS: Aortic stenosis, AVSD: Atrioventricular septal defect, PS: Pulmonary stenosis, PA/IVS: Pulmonary atresia with intact ventricular septum, PAB: Pulmonary artery banding, bil-PAB: Bilateral pulmonary artery banding, rt-m-BT: right modified Blalock-Taussig shunt, ICR: intracardiac repair, →: Staged operation, d: days, m: months, y: years, *: Mosaicism. |
手術介入を行わなかった残り30例(C群)の臨床像をTable 2に示す.30例の在胎週数は28~42週(平均36週),出生体重は493~2,460 g(平均1,484 g)であった.30例中29例(97%)に,先天性心疾患を合併していた.心疾患および主な合併奇形の内訳はTable 2に示すとおりである.
Table 2 Characteristics and outcomes of patients in group C| Case | GW (weeks) | BW (g) | CHD | Extracardiac anomaly | Hospital discharge | Final status |
|---|
| 17 | 37 | 1488 | VSD | Agenesis of corpus callosum, Horseshoe kidney, Cerebellular hypoplasia | (−) | Death (2d) |
| 18 | 35 | 1103 | VSD+AS | Spina bifida, Horseshoe kidney | (−) | Death (1d) |
| 19 | 42 | 1688 | VSD | Cerebellular hypoplasia | 121d | Death (5m) |
| 20 | 40 | 1697 | (−) | Cerebellular hypoplasia | 112d | Alive (10y) |
| 21 | 40 | 1718 | VSD+PDA | Myelomeningocele | unknown | Unknown |
| 22 | 28 | 493 | VSD+PDA | Esophageal atresia, Horseshoe kidney, Cerebellular hypoplasia | (−) | Death (1d) |
| 23 | 29 | 821 | DORV+AVSD | Cerebellular hypoplasia | (−) | Death (0d) |
| 24 | 34 | 1614 | VSD | Diaphragmatic hernia | (−) | Death (0d) |
| 25 | 35 | 1286 | VSD+PDA | Malrotation of intestine, Cerebellular hypoplasia | (−) | Death (0d) |
| 26 | 37 | 1635 | VSD+PDA | Cerebellular hypoplasia | (−) | Death (5d) |
| 27 | 40 | 2460 | VSD+PDA | Polycystic kidney | (−) | Death (136d) |
| 28 | 40 | 2016 | DORV+PS | (−) | (−) | Death (159d) |
| 29 | 37 | 2086 | VSD+PDA | Myelomeningocele, Umbilical hernia | (−) | Death (0d) |
| 30 | 41 | 2458 | VSD | Cleft palate | (−) | Death (24d) |
| 31 | 30 | 647 | VSD | Umbilical hernia | (−) | Death (58d) |
| 32 | 35 | 1467 | VSD | Umbilical hernia, Micrognathia, Cerebellular hypoplasia | (−) | Death (10d) |
| 33 | 38 | 1609 | VSD+PDA | Gastroschisis, Cerebellular hypoplasia | (−) | Death (176d) |
| 34 | 28 | 635 | VSD+PDA | (−) | (−) | Death (12d) |
| 35 | 35 | 1417 | VSD+PDA | Cerebellular hypoplasia | 39d | Death (5m) |
| 36 | 34 | 1130 | VSD+PDA | Esophageal atresia | (−) | Death (2d) |
| 37 | 37 | 1584 | VSD+PDA | Hydronephrosis | 69d | Death (6m) |
| 38 | 36 | 1538 | VSD+PDA | Polydactyly | 61d | Death (5m) |
| 39 | 38 | 1940 | VSD+PDA | (−) | (−) | Death (17d) |
| 40 | 35 | 1042 | VSD | Myelomeningocele | (−) | Death (30d) |
| 41 | 41 | 2072 | VSD+PDA | (−) | 61d | Death (9m) |
| 42 | 37 | 1140 | CoA+VSD | (−) | (−) | Death (142d) |
| 43 | 35 | 1692 | CoA+AVSD | (−) | (−) | Death (3d) |
| 44 | 38 | 2165 | DORV+PDA | Umbilical hernia, Atresia ani | (−) | Death (30d) |
| 45 | 36 | 1194 | VSD | Esophageal atresia | 183d | Death (10 m) |
| 46 | 31 | 685 | VSD | (−) | (−) | Death (1d) |
| GW: Gestational week, BW: Birth weight, CHD: Congenital heart disease, VSD: Ventricular septal defect, PDA: Patent ductus arteriosus, DORV:double outlet right ventricle, AVSD: Atrioventricular septal defect, CoA: Coarctation of the aorta, AS: Aortic stenosis, PS: Pulmonary stenosis d: days, m: months, y: years |
2. A群の手術時日齢,術式,成績
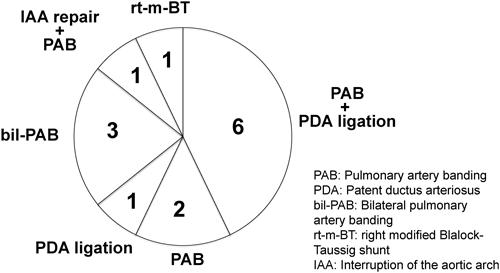
A群14例の手術時日齢は2~167日(平均32日,中央値25日),手術時体重は1,050~3,300 g(平均1,805 g)であった.心疾患の手術直前で人工呼吸管理を要していたのは14例中9例(64%)であった.(Table 1)手術術式の内訳をFigure 3に示す.全例姑息手術である.肺動脈絞扼術+動脈管結紮術6例,肺動脈絞扼術2例,動脈管結紮術が1例でこれらを合計すると全体の64%を占める.次いで両側肺動脈絞扼術が3例,大動脈弓再建+肺動脈絞扼術1例,修正Blalock–Taussig短絡術1例であった.なお体循環が動脈管に依存する左心系狭窄病変において両側肺動脈絞扼術を行う際には,動脈管がprostaglandin製剤を使用しない状態でも安定して開存していることを確認のうえ,手術を行った.3例とも術後も動脈管の閉鎖傾向はなく,prostaglandin製剤の投与を必要としなかった.A群14例で周術期死亡はなかった.
3. A群の術後経過および予後
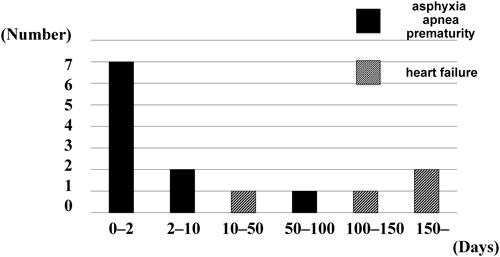
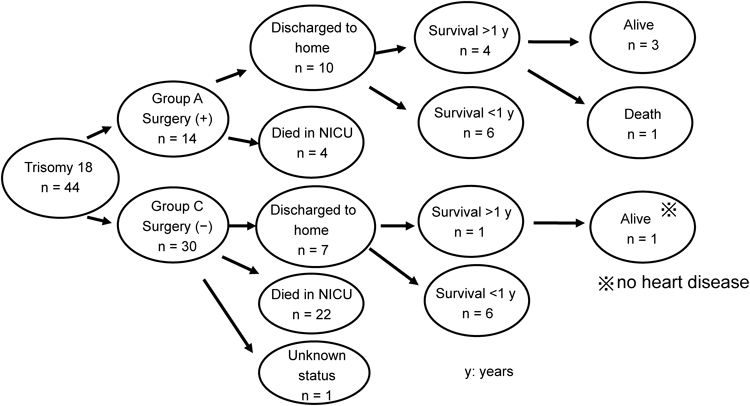
14例全例で術後心不全症状の改善が得られた.このうち10例(71%)は,術後1~25日(平均8.2日)で人工呼吸を離脱,体重増加が得られ,生後69~223(平均122日)で退院,在宅移行した.退院時,経腸栄養は全例で確立されており,気管切開や在宅人工呼吸管理を要した例はなかった.在宅酸素療法を要した例は10例中5例であった.在宅移行できた10例中3例は現在生存中(現在それぞれ2,2,8歳)であるが,残り7例は,退院後呼吸器感染等を契機に死亡している.1歳未満での死亡が6例,1歳以上での死亡が1例で,死亡例の在宅期間は4~550日(平均152日,中央値64日)であった(Table 1, Figure 4).
一方,A群のうち4例(症例2~5)は,退院できず生後57~219日(平均126日)で死亡した.いずれも消化管や呼吸器の合併疾患を有していた.これら4例では心疾患の姑息術により,心不全症状の改善は得られたものの,最終的には呼吸不全,消化管穿孔や敗血症など心疾患以外の原因で死亡している.症例4は左横隔膜弛緩症+肺低形成合併例,症例10は極端な小顎+四肢拘縮合併例で,いずれも呼吸不全で死亡した.症例6はA型食道閉鎖+低位鎖肛合併例で消化管穿孔から敗血症で死亡した.症例12はC型食道閉鎖+横隔膜ヘルニア合併例で,日齢1に気管食道瘻結紮術,胃瘻増設術,横隔膜ヘルニア修復術が実施されたが,消化管穿孔を合併し,最終的には呼吸不全で死亡した(Table 1).
4. B群(心内修復術例)の経過
心内修復術を行ったB群の2例(症例15,16)は,いずれも手術介入なしで他院をいったん退院後,心不全が増強し当院に紹介され,心内修復術を行った例である.症例15は心室中隔欠損,肺動脈弁狭窄の症例で,生後7ヶ月,体重4.1 kgで心内修復術(心室中隔欠損閉鎖,肺動脈弁交連切開術)が実施された.症例16は心室中隔欠損で18トリソミーモザイク症例である.生後2ヶ月時に当院で肺動脈絞扼術を実施したが,その後も心不全症状が強く生後5ヶ月時に心臓カテーテル検査を実施し,高度の肺高血圧はなく,体重3.7 kgで心内修復術が施行された.2例とも術後経過は良好で,術前に比べ心不全症状の改善が得られ,経口栄養も確立し,自宅で安定した生活を送っている.現在それぞれ4歳と3歳に達し,心エコー上明らかな肺高血圧の所見もなく,比較的長期生存が得られている(Table 1).
5. C群の経過
心疾患に対し手術介入を行わなかったC群30例中,22例はNICUを退院できず死亡している.1例は転院後,経過不明で,残り7例(23%)が在宅移行していた.退院後の7例の経過であるが,1例を除き全例1歳未満で死亡している.なおこの生存の1例(症例20)は心疾患を合併していなかった(Figure 4, Table 2).
不明の1例を除くC群の生存期間の中央値は24日であった.なお人工呼吸管理を含めた集中治療を行わない方針であった2004年までに限ると生存期間の中央値は7.5日であった.
6. 心疾患に対する手術介入の有無による在宅移行率,生命予後の比較
調査期間中当院NICUに入院した44例のうち,心疾患への手術介入を行ったのが14例(A群),行わなかったのが30例であった(C群).手術介入の有無による在宅移行率,生命予後をFigure 4に示す.なおB群2例は手術介入なしで他院をいったん退院し,その後心不全が増強し当院で心内修復術を行った例で,当院のNICU退院,在宅医療への移行という過程を経ていないのでこの検討には含まれていない.前述のように心疾患への手術介入を行ったA群14例中10例(71%)が在宅移行した.一方,手術を受けなかったC群でも30例中7例(23%)が在宅移行していたが,心疾患非合併の1例を除き全例1歳未満で死亡していた(Figure 4, Table 2).
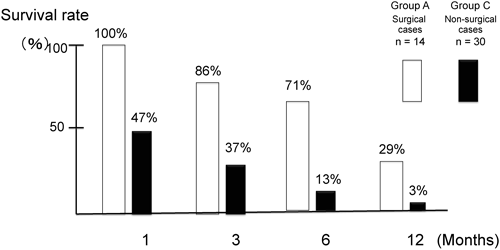
NICU入院例44例の経時的な生存率をFigure 5に示す.手術例(A群)では生後1,3,6,12ヶ月での生存率は100,86,71,29%であった.一方非手術例(C群)では生後1,3,6,12ヶ月での生存率は47,37,13,3%であった(Figure 5).生存期間の中央値は非手術例(C群)で24日に対し,手術例(A群)で234日であった.
7. 主要症例の提示(Table 1)
1)症例3:A群 在宅移行例
診断:心室中隔欠損,動脈管開存,小脳低形成.
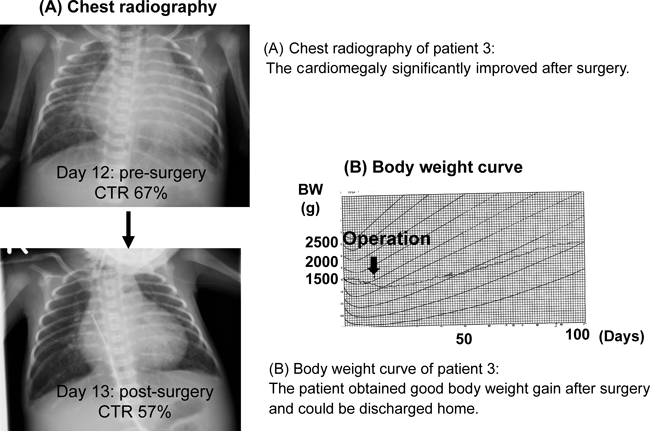
胎児エコーで小脳低形成を指摘され,羊水染色体検査で18トリソミーと診断された.在胎39週4日,1,521 gアプガールスコア 1分6点 5分9点で出生した.出生時,自発呼吸は確立していたが,日齢2に心不全のため肺出血を起こし人工呼吸管理となった.動脈管閉鎖を目的にindometacin療法を2クール受けたが無効で,胸部レントゲン写真上も心拡大と肺血管陰影の増強が続き,経腸栄養が十分進まない状況であった.両親と相談のうえ,日齢13に肺動脈絞扼術(体重1,389 g,絞扼周囲長18 mm)と動脈管結紮術が実施された.日齢18に抜管後呼吸状態は安定し,経管栄養で体重増加も得られるようになり,日齢142に体重2,440 gで退院した(Figure 6).退院時酸素療法は不要であった.退院後は比較的安定していたが,生後8ヶ月時に肺炎で入院した.血液検査上は軽度の脱水所見のみで重症細菌感染を示唆する所見はなかった.輸液,酸素投与など対処療法が行われたが,入院2日目に呼吸不全が急速に進行し死亡した.なお家族との話し合いで人工呼吸管理は実施されなかった.
2)症例2:A群 在宅移行,長期生存例
診断:心室中隔欠損,動脈管開存,小脳低形成,18トリソミーモザイク.
在胎37週1日,2,597 gアプガールスコア 1分4点 5分7点で出生した.新生児一過性多呼吸のため人工呼吸管理となったが,日齢7に離脱した.胸部レントゲン写真上,心拡大と肺血管陰影の増強が続き,動脈管閉鎖を目的にindometacin療法を2クール受けたが無効で,日齢14に動脈管結紮術が実施された.日齢16に抜管後呼吸状態は安定し,経口栄養が確立され,日齢77に体重2,663 gで退院した.退院時酸素療法は不要であった.出生後の染色体検査で18トリソミーモザイクと判明した.その後在宅療養を行っていたが,生後3ヶ月頃より多呼吸の増悪,哺乳不良が出現し両親と相談のうえ,生後6ヶ月時に肺動脈絞扼術(体重3.2 kg,絞扼周囲長23 mm)が実施された.術後誤嚥性肺炎や麻痺性イレウスを合併し長期入院となったが,最終的には改善し,全量経口哺乳も可能となり1歳時に退院した.その後は他院にて経過観察中であるが,胃食道逆流,嚥下障害,高度の側弯があり6歳時に肺炎の重症化から気管切開のうえ在宅人工呼吸管理が開始された.発達状況は一時寝返りも可能であったが,現在は痙攣の影響もあり寝たきりである.8歳時の心エコーでは,心室中隔欠損は10.4 mm両方向短絡(左右有意)で,肺動脈絞扼部径は4.4 mm,ドプラによる推定圧較差は86 mmHgであった.両心室の収縮能は良好であった.
3)症例6:A群 病院死亡例
診断:心室中隔欠損,大動脈縮窄,動脈管開存,A型食道閉鎖,低位鎖肛.
胎児エコーで羊水過多,心奇形を指摘され,羊水染色体検査で18トリソミーと診断された.在胎35週6日,1,527 gアプガールスコア 1分5点 5分5点で出生した.新生児呼吸窮迫症候群のため,人工呼吸管理およびサーファクタント投与を受けた.心疾患および消化器疾患については当初は外科的処置を行わない方針であった.しかしその後呼吸状態が安定したため,経腸栄養の確立のため,両親と相談のうえ,日齢17に胃瘻造設および肛門形成術が実施された.術後経過は良好で経腸栄養は確立されたが,心不全のためミルク増量に伴い呼吸状態の悪化を認めた.一方,動脈管についてはprostaglandin製剤を使用しない状態でも安定して開存していた.両親と話し合いのうえ,日齢42に両側肺動脈絞扼術が実施された.その後も動脈管は安定して開存し,心不全症状は軽減し,ミルクの増量が可能となり在宅移行を目指していた.しかし,日齢60に消化管穿孔による敗血症性ショックで急変,死亡した.
4)症例15:B群 心内修復術例
診断:心室中隔欠損,肺動脈弁狭窄,小脳低形成.
在胎41週1日,出生体重2,820 gで他院にて出生,特徴的な身体所見(手指の重なり,揺り椅子状の足)から,染色体検査が実施され18トリソミーと診断された.自発呼吸,経口栄養は確立され,生後2ヶ月で他院を退院したが,その後肺血流増加による心不全症状が進行し,生後7ヶ月時には呼吸器感染を契機に人工呼吸管理を要する状態となった.心エコー上ドプラによる肺動脈狭窄の圧較差は75 mmHgで高度の肺高血圧はないと判断し,両親と相談のうえ,生後7ヶ月,体重4.1 kgで心内修復術(心室中隔欠損閉鎖,肺動脈弁交連切開術)が実施された.術後3日で人工呼吸離脱するも,心嚢液貯留があり再ドレナージ術施行.その後の経過は順調で術後50日で退院した.退院後は術前に比べ心不全症状の改善が得られ,現在4歳に達し,経口栄養も確立し,自宅で安定した生活を送っている.心エコー上明らかな肺高血圧の所見もなく,無呼吸のため夜間のみ在宅酸素療法を受けている.現在の発達状況は寝返りが可能である.
5)症例16:B群 心内修復術例
診断:心室中隔欠損,多指症,18トリソミーモザイク.
在胎41週0日,出生体重2,046 gで他院にて出生.呼吸状態や哺乳に問題なく,生後12日で他院を退院した.その後肺血流増加の心不全症状が進行し,当院に紹介され,生後2ヶ月時に当院で肺動脈絞扼術(体重2.4 kg,絞扼周囲長20 mm)を実施した.その際の染色体検査で18トリソミーモザイクと判明した.外来経過観察可能となったが,その後も心不全症状が強く,生後5ヶ月時に心臓カテーテル検査が施行された.肺体血流量比1.91,肺動脈圧45/27(35)mmHg,肺体収縮期血圧比0.64,肺血管抵抗4.3単位・m2であった.この結果を踏まえ,両親と相談のうえ,生後5ヶ月,体重3.7 kgで心内修復術が施行された.術後経過は良好で,術後3日で抜管,術後13日で退院した.その後は術前に比べ心不全症状の改善が得られ,現在3歳に達し,経口栄養も確立し,自宅で安定した生活を送っている.心エコー上明らかな肺高血圧の所見もない.現在の発達状況は,伝い歩きが可能である.
18トリソミーでは生存期間の中央値は10~14.5日,1年生存率は5~10%とその生命予後は不良であり,従来は積極的な治療は行われてこなかった.また先天性心疾患を高率に合併するが,主たる死因は心疾患ではなく中枢性無呼吸であり,心臓手術は生命予後を改善しないであろうとされてきた1–3).本邦でもいわゆる仁志田らのクラス分け(新生児医療における倫理的観点からの意思決定)において,18トリソミーはクラスCに分類され,現在行っている以上の治療を行わず,一般養護に徹するとする考え方が主流であった4).しかし18トリソミーの出生後の経過には個人差があり,稀ながら長期生存の報告もある5–8).近年は18トリソミーという病名での画一的な対応ではなく,個々の症例に応じた対応が求められつつある.田村らは「重篤な疾患を持つ新生児の家族と医療スタッフの話し合いのガイドライン」を提唱し,近年は看取りの医療から児の状況に合わせた最善の治療を提供すべく,両親と話し合って方針を決定する考え方が広がりつつある9).AHAの新生児蘇生のガイドラインでも18トリソミーは蘇生を差し控える対象から除外されている10).18トリソミーに対して生存率や在宅移行率の向上を念頭に,気管内挿管による蘇生を含めた集中治療を行った報告が散見される11–13).Koshoらは18トリソミー24例に対して帝王切開(67%),気管内挿管による蘇生(63%),心疾患を除く外科手術(42%)を含む集中治療を行い,1ヶ月の生存率が83%に上昇し生存退院が21%であったと報告している.しかし,この報告では心疾患の手術は行われておらず,死亡に関連した因子は心疾患が96%であったとされている11).以上のような経過を踏まえ,18トリソミーの心疾患に対する手術介入の報告も散見されるようになり,心不全症状の改善や在宅移行率の向上が報告されている14–20).Grahamらは18トリソミー24例,13トリソミー11例に対し,心内修復術21例,姑息術後心内修復術4例,姑息術10例を行い,生存退院が91%であったと報告し,心内修復術を中心にした心疾患への手術介入の有効性を述べている.また術前の人工換気日数2日以下が退院時の人工換気不要と関連があったと報告している14).Kanekoらは18トリソミー17例に対し,心内修復術3例,姑息術後心内修復術4例,姑息術10例を行い,手術死亡は1例のみで生存退院が82%であったと報告している.術後平均生存日数179日で心不全死は1例のみで,感染症が死因の最多(44%)となり,心疾患への手術介入は心不全死を予防するのに有効であると結論している.また,1歳以上生存はすべて初回が姑息術であったこと,退院後の死因は心不全が1例のみで,姑息術の効果を述べている17).本邦の多施設共同研究では,先天性心疾患を合併した18トリソミー127例中34例(27%)に手術介入が行われている.手術の内訳は姑息術23例(68%),開心術は6例(18%)のみで,不明が5例であった.手術後1ヶ月以内の死亡は2例のみであった.19例(56%)が生存し,手術群は非手術群に比べ明らかに生存率が高かったと報告している.手術例には,心疾患および心外合併症が比較的軽度で,元来予後良好な例が多く集積されている可能性が考えられ,心臓手術が長期的な生命予後を改善するかは不明であるが,心外合併症が比較的軽度で全身状態が良好な例では心臓手術が考慮されうるとしている18).Muneuchiらは心疾患への手術介入により,生存率の改善は得られたが,在宅移行は生存者の55%にとどまり,人工呼吸管理を要する児などの在宅移行支援の問題を述べている20).
今回,我々は当院で先天性心疾患に対して心不全症状の改善や在宅移行を目的に姑息術を中心とした手術介入を行った18トリソミー16例を検討したが,周術期死亡はなく,全例で術後心不全症状の改善が得られた.このうちA群14例はNICU入院中に在宅移行を目的に姑息術を行った例である.心疾患の手術直前で人工呼吸管理を要していたのは14例中9例(64%)であった.14例中10例(71%)は,生後平均122日で退院,在宅移行した.退院時,経腸栄養は全例で確立されており,気管切開や在宅人工呼吸管理を要した例はなかった.在宅酸素療法を要した例は10例中5例であった.A群14例の生存率は生後1,3,6,12ヶ月で100,86,71,29%となっており,従来の18トリソミーの報告1–3)に比べ明らかに高かった.在宅移行後もこの間比較的安定し,自宅で家族と貴重な時間を過ごせた.またNICU入院例の生存期間の中央値は,非手術例(C群)で24日に対し手術例(A群)で234日であった.手術介入を行った例には全身状態が比較的良好な例が多く含まれている可能性があり単純には比較できないが,心疾患に対する姑息術は,心不全症状の改善や在宅移行率の向上に寄与すると考える.一方,A群14例中4例は,退院できず死亡した.いずれも消化管や呼吸器の合併疾患を有していた.これら4例では心疾患の姑息術により,心不全症状の改善は得られたものの,最終的には呼吸不全,消化管穿孔や敗血症など心疾患以外の合併疾患が原因で死亡した.心疾患への手術介入については,心疾患以外の合併奇形の重症度や児の全身状態を考慮し決定する必要がある.
次に,姑息術を行い在宅移行できた10例中3例は現在生存中であるが,残り7例は,退院後呼吸器感染等を契機に死亡している.1歳未満での死亡が6例,1歳以上での死亡が1例で,死亡例の在宅期間は4~550日(平均152日,中央値64日)であった.12ヶ月時の生存率は29%と急速に低下し,従来の報告(5~10%)1–3)より高いものの,必ずしも1歳を超えての中長期予後の改善にはつながっていない.
一方,B群2例は,手術介入なしでいったん他院を退院後,心不全が増強し当院に紹介され心内修復術を行った例である.術後経過は良好で,現在それぞれ4歳と3歳に達し,経口栄養も確立し,術前に比べ心不全症状の改善が得られ,自宅で安定した生活を送っている.この2例は心疾患以外の重大な合併奇形もなく,もともと全身状態も良好な症例で心内修復術を行ったが,心エコー上明らかな肺高血圧の所見もなく,比較的長期生存の可能性も考えられる.現在18トリソミーの心疾患に対する当院の方針としては,在宅移行を最大の目標とし姑息術を中心に介入を行っているが,姑息術による心不全症状の改善が限定的な例や,肺動脈絞扼術後長期となった例などで,全身状態が手術に耐えうると判断される患者については,心内修復術についても考慮すべきであると考えている.
以上より,心疾患の手術により心不全症状の改善が得られ,在宅移行が可能となる症例が存在することから,18トリソミーの心疾患に対する手術介入は,症例によっては治療の選択肢の一つとなりうると考える.一方,18トリソミーにおいては肺血管閉塞性病変が早期に出現し,手術後も改善しない例があると報告されており21–23),現時点では心疾患に対する手術介入により,長期的な生命予後の改善がもたらされうるか否かは不明である.姑息術か心内修復術かの選択,手術時期の決定,心疾患以外の合併奇形を持つ症例に対する対応など,検討すべき課題は多く,今後の症例の蓄積が待たれる.18トリソミーの心疾患に対する治療方針については,今後このような情報を新生児科医や産婦人科医,患者家族にもフィードバックし,それを基に十分な話し合いを行い,個々の症例の状況に応じた対応を行うことが重要であると考える.
引用文献References
1) Embleton ND, Wyllie JP, Wright MJ, et al: Natural history of trisomy 18. Arch Dis Child Fetal Neonatal Ed 1996; 75: F38–F41
2) Rasmussen SA, Wong LYC, Yang QY, et al: Population-based analysis of mortality in trisomy 13 and trisomy 18. Pediatrics 2003; 111: 777–784
3) 古庄知己:18トリソミーの自然歴およびマネジメントの確立をめざして.日小児会誌 2010; 114: 637–645
4) 仁志田博司,山田多佳子,新井敏彦,ほか:新生児医療における倫理的観点からの意志決定(Medical Decision Making).日新生児会誌 1987; 23: 337–341
5) 梶原眞人,手島千鳥,宮崎貴史,ほか:10歳を迎えた18トリソミーの1女児例.日小児会誌 2004; 108: 1230–1233
6) Van Dyke DC, Allen M: Clinical management considerations in long-term survivors with trisomy 18. Pediatrics 1990; 85: 753–759
7) Baty BJ, Blackburn BL, Carey JC: Natural history of trisomy 18 and trisomy 13: I. Growth, physical assessment, medical histories, survival, and recurrence risk. Am J Med Genet 1994; 49: 175–188
8) Kosho T, Kuniba H, Tanikawa Y, et al: Natural history and parental experience of children with trisomy 18 based on a questionnaire given to a Japanese trisomy 18 parental support group. Am J Med Genet A 2013; 161A: 1531–1542
9) 田村正徳:重篤な疾患を持つ新生児の家族と医療スタッフの話し合いのガイドライン.日小児会誌 2004; 108: 1095–1107
10) American Heart Association, American Academy of Pediatrics: 2005 American Heart Association (AHA) guidelines for cardiopulmonary resuscitation (CPR) and emergency cardiovascular care (ECC) of pediatric and neonatal patients: Neonatal resuscitation guidelines. Pediatrics 2006; 117: e1029–e1038
11) Kosho T, Nakamura T, Kawame H, et al: Neonatal management of trisomy 18: Clinical details of 24 patients receiving intensive treatment. Am J Med Genet A 2006; 140A: 937–944
12) 岩見裕子,寺田明佳,松村寿子,ほか:当センターにおける18トリソミー児に対する積極的医療介入による治療と予後の変遷.日未熟児新生児会誌 2011; 23: 95–100
13) Nishi E, Takamizawa S, Iio K, et al: Surgical intervention for esophageal atresia in patients with trisomy 18. Am J Med Genet A 2013; 164A: 324–330
14) Graham EM, Bradley SM, Shirali GS, et al: Pediatric cardiac care consortium: Effectiveness of cardiac surgery in trisomies 13 and 18 (from the pediatric cardiac care consortium). Am J Cardiol 2004; 93: 801–803
15) 寺口正之,野木俊二,池本裕実子,ほか:18トリソミーに合併した心疾患の治療と予後.日小児会誌 1998; 102: 592–596
16) 鈴木恵美子,大嶋義博,土肥善郎:13トリソミーまたは18トリソミーに対する開心術の経験.日小児循環器会誌 2008; 24: 546–554
17) Kaneko Y, Kobayashi J, Achiwa I, et al: Cardiac surgery in patients with trisomy 18. Pediatr Cardiol 2009; 30: 729–734
18) 前田 潤,山岸敬幸,新垣義夫,ほか.平成17~19年度研究課題報告18および13トリソミーの心表現型・遺伝子型と予後.日小児循環器会誌 2009; 25: 216–220
19) Yamagishi H: Cardiovascular surgery for congenital heart disease associated with trisomy 18. Gen Thorac Cardiovasc Surg 2010; 58: 217–219
20) Muneuchi J, Yamamoto J, Takahashi Y, et al: Outcomes of cardiac surgery in trisomy 18 patients. Cardiol Young 2011; 21: 209–215
21) 城尾邦隆:症候群と先天性心疾患:染色体異常から単一遺伝子病へ.日小児循環器会誌 2010; 26: 4–18
22) Van Praagh S, Truman T, Firpo A, et al: Cardiac malformations in trisomy-18: a study of 41 postmortemcases. J Am Coll Cardiol 1989; 13: 1586–1597
23) 田原昌博,本田 茜,下薗彩子,ほか:高肺血流性心疾患を伴う18トリソミーの肺生検所見.日小児会誌 2013; 117: 1260–1266