消化管閉鎖に先天性心疾患(CHD)を合併する場合には先行手術,術式の選択など外科的治療戦略が重要になる.また,染色体異常や奇形症候群などの合併も多く,治療に難渋することが多い.
消化管閉鎖合併の先天性心疾患の現状と今後の課題を明らかにするために,自験例を後方視的に検討した.
1979年1月から2011年12月までの32年間に当センターに入院し,治療を受けた消化管閉鎖442例を対象とした.
診療録より,①消化管閉鎖の内訳,消化管閉鎖のCHD合併率,②消化管閉鎖に合併するCHDの内訳,③消化管閉鎖のCHDの有無における出生年代別の死亡率,④CHD合併群の手術時期,⑤CHD合併群の予後不良因子,死亡症例(生後1年以内)について後方視的に検討した.
消化管閉鎖は食道閉鎖,十二指腸閉鎖,腸閉鎖,鎖肛に分類し,これらを複数合併する場合は,重複合併疾患とした.狭窄は閉鎖に含め,腸閉鎖は新生児壊死性腸炎を除いた小腸・大腸閉鎖とした.
合併した心疾患が多岐にわたり,その病態によって手術戦略が異なるために,A群:肺血流増加群:心室中隔欠損(VSD),心房中隔欠損(ASD),動脈管開存症(PDA)など,B群:肺血流減少群:ファロー四徴症(TOF),肺動脈閉鎖/心室中隔欠損(PA/VSD)など,C群:生後早期よりチアノーゼと肺血流増加を伴うことが多く,新生児期に手術を要する複雑心奇形:単心室(SV),左心低形成症候群(HLHS)など,D群:その他に分類した.
さらに,手術の年代が死亡率に影響を与えること考慮し,出生年代を,Ⅰ期:1979~1989年,Ⅱ期:1990~2000年,Ⅲ期:2001~2011年に区切り,出生年代別の死亡率を検討した.
2群間の比較として,数量データにはt検定,質的データにはフィッシャーの直接確率法,重回帰分析にはロジスティック回帰分析を用いた.有意水準は5%としp<0.05を統計学的有意差ありと判断した.
1. 消化管閉鎖の内訳,消化管閉鎖のCHD合併率(Table 1)
消化管閉鎖442例の内訳は,食道閉鎖69例(16%),十二指腸閉鎖61例(14%),腸閉鎖91例(20%),鎖肛206例(47%),重複合併疾患15例(3%)であった.重複合併の内訳は,食道閉鎖+鎖肛12例,鎖肛+十二指腸閉鎖1例,鎖肛+腸閉鎖1例,食道閉鎖+十二指腸閉鎖+鎖肛1例であった.
消化管閉鎖442例におけるCHDの合併は76例(17%)であった.各疾患におけるCHDの合併は,食道閉鎖19例(28%),十二指腸閉鎖15例(25%),腸閉鎖11例(12%),鎖肛23例(11%),重複合併疾患8例(53%)であり,食道閉鎖,十二指腸閉鎖,重複合併疾患で合併率は高い傾向にあった.
Table 1 Details of the congenital anomalies of the gastrointestinal tract | Number of co-existing CHD/total cases (%) |
|---|
| Esophageal atresia | 19/69 (28%) |
| Duodenal atresia | 15/61 (25%) |
| Intestinal atresia | 11/91 (12%) |
| Anorectal anomaly | 23/206 (11%) |
| Overlapping anomalies | 8/15 (53%) |
| Total | 76/442 (17%) |
2. 消化管閉鎖に合併するCHDの内訳(Table 2)
CHDは,A群53例,B群13例,C群7例,D群3例に分類された.その内訳は,A群では,VSD 20例,PDA 9例,VSDとASDやPDAの合併が9例,ASD 6例,大動脈縮窄(CoA)5例などが占めていた.また,B群では,TOF 9例,PA/VSD 3例などが多かった.消化管閉鎖の各疾患とCHDの内訳にVATER連合や21トリソミーなどの特徴的な関連はなかった.
Table 2 Details of co-existing CHD| Group A (N=53) | VSD 20, PDA 9, VSD+(ASD and/or PDA) 9, ASD 6, CoA (+VSD) 5, AVSD 2, DORV 2 |
| Group B (N=13) | TOF 9, PA/VSD 3, DORV+PS 1 |
| Group C (N=7) | SV 2, HLHS 2, TA 1, TAC 1, TGA 1 |
| Group D (N=3) | HCM 1, PS 1, not detailed 1 |
| VSD: ventricular septal defect, PDA: patent ductus arteriosus, ASD: atrial septal defect, CoA: coarctation of the aorta, AVSD: atrioventricular septal defect, DORV: double outlet right ventricle, TOF: tetralogy of Fallot, PA: pulmonary atresia, PS: pulmonary stenosis, SV: single ventricle, HLHS: hypoplastic left heart syndrome, TA: tricuspid atresia, TAC: truncus arteriosus communis, TGA: transposition of great arteries, HCM: hypertrophic cardiomyopathy. |
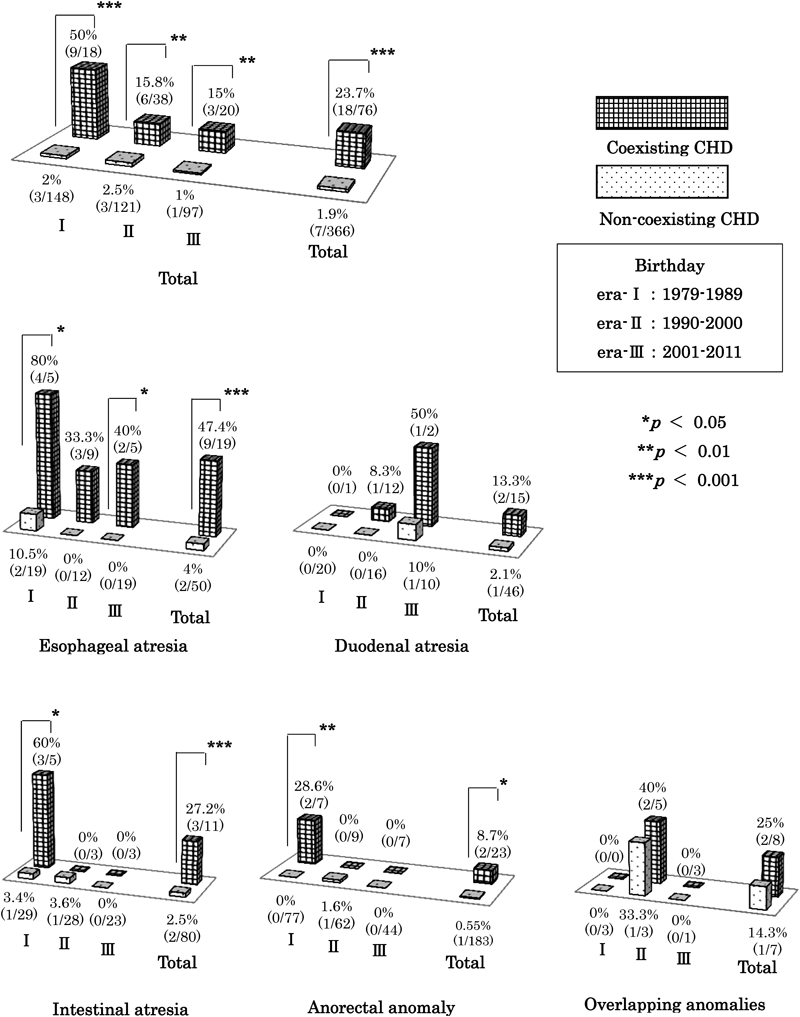
3. 消化管閉鎖のCHDの有無における,出生年代別の死亡率(Fig. 1)
消化管閉鎖全体では,Ⅰ,Ⅱ,Ⅲ期すべての年代において,CHD合併群は非合併群より有意に死亡率は高かった(順にp<0.001,p<0.01,p<0.01).
次に,消化管閉鎖の疾患別に,同様の検討をした.食道閉鎖,腸閉鎖,鎖肛はI期でCHD合併群が非合併群より,有意に死亡率が高かった(順にp<0.05,p<0.05,p<0.01).腸閉鎖,鎖肛はⅡ期,Ⅲ期ではCHD合併群に死亡例がなかった.一方,食道閉鎖は,Ⅲ期でもCHD合併群が非合併群と比較して,有意に死亡率が高く(p<0.05),食道閉鎖にCHDを合併した場合は,現在も予後不良であった.
4. CHD合併群の手術時期
CHD合併群76例の中で,消化管手術先行は69例,心臓手術先行は4例,手術未施行は3例であり,消化管手術先行例が多かった.
CHDの疾患別では,A群53例は,消化管手術先行は47例,心臓手術先行は4例,手術未施行は2例であった.一方,B群13例は,全て消化管手術が先行されていた.C群7例は,手術未施行1例を除いて,消化管手術が先行されていた.D群3例も,全て消化管手術が先行されていた.
5. CHD合併群の予後不良因子(Table 3),死亡症例(Table 4)
CHD合併群76例の中で,生存は58例,死亡は18例であった.重回帰分析では,18トリソミー合併例が死亡例には多かった(p<0.05).しかし,多発奇形の合併や,血行動態の安定のために生後1ヵ月以内に心臓手術を必要とする症例が死亡例で多いという結果にはならなかった.なお,今回の検討では,13トリソミーの合併例は含まれていなかった.
18トリソミー合併6例を除き,CHD合併群70例で検討したところ,重回帰分析では,食道閉鎖の合併が死亡例には有意に多かった(p<0.05).
Table 3 Outcome and related clinical characteristics | Alive
(N=58) | Death (including trisomy 18)
(N=18) | p value(1) | Death (except trisomy 18)
(N=12) | p value(2) |
|---|
| Birth weight (g) (mean±S.D.) | 2359±642 | 2039±549 | 0.30 | 2200±371 | 0.53 |
| trisomy 18 | 0 | 6 | 0.03* | — | — |
| trisomy 21 | 13 | 0 | 0.73 | 0 | 0.38 |
| Multiple anomalies※ | 22 | 10 | 0.83 | 4 | 0.71 |
| Co-existing EA | 15 | 11 | 0.08 | 7 | 0.03* |
| Earlier operation of CHD※※ | 11 | 4 | 0.49 | 3 | 0.38 |
| EA: Esophageal atresia. * p<0.05. ※ renal anomaly, limb anomaly, inguinal hernia, undescended testis, etc. ※※ The cases of operation performed before 31 days. (1) Logistic regression analysis: Alive vs Death including trisomy 18. (2) Logistic regression analysis: Alive vs Death except trisomy 18. |
Table 4に死亡症例の詳細をCHDの疾患別に,出生年代の順に示す.
Table 4 Profiles of death cases | No. | Intestinal disorders | CHD | Birthyear | Birth weight (g) | Chromosomal disorders | Initial operations | Second Operations | Age at death (the cause of death) |
|---|
| Group A | 1 | IA | VSD | era-I 1980 | 3120 | trisomy 18 | Digestive (day3) membrane resection | none | day12
(thorombocytopenia) |
| 2 | EA+Omphalocele | VSD+PDA | era-I 1984 | 1380 | trisomy 18 | Digestive (day0) Gastrostomy+definitive repair | Cardiac (day8) PAB+PDA ligation | 4m
(heart failure) |
| 3 | EA | VSD+ASD | era-I 1987 | 1880 | trisomy 18 | Digestive (day0, day23) gastrostomy, TEF ligation | none | 1m
(heart failure) |
| 4 | AA | PDA | era-I 1987 | 1604 | none | Digestive (day3) stoma | none | day21
(sepsis) |
| 5 | EA
(VATER association) | VSD+PDA | era-II 1990 | 1655 | none | Digestive (day0) gastrostomy | none | day2
(IVH) |
| 6 | DA | CoA+VSD | era-II 1997 | 2585 | none | Cardiac (day10) arch repair | none | day10
(table death) |
| 7 | EA | VSD+ASD | era-II 2000 | 1498 | trisomy 18 | none | none | day3
(respiratory failure) |
| 8 | EA | DORV | era-III 2007 | 1033 | trisomy 18 | Digestive (day0) gastrostomy | none | day11
(heart failure) |
| 9 | DA | VSD | era-III 2010 | 1550 | trisomy 18 | none | none | not detailed
(peritonitis) |
| Group B | 10 | EA | PA+VSD | era-I 1981 | 1980 | none | Digestive (day0) gastrostomy | none | day11
(heart failure) |
| 11 | IA | TOF | era-I 1983 | not detailed | none | Digestive (day0) stoma | none | 1y
(heart failure) |
| 12 | IA | TA | era-I 1984 | 2340 | none | Digestive (day1) stoma | Cardiac (1m) BT shunt | 1m
(peritonitis) |
| 13 | Overlapping
(EA+AA) | PA+VSD | era-II 1993 | 2210 | none | Digestive (day4, 1m) gastrostomy+cut back, definitive repair | Cardiac (3m) BT shunt | 1y
(heart failure) |
| 14 | Overlapping
(EA+AA) | TOF | era-II 1995 | 2580 | none | Digestive (day1) gastrostmy+stoma | none | 4m
(sepsis) |
| Group C | 15 | AA | TAC | era-I 1980 | 2000 | none | none | none | day29
(heart failure) |
| 16 | EA | HLHS | era-I 1981 | 2670 | none | Digestive (day1, day5) gastrostomy, definitive repair | none | day5
(heart failure) |
| 17 | EA | TGA | era-II 1993 | 2080 | none | Digestive (day0, day2) gastrostomy, definitive repair | Cardiac (2m) Senning | 1y
(sepsis) |
| 18 | EA | HLHS | era-III 2008 | 2500 | none | Digestive (day0) gastrostomy | Cardiac (day1) bil PAB | day1
(table death) |
| IA: intestinal atresia, EA: esophageal atresia, AA: anorectal anomaly, DA: duodenal atresia, CHD: congenital heart disease, VSD: ventricular septal defect, PDA: patent ductus arteriosus, ASD: atrial septal defect, CoA: coarctation of the artery, DORV: double outlet right ventricle, PA: pulmonary atresia, TOF: tetralogy of Fallot, TA: tricuspid atresia, TAC: truncus arteriosus communis, HLHS: hypoplastic left heart syndrome, TGA: transposition of great arteries, TEF: tracheo-esophageal fistula, PAB: pulmonary artery banding, BT: Blalock-Taussig, bil PAB: bilateral PAB, IVH: intraventricular hemorrhage. |
まず,A群における18トリソミー合併6例(症例1~3, 7~9)では,いずれの手術も未施行が2例,消化管手術のみが3例と積極的な手術は控える傾向にあった.症例4, 11, 12, 15は出生時期がⅠ期で,食道閉鎖以外の症例であった.症例6は,血行動態が不安定なために,心臓手術を先行させたが,消化管手術を施行する前に,術中死していた.A群の1例(症例5),B群の3例(症例10, 13, 14),C群の3例(症例16, 17, 18)の合計7例が食道閉鎖の症例であった.なお,食道閉鎖は症例13のみGross A型であり,その他の6例はGross C型で,long gap症例は含まれていなかった.
1. 基本的な治療戦略
消化管閉鎖を合併するCHDの検討は,現在までいくつもの報告がある1–4).
消化管閉鎖を合併した場合はCHDの合併率は高く,消化管閉鎖の手術に先がけて,心エコー検査による心疾患のスクリーニングを施行することが治療成績の向上に寄与してきたと考えられる.新川ら1)は今回と同様の検討において,1990年前後で死亡率の改善を認めており,心疾患のスクリーニングの重要性を挙げている.今回の検討でも,消化管閉鎖の各疾患におけるCHD合併率は今までの報告とほぼ同様の結果であり,新川ら1)の報告と同様の時期に,CHD合併群の死亡率がⅠ期の50%からⅡ期の15.8%と改善していた.
心臓手術と消化管手術のどちらを先行するかは,肺血流増加に伴う呼吸不全や循環不全がコントロールできるのであれば,基本的には消化管手術を先行させる方針で良いと思われる5).新川らの報告1)によれば,十二指腸閉鎖,腸閉鎖,鎖肛などの消化管閉鎖を合併する心疾患において,心疾患の治療が緊急を要しない場合は,まず消化管手術を行って腸管減圧を図り,その後心臓手術を行う方針とされている.また,内科治療により循環動態が安定している限り,消化管手術を先行させてもリスクはないという報告もある3,6–8).今回の検討でも,ほとんどの症例において消化管手術が先行されていた.しかし,心臓手術が未施行で血行動態が不安定な状態での消化管の緊急手術は危険性が高く,予後を悪化させる因子9)になっており,できる限り回避する必要がある.
また,今回の検討では検証が不十分であったが,胎児診断の進歩によりそれ以前には生直後で死亡していたと思われる複雑心奇形や肺静脈狭窄などの重症心疾患に対し出生24時間以内の超緊急の心臓手術が増えてきており,今後手術のタイミングやアプローチが問題となる症例が出てくると予想される3,10,11).
2. 食道閉鎖に対する治療戦略
食道閉鎖の手術には,早期に気管食道瘻切離と食道吻合を行う一期的修復術,初回手術では胃瘻造設のみを行い,のちに一期的食道吻合を行う遅延的一期的修復術,あるいは胃瘻造設と同時に気管食道瘻切離あるいは食道バンディングを行い,のちに食道吻合を行う多段階手術がある.術式の多様性に加え,CHD合併例では,術後の食道縫合不全や,縦隔炎のリスクも上がる.さらに,気管食道瘻の存在や,食道縫合不全を避けるための術後の深鎮静による呼吸器合併症などが挙げられる.
以前,Waterson分類12)では,低出生体重児,先天奇形,呼吸器合併症は予後不良因子とされていた.しかし,近年では周産期医療の発達により肺合併症が減少し,出生体重1,500 g未満と重症心奇形の合併の有無で分けたSpitz分類13)でリスクを評価している.また,Diatzら14)は麻酔の視点から,特に動脈管依存性の心疾患の場合,高い合併症率と死亡率を指摘している.食道閉鎖の治療成績は近年飛躍的に向上し,極低出生体重児,重症心奇形,18トリソミーなどの重症染色体異常のハイリスク症例を除けばほぼ全例が救命されるまでになった15)が,今回の検討でも示された通り,食道閉鎖にCHDを合併する場合は,現在も治療成績は不良である.
気管食道瘻は呼吸管理上,重大な問題となり,上下の盲端が離れているlong gap症例では大侵襲の食道再建術を要する.黒田ら4)は,生直後の生理的な肺高血圧により肺血流量が増えない時期に,気管食道瘻の切離など呼吸管理で必須の処置を完了し,可能であれば根治的な食道修復まで施行する治療戦略を提唱している.新川らの報告1)でも,食道閉鎖を合併する心疾患においては,気管食道瘻による呼吸状態悪化を予防するため瘻孔の閉鎖を重要視し,心疾患の治療が緊急を要しない場合は,新生児期の気管食道瘻の閉鎖を優先する方針としている.今回の検討における死亡症例の中で,食道閉鎖の症例に対して気管食道瘻の絞扼術を施行したのは症例3のみであり,早期の気管食道瘻の処置が行われなかったことで治療成績の不良につながった可能性は否定できない.
一方,遠隔予後を規定するのは,多くの場合心疾患そのものの重症度であるが,それに加えて呼吸器感染症16)や中枢神経疾患17)の合併が影響を与えている.遠隔予後まで考慮すると,原疾患の治療のみならず,それらの予防,克服も念頭に置く必要がある.今回の検討では予後は早期死亡だけの検討になっており,遠隔期死亡や他病死による死亡の検討は不十分であり,今後は,長期のフォローアップの検討が必要である.
CHDを合併した消化管閉鎖の治療成績は向上しているが,食道閉鎖にCHDを合併した場合は,低出生体重児,重度染色体異常合併が多く,現在も予後不良である.治療成績の向上のために,個々の症例に応じた治療戦略の検討,症例の蓄積が求められる.
本論文の要旨は,第48回日本小児循環器学会総会(2012年8月,京都)において発表した.
引用文献References
1) 新川武史,山口眞弘,芳村直樹,ほか:先天性心疾患に一般外科疾患を伴う患児の治療方針とその成績.日小循誌2003; 19: 394–404
2) 川田博昭:先天性心疾患と増悪させる小児外科疾患とその外科治療.日外会誌 2011; 112: 225–230
3) 麻生俊英,武田裕子,帯刀英樹,ほか:新生児外科治療成績に及ぼす心疾患の影響.日外会誌 2011; 112: 231–234
4) 黒田達夫,北野良博,田中秀明,ほか:先天性心・大血管疾患合併症例に対する新生児外科手術戦略.日外会誌 2011; 112: 245–249
5) 水野 大:先天性心疾患合併小児外科疾患の治療戦略—小児外科医の立場から—.日外会誌 2011; 112: 240–244
6) Walker A, Stokes M, Moriarty A: Anesthesia for major general surgery in neonates with complex cardiac defects. Paediatr Anaesth 2009; 19: 119–125
7) Hennein HA, Mendeloff EN, Cilley RE, et al: Predictors of postoperative outcome after general surgical procedures in patients with congenital heart disease. J Pediatr Surg 1994; 29: 866–870
8) Mee BBB, Beasly SW, Auldist AW, et al: Influence of congenital heart disease on management of oesophageal atresia. Pediatr Surg Int 1992; 9: 90–93
9) Woitalik M, Mrowczyski W, Henschke J, et al: Congenital heart defect with associated malformations in children. J Pediatr Surg 2005; 40: 1675–1680
10) Khoo NS, Van Essen P, Richardson M, et al: Effectiveness of prenatal diagnosis of congenital heart defects in South Australia; a population analysis 1999-2003. Aust N Z J Obstet Gynaecol 2008; 48: 559–563
11) 武井黄太,安河内聰,瀧聞浄宏,ほか:出生直後に医学的介入が必要となる先天性心疾患児に対する胎児診断の役割.日小循誌 2010; 26: 106–112
12) Waterson DJ, Carter RE, Aberdeen E: Oesophageal atresia: tracheo-esophageal fistula. A study of survival in 218 infants. Lancet 1962; 1: 819–822
13) Spitz L: Esophageal atresia: past, present, and future. J Pediatr Surg 1996; 31: 19–25
14) Diaz LK, Akpek EA, Dinavahi R, et al: Tracheoesophageal fistula and associated congenital heart disease: implocations for anesthetic management and survival. Paediatr Anaesth 2005; 15: 862–869
15) 黒田達夫,北野良博,森川信行,ほか:重症奇形を合併する先天性食道閉鎖に対する治療方針.小児外科 2010; 42: 1243–1247
16) Wyse RKH, Al-Mahdawi S, Burn J, et al: Congenital heart disease in CHARGE association. Pediatr Cardiol 1993; 14: 75–81
17) Nieminen HP, Jokinen EV, Sairanen HI: Causes of late deaths after pediatric cardiac surgery. A population-based study. J Am Coll Cardiol 2007; 50: 1263–1271