心臓カテーテル造影(以下心カテ)検査とは末梢血管から心臓内にカテーテルを挿入し,心臓,血管の各部位から血液を採取し,その酸素含有量を調べる血液ガス分析,心臓,血管内の圧記録をして解析する心内圧解析,必要な部位で造影剤を注入する心臓血管造影の3つの柱からなる.日本小児循環器専門医修練目標の中で,心カテ検査に関するものとして“検査の適応とリスクを理解し,基本手技を習得し,血行動態,造影所見を評価できる”とある.米国の小児循環器科医のCore training期間に学ぶべきこととして1)心カテ検査の適応とリスク,2)カテーテル治療の適応とリスク,3)圧波形の解釈,4)酸素飽和度のデータの解釈,5)Fickの原理と短絡の計算,6)血管抵抗の計算,7)造影に関連しAngle-viewを含めた基本技術,解釈,8)放射線被爆の8つの項目を挙げている1).2)のカテーテル治療とリスクは総説シリーズの別項で扱われ,また1)と8)に関しては主題である“心臓カテーテル検査によって得られた結果をどう解釈するか”とは異なる.これら3つを除く5つの事項に焦点をあて解説する.5)のFickの原理と短絡の計算,6)血管抵抗の計算に関しては“得られた結果をどう解釈”する前に,“どのようにしてその結果が得られたか,または得たか”という点で重要と考えたので,“データを得るうえでの注意点”についても記載した.
古くから行われている検査法がゆえに,小児循環器関係の成書3–7)に必ずこの検査法の記載がある.1)の検査の適応,リスクは非常に重要な事項であり,非侵修的画像診断法が進歩した現在の適応は以前とは異なる2).リスクも含め成書3–5)などを参照してほしい.
心,血管内圧はその波形からA)心室圧(右室圧,左室圧),B)動脈圧(肺動脈圧,大動脈圧,肺静脈楔入圧),C)心房,静脈圧(右房圧,左房圧,上,下静脈圧,肺静脈圧,肺動脈楔入圧,冠状静脈圧)と3つに分かれる.これらの波形は心周期とともに特徴的波形を形成し,呼吸とともに変動する.通常の呼吸では圧は呼気で高くなり,吸気で低くなるが,絶対値の読み取りは呼気終わりで,吸気開始前の高いところの圧(陽圧呼吸下では呼気で低くなるため,低いところの圧)をとる.正常値は成書4–8)を参照してほしい.年齢により差があり,大動脈圧は年齢がすすむにつれその値は高くなる.
A)心室圧
収縮期のピーク圧と拡張末期圧(EDP)を読む.EDPは心室収縮開始の圧で,同部での偏曲点か,心房収縮時にみられるatrial kickと呼ばれる小さなピークと心室圧との谷の低い点をとる.決定困難な場合,左室EDPは同時記録された心電図のQRSの頂点か最下点での圧を,右室EDPはそれに引き続く上行脚か下行脚の中点における圧をとってもよい8).また心室圧波形からPositive dp/dt,Negative dp/dt,Tauなどの等容収縮期と等容拡張期の指標も得られるが,これらの指標はカテ先マノメータという特殊なカテーテルを用いて得られるノイズの少ない圧波形でないと解析不可能と考えてよい.一般のカテ室で用いている“Fluid filled catheter”のシステムでの圧波形はノイズが多く,これらの指標は算出しないほうがよい.
心室の異常圧曲線として1)心室収縮期圧の上昇,2)EDPの上昇がある.心室収縮期圧の上昇している時は,原因として高血圧などの動脈圧上昇,大動脈弁,肺動脈弁狭窄などの狭窄によるもの,大動脈閉鎖不全などの1回拍出量増加による病態を考える.EDPを含めた拡張期圧の上昇をみた場合は,心不全,とくに拡張期障害を主体とした心不全,半月弁閉鎖不全,心筋症,収縮性心膜炎,心タンポナーゼを考える.心不全,半月弁逆流による圧上昇は拡張期全体がだらだら上昇するのに比較し,収縮性心膜炎,心タンポナーゼなどでは“Dip and plateau”という特徴的波形をとる.
B)動脈圧
収縮期圧,拡張期圧,平均圧を読む.カテーテルを大動脈弁上から末梢に引いてくると半月弁閉鎖と同時にみられる重複切痕(dicrotic notch)は消失し,収縮期圧のピークは高くなり,圧波形はsharpになり脈圧は広がる.これは反射波による影響といわれ,撓骨動脈などの末梢動脈圧を中心血圧である大動脈圧の値に代用できないことを示している.
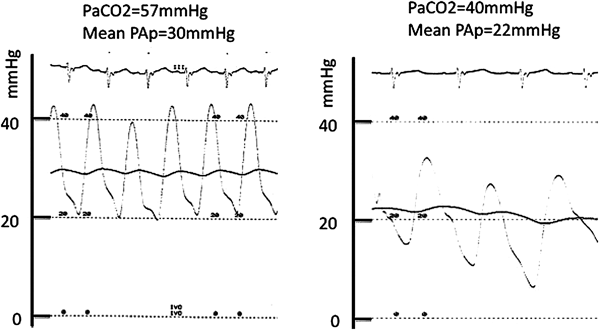
肺静脈楔入圧は肺動脈圧の代わりに用いることができるが,平均圧で18~20 mmHg以下の肺高血圧がない症例に限る9).また肺動脈圧の評価として平均圧25 mmHg以上あれば肺高血圧10,11)と診断する.後に述べる肺血管抵抗が種々の要因で変化するため,麻酔下で圧測定することの多い小児では,PH,PaCO2が生理的な状態で測定する.鎮静下では呼吸抑制され,肺胞低換気であることはしばしば経験する.必要があれば気管内挿管は躊躇しない.図に同一症例でのPaCO2が35 mmHgと50 mmHgでの平均肺動脈圧を示したが,8 mmHgも変化することがわかる(Fig. 1).この差が後述する肺血管抵抗(Rp)の計算に大きく影響する.
C)心房,静脈圧
心房圧は心房収縮によるa波,房室弁が閉鎖期間中に静脈系から心房への血液充盈による心房内圧が上昇することで形成されるv波の2つの陽性波と平均圧を読む.正常心では右房ではa波がv波より高く,左房ではv波のほうがa波より高い.また平均圧は右房より左房が高い.
a波が消失している場合は心房収縮がない心房細動,洞停止や完全洞房ブロックを考え,同時記録した心電図をみる.逆にa波の増高がみられたときは,左房であれば僧房弁狭窄,閉鎖,右房であれば三尖弁狭窄,三尖弁閉鎖の存在を考える.特殊な例として完全房室ブロックでは心房収縮と房室弁閉鎖が重なると極端にa波が増高し,“巨大a波”と呼ばれる.また心房への流入が増加するとv波は増高するので,左房のv波が増高の場合は僧房弁閉鎖不全や心室中隔欠損,動脈管開存などの左–右短絡疾患を,右房のv波の増高ではEbstein奇形を代表とする三尖弁閉鎖不全,心房中隔欠損,総または部分肺静脈還流異常症などを考える.v波の増高は平均圧上昇も伴うが,慢性的な流入量の容量負荷は心房の拡大により代償され,しだいに正常化してくるので急性なものに比較してその変化は少なく目立たなくなってくる.逆に右房平均圧が1~2 mmHg未満と低いときは“hypovolemia”を考える.
肺動脈楔入圧は肺静脈圧(肺静脈狭窄がなければ,左房圧)の代用に用いることができる.きちんと楔入されているかの確認のため,必ず採血し,肺動脈より高い酸素飽和度(肺静脈と同等かそれよりも高く,97~100%)であることを確認する.楔入されている条件は酸素飽和度以外に肺動脈圧より低いこと,波形が肺静脈または左房波形に似ることである.
D)圧較差
血管の狭窄,弁狭窄(肺動脈弁狭窄,大動脈弁狭窄)では収縮期圧の差をもって表し,圧較差は狭窄の程度(重症度)を表す.ただし,圧較差は心拍出量(狭窄部を通過する血流量)に依存しているので,重症度を表すのは正常心機能であることが前提である.左室駆出率が悪い新生児期発症の重症大動脈弁狭窄では圧較差が狭窄の程度(重症度)を反映しないのがよい例である.また正常でも肺動脈–右室間で5~10 mmHgほどの圧較差がみられ,新生児,乳児期早期では左右肺動脈から主肺動脈間で約10~15 mmHgまでの圧較差をみることがあるが,成長とともに改善するもので必ずしも病的とは考えない5,6).
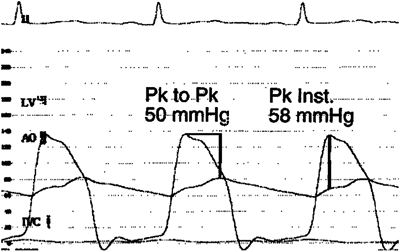
また心エコーでも狭窄部の最大流速(v,m/秒)を測定し,簡易ベルヌイ(4xv2)式を用い圧較差は推定できる.しかしカテーテルで測定した圧較差とは根本的に異なる.大動脈弁狭窄では,心エコーでの圧較差は狭窄部のVena contractaの瞬時の圧較差であるが,カテーテルで測定して得られる圧較差は“Peak to Peak”の血圧差であり,またpressure recoveryが生じた部位の上行大動脈の血圧になる12)(Fig. 2),この大動脈弁狭窄を代表として,血管,弁狭窄の治療適応となっている圧較差はカテーテル検査で得られる“Peak to Peak”の圧較差であり,このことが心カテ検査適応2,4,5)の一つとなっている.大動脈弁狭窄,僧房弁狭窄では同時圧(大動脈弁狭窄では左室と上行大動脈圧,僧房弁狭窄では左室と肺動脈楔入圧ないしは左房圧)を測定し,その圧較差部分の面積をプラニメトリーなどで計測して平均圧較差を求め,この部を通過する血流量からGorlinの公式を用いて弁口面積を算出して評価する.大動脈弁狭窄では0.8 cm2/m2以上(正常2 cm2/m2)が軽度,0.5~0.8 cm2/m2が中等度,0.5 cm2/m2以下が高度狭窄と判定,また僧房弁狭窄では0.5~0.7 cm2/m2は重症例である.治療適応となる圧較差はそれぞれの病変によるので,成書を参考にしてほしい.
1)基本的事項
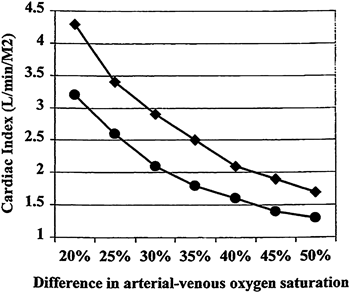
正常心での大静脈の酸素飽和度は部位によって異なる.一般に上大静脈と下大静脈の酸素飽和度を比較すると上大静脈のほうが低い.また下大静脈でも腎静脈血の酸素飽和度は高く,肝静脈血の酸素飽和度は低いので,どのレベルで血液採取したかで異なる.右房では酸素飽和度の低い冠状静脈血が流入するので完全にこれらの静脈血が混合する部屋(Mixing chamber)にはなりえず,肺動脈に至って充分に混合された混合静脈血を得ることができる.また大動脈血酸素飽和度は呼吸機能が正常であれば,肺静脈,左房と同じ96~98%である.この動静脈酸素飽和度較差は心拍出量のよい指標で,この値が大きいほど低心拍出量状態を示す.動静脈酸素飽和度較差は正常で20~25%である.酸素消費量,ヘモグロビン値によって異なるが,この飽和度較差は心拍出量(心係数)が約3.5 L/min/m2に相当する5)(Fig. 3).簡単に動脈血酸素飽和度が97%の患者で混合静脈血の酸素飽和度が低い,例えば65%以下のときはかなりの低心拍出量状態で,60%以下であればカテ検査自体リスクが高く,中断を考慮する.
2)左–右,右–左短絡の酸素飽和度
体循環と肺循環で解剖学的欠損がある疾患では短絡の有無と部位,ならびに短絡方向は重要な問題である.最近は心エコー法などで,短絡部位,方向の情報はほぼ正確に得ることができるが,その確定診断と短絡量は心カテ検査の心臓各部位の酸素飽和度から診断する.
左–右短絡の存在と部位は体静脈から肺動脈への流れでどの部分から酸素飽和度の上昇(O2 step up)があるかをみることで診断する.これらの血液採取は患者の状態が変化しないうちに,迅速にすることが重要で,Grossmanの成書3)には7分以内との記載がある.Table 1に各部位でのO2 step upの診断基準を示す.心房中隔欠損(ASD)を例にとると,有意なO2 step upは平均値を用いた場合7%以上であり,それから検出できる左–右短絡の体肺血流量比(Qp/QS)は1.5以上である.これ未満のものは心エコーで左–右短絡があっても検出できないし,また有意でない左–右短絡と解釈する.ただしこの酸素飽和度を用いた有意な左–右短絡のQp/Qsの検出は体血流量(Qs)に依存し,Qsが増加するほど混合静脈血酸素飽和度はあがり,その検出率はおちる13).したがってQsの数値をみてQp/Qsを判定することが肝要となる.有意な左–右短絡のASD(Qp/Qsが1.5以上)は,Hb=14.7 g/dL,酸素消費量が125-mL/min/m2と仮定した際はQsが3 L/min/m2のときである.Qsが5 L/min/m2ではQp/Qsが2.5以上のASDのみが検出可能になる(Table 2).
Table 1 Detection of left-to-right shunt by oxymetry (from reference 3)| Level of shunt | Criteria for significant Step-up | Approximate minimal Qp/Qs required for detection (Assuming SBFI=3 L/min/m2) | Posiible Causes of Step-up |
|---|
| Mean of distal chamber samples | Highest values in proxymal chamber |
|---|
| O2 sat (%) | O2 sat (%) |
|---|
| Atrial (SVC/IVC to RA) | ≥7 | ≥11 | 1.5–1.9 | ASD; PAPVR; Ruptured Sinus Valsalva; VSD with TR; coronary fisula to RA |
| Ventricular (RA to RV) | ≥5 | ≥10 | 1.3–1.5 | VSD; PDA with PR; Primum ASD; coronary fisula to RV |
| Great Vessel (RV to PA) | ≥5 | ≥5 | ≥1.3 | PDA; aorto-pulmonary window; aberant coronary oprigin |
| Any level (SVC to PA) | ≥7 | ≥8 | ≥1,5 | All the above |
| * SVC and IVC: Superior and inferior vena cava, RA: Right atrium, RV: Right ventricle, PA:Pumonary artery, ASD: Atrial septal defect VSD: Ventricular septal defect, TR: Tricupid regurgitation, PDA: Patent ductus arteriosus, PR: Pulmonary regurgitation, SBFI: Systemic Blood Flow Index. Qp/QS: pulmonary to sytemic flow ratio. |
Table 2 Approximate minimal Qp/Qs ratios required for detection of left to right Shunts at various levels of systemib blood flow and oxygen saturation step-up* (from reference 13)| Level of SBFI (L/min/m2) | Step-up in Qxgen Saruration |
|---|
| 5% | 7% | 10% |
|---|
| 1.5 | 1.1 | 1.2 | 1.3 |
| 2.0 | 1.2 | 1.3 | 1.5 |
| 2.5 | 1.3 | 1.3 | 1.7 |
| 3.0 | 1.3 | 1.5 | 1.9 |
| 3.5 | 1.4 | 1.6 | 2.2 |
| 4.0 | 1.4 | 1.7 | 2.6 |
| 4.5 | 1.5 | 2 | 3.5 |
| 5.0 | 1.8 | 2.5 | 6.3 |
| * It is assumed that blood hemoglobin concentration is 14.7 g/100-mL, systeimc arterial and pulmonary venous oxgen saturation are equal at 98% and oxgen consuption is 125 mL/min per m2. |
右–左短絡に関しては上述したように呼吸機能が正常であれば,大動脈血酸素飽和度は96%以上なので,95%以下であれば心内の右–左短絡の存在を考えるのが一般である.しかし麻酔下の乳児では呼吸抑制のため,また成人先天性心疾患患者ではしばしば慢性呼吸器疾患を合併し,肺静脈血酸素飽和度が低下しており,このことがあてはまらない.例を挙げると,心室中隔欠損(VSD),肺高血圧症例を疑う乳児例で検査を施行し,右室圧が左室圧の70%で大動脈血の酸素飽和度が93%の値が得られたとする.これはVSDでの右–左短絡ではなく,麻酔による呼吸抑制により肺静脈血酸素飽和度が低下しているためと解釈すべきである(下記の体血流量:Qsの計算では大動脈血酸素飽和度は96%でなく,93%を用いる).この鑑別は肺静脈血から採血をして酸素飽和度を測定するか,簡便な方法として低濃度の酸素を吸入させ大動脈酸素飽和度が96%以上を示すことである.筆者らの施設ではこのような麻酔による大動脈酸素飽和度低下例を疑う症例で回復に時間を要しそうな患者では,FIO2が0.3以下の低濃度酸素を使用しPO2が100 mmHg未満を確認した後に,心臓各部位で血液採取し酸素飽和度を測定している.肺静脈血からの採血は心房中隔欠損があると容易であるが,ないときは心室から左房−肺静脈へと逆行にカテ−テルをすすめることで可能である.この操作は練習を要するが3Fカテーテルを用いると比較的容易である.3Fカテーテルでは酸素飽和度の測定と圧は周波数特性の問題で平均圧のみが使用できる14).
1)Fick法の原理
Fickの原理15)とは“ある器官がある物質を摂取(あるいは供給)するとき,その器官へ流入する血液と流出する血液の物質の濃度差で,その器官が一定時間内に摂取(あるいは供給)する物質の量を除することで,その血流量を算出できる”というもので,ある物質が酸素で,肺血流量(Qp)の算出ではある器官は肺に相当する.Qp=酸素消費量/(肺静脈血酸素含有量−肺動脈血酸素含有量)で,Qs=酸素消費量/(大動脈酸素血含有量−混合静脈血酸素含有量)で算出される.短絡がなければ肺血流量(Qp)とQsは同じで,Fick法を用い心拍出量が得られる.酸素含有量(vol%=100 mL中に含まれる量)は,ヘモグロビンの酸素運搬能の理論値である1.36(mL O2/g Hb)にヘモグロビン濃度(g/dL)と酸素飽和度を乗じて計算され,それに0.003 mL/100 mL/mmHg(PO2)で計算される血漿中に溶解している酸素量を加えたものである.通常の環境下では酸素分圧(PO2)は100 mmHg以下で溶解酸素量は無視できるので,酸素飽和度の測定のみでQs(Qp)の計算が可能となる.心カテ検査での心拍出量の測定法には,Fick法以外に,熱希釈法がよく用いられる.熱希釈法を用いて心拍出量測定するのにあたっての注意点としては1回目の値が高めに算出されることが多い(初回注入液がカテ内の暖かい液混入のため)ので,1回冷水であらい,3~4回の平均値を用いることである.また三尖弁,肺動脈弁逆流あると信頼性が低くなり8),3.5 L/min未満の低心拍出量のときは過大評価することを知って用いるべきである.特に2.5 L/min未満では平均35%(18~71%)もFick法で計算された値より過大評価するとの報告16)がある.このような状態では短絡がなくてもFick法での算出を選択したほうがよい.
2)酸素消費量
実測と推定して求める方法がある.推定する方法としては3~40歳を対象としたLaFarge–Miettinenの方法17),0~27歳でのLundellの方法18),0~17歳でのWesselの方法19)など種々の推定式がある.頻用されているのはLaFarge–Miettinenの方法であり,男性は138.1−(11.19×log年齢)+(0.378×心拍数),女は138.1−(17.04×log年齢)+(0.378×心拍数)で計算され,表として成書4,5,8)に記載されている.しかし,実測とLaFarge–Miettinenの推定方法の比較を行った研究で,平均年齢52.2歳の成人を対象としたものでは実測値を過小評価し,実測値との誤差が25%以上あった患者が26%にみられたとの報告20),小児を対象としたものではこの推定法は実測値を過大評価21,22)し,特に3歳未満で気管内挿管している小児で誤差が53%にもなり,使用できないとの報告21)があり,実測が薦められている.
3)短絡量,短絡率の算出
短絡疾患での体血流量(Qs:心拍出量に相当)と肺血流量(Qp)は上記のFick法を用いて求める.この比が肺体血流量比(Qp/Qs)であり,1を超える場合は肺血流量の増加を,1.0未満は減少を意味する.また肺動脈酸素飽和度(含有量)の誤差が同じ程度であっても,高肺血流量ほどその計算される肺血流量の誤差は大きくなる.そのことを考慮すると,Qp/Qsの値がもし3.5と5.5となった場合,両者の比較はあまり意味がなく,Qp/Qs>3.0は同じ範疇の肺血流増加の群と解釈すべきである5).
また重要なことはFick法の原則は,酸素が完全混和するmixing chamberが存在する前提でのみ使用できるという点である.したがって肺動脈酸素飽和度が左右で異なっている状態(肺動脈大動脈起始症,Original Glenn術後など)ではQpは計算できない.Qsの計算で,ファロー四徴症のように両方の心室から血液をうける疾患の大動脈血酸素飽和度は上行大動脈でなく,完全に血液が混和した下行大動脈の酸素飽和度を使用する.心房中隔欠損症では左房から右房に短絡した血液が下大静脈にも流れるので,混合静脈血として上大静脈と下大静脈の酸素飽和度の平均値を用いることはできない.一般に上大静脈の酸素飽和度のみを使用する方法23)か,上大静脈の酸素飽和度に3を乗じた値と下大静脈の酸素飽和度の値の和を4で除した(3×上大静脈酸素飽和度+下大静脈酸素飽和度/4)値を用いる方法3)が用いられている.また両方向性を含めGlenn術後では混合静脈血が存在せず,Qsの計算は通常の計算式では求めることはできない.そこで両方向性Glenn術後ではQsはQpと下大静脈血流量の和であることを利用し,Qp/Qs=(大動脈血酸素飽和度−下大静脈血酸素飽和度)/(肺静脈血酸素飽和度−下大静脈血酸素飽和度)の式でQp/Qsを計算し,そこからQsを算出する方法が報告24)されている.しかし最近,MRI法との比較でFick法を用いた両方向性Glenn術後のQp,Qsの算出は限界があり,無視できない誤差が指摘25)されており,Fick法で算出した値の解釈には誤差が大きいことを認識しておくことが必要である.
短絡の方向として複数の短絡部位,または同一短絡部位ですべてが一方向でなく,両方向短絡の場合は,実際に酸素化された血流量である有効肺血流量を酸素消費量/(肺静脈血酸素飽和度−混合静脈血飽和度)の式で計算し,短絡率を算出する.短絡の程度をみるのに短絡血流量ではなく,短絡血流量が相対的に心拍出量の何%にあたるかで評価する.この短絡率は酸素飽和度のみの計算式で算出され,誤差の大きい酸素消費量の項目がなく有用である.
肺高血圧評価の負荷試験として高濃度酸素が使用11)されることがあるが,その際は血漿中に溶解した酸素量もQp,Qsの計算にいれる必要があり,各部での血液の酸素飽和度のみでなく,PO2も測定する.もし麻酔による呼吸抑制などのために使用することがあれば,最低5分はRoom Airにして,その影響をとってから採血を再開する.
流体力学の定常流での法則が参考になる.Poisseulleの法則からQ=π(P2−P1)r4/8ηι,オームの法則から抵抗RはR=P1−P2/Q=8ηι/πr4で表される.Qは流量,P2–P2は圧較差,rは管径,ηは液体粘性,ιは管の長さである.生体では血管は弾性を有し,拍動流で,血液は不均一液なので,必ずしもこの流体力学の法則を生体に当てはめることはできないが,この式から血管抵抗は血管床(r)と血液粘性(η)の変化に左右されることがよく理解される.つまり血管床(r)が大きければ血管抵抗は少なくなり,血液粘性が高いほど大きくなる.ヘマトクリットが43%から64%に増加するとRpが約2倍増加したとの報告26)がある.このことはFontan型手術適応27)の一つの指標であるRpの算出に非常に重要なことで,ヘマトクリットが65%超える場合は60%未満にしてRpを評価することが薦められている5).
このように血管抵抗は圧較差を血流量で除したもので,肺血管抵抗(Rp)は(肺動脈平均圧−肺静脈平均圧)/肺血流量,体血管抵抗(Rs)は(大動脈平均圧−混合静脈圧)/体血流量で計算される.1980年代では全体血管抵抗と全肺血管抵抗(それぞれ大動脈,肺動脈平均圧を血流量で除したもの)が用いられていたが,現在では使用されていない.単位は血流量がL/min,圧がmmHgなのでmmHg/L/minで表され,Paul Woodにより最初導入されたことからWood単位ともいわれる.別名,Hybrid unitと呼ばれ,成人領域で使用されるmetric unitのdyne·second·cm−5はhybrid unitを80倍にすることで変換可能である.Qs,Qpの計算式での酸素消費量は多くは体表面積(BSA)補正されている値を用いているので,血流量の単位はL/min/m2で,L/minでない.したがってRpの値は圧較差(mmHg)を心拍出量(L/min)で除し,BSA補正する時は,その値にBSAを“かけ算”した値で,“わり算”ではないことに注意をする.成書,論文にWood unit/m2,Unit/m2,単位/m2などの記載があるが,BSA補正しているという意味で,通常Unit·m2,単位·m2と同じと解釈する.またRpはFontan型手術適応の一つとして3 unit·m2はハイリスク,4 unit·m2は禁忌27),また左–右短絡疾患のおけるアイゼンメンゲル化に焦点をあてた手術適応の基準とし8 unit·m2以上が禁忌10)とされ,肺高血圧の指標として用いられている.その解釈で重要なことはRpの絶対値のみでなく,必ずRsとの関係(Rp/Rs)をみてその値を評価することである.例を挙げるとFontan型手術適応疾患でRpが4.0 unit·m2と計算されたとする.この値そのものからは手術適応からはずれるが,そのときのRsが28 unit·m2であれば,いわゆる“末梢血管が非常にしまった状態”でのカテーテル検査結果であり,実際のRpはもっと低い可能性がある.また圧較差と血流量から算出されるものなので,それぞれの因子の誤差,例えば推定した酸素消費量の誤差,圧変動を考えた時の圧較差の誤差などを考慮すると,算出されたRpも少なくとも20%前後の誤差は生じている値と考えるべきである.Rpの値が手術適応を決めるボーダライン値のときは,その1回のRp値で適応を決定すべきでなく,検査を繰り返したほうが無難である.
5. 造影に関連しAngle-viewを含めた基本技術,解釈
撮影方向は正面,側面の2方向が下記の容積測定に必要なため基本となるが,観察したいものによって様々なAngle-view28)が考案されている.形態診断では造影されている部分以外,造影されない透亮像,ないしは欠損像をみることも必要となる.右室造影で,両大血管右室起始症のVSDの位置,右室二腔症の異常筋束はよい例である.また形態診断のみならず,右心室,左心室の容積,駆出率などの機能診断にも使用され,右室はSimpson法に基づいたGraham法29),左室はArea length法30)を用いて正面,側面像の心室造影の縁をトレースするだけで心室容積,駆出率を算出するコンピュータソフトが市販されている31).それぞれの容積が正常の何%(対正常%)にあたるかが算出されるので,それで心室の拡大,または低形成を評価する.筆者らの施設ではNakazawaらの式30)で容積が算出されるソフトを使用しているが,このソフトを使用した場合,日齢1~16歳の,BSAが多くは1.4~1.6以下の正常小児からの容積を用いて算出されているので,BSAがこれを超える,特に成人患者での容積の対正常%の解釈には注意を要する.
肺動脈造影で左右の肺動脈の第一分枝手前の径の測定で得られるNakata Index32)はファロー四徴症,肺動脈閉鎖などの肺血流量減少疾患,Fontan型手術適応疾患の肺血管床の評価に非常に有用な指標で,ファロー四徴症では100 mm2/m2以上あれば心内修復術は可能とされる.正常値は330±30 mm2/BSAであるが,対象が新生児では使用しないほうがよい.
繰り返しになるが,日本小児循環器専門医修練目標の“検査の適応とリスクを理解し,基本手技を習得し,血行動態,造影所見を評価できる”の中で,この“血行動態,造影所見を評価できる”の部分が本稿の主題であるため,“検査の適応とリスクを理解し,基本手技を取得し”の部分は主に成書3–7)参照とした.心カテは侵襲的検査法なので,検査のメリット,デメリットを患者さんに充分に説明し,理解してもらった上で施行することはいうまでもない.基本手技とは,「時間,時間で状態が変化する患者さんで,いかに短時間で“安定”した状態での血行動態のデータを,いかに“安全”にとるかの技術,手技」を意味するとの解釈も可能である.そのためには最低限,施行する医師は心カテプランを術前に充分に練ることが要求される.
心カテ結果の解釈には“どのように心カテを行い,どのようにデータを得たか”によって,様々な要因でその結果に“誤差”を生じている可能性があることを常に念頭におくことが必要である.最後に本稿が小児循環器専門医を目指す医師にとって心カテ検査の理解の一助になれば幸いである.
引用文献References
1) Beekman RH, Hellenbrand WE, Lloyd TR, et al: Task force 3: Training guideline for pediatric cardiac catheterization and interventional cardiology. J Am Coll Cardiol 2005; 46: 1338–1390
2) Feltes TF, Bacha E, Beekman RH III, et al: Indications for cardiac catheterization and intervention in pediatric cardiac disease. A scientific statement from the Ameriacn Heart Association. Circulation 2011; 123: 2607–2652
3) Grossman W: Hemodynamic principles, in Baim DS, Grossman W. (eds): Grossman’s Cardiac Catheterization, Angiography and Intervention. 7th edition, Philadelphia, Lippincott Williams & Wilkins, 2006, pp 131–183
4) Lock JE: Cardiac catheterization, in Keane JF, Lock JE (eds): Nadas’ Pediatric Cardiology. 2nd edition, Philadelphia, Saunders, 2006, pp 213–250
5) Grifka RG: Cardiac catheterization and angiography, in Allen HD, Driscall DJ, Shaddy RE, et al (eds): Moss and Adamus Heart Diseses in Infants, Children, and Adlolescents: Including the Fetus and Young Adult. 7th edition, Philadelphia, Lippincott Williams & Wilkins, 2008, pp 208–237
6) Rudolph AM: Functional assessment and oxygen uptake and delivery, in Rudolph A (eds): Congenital Disease of the Heart: Clinical-Physiological Consideration. 2nd edition, New York, Futura, 2001, pp 45–102
7) 門間和夫:心臓カテーテル検査法と心血管造影法.高良篤良,門間和夫,中沢 誠,ほか(編):臨床発達心臓病学 改訂3版.東京,中外医学社,2005, pp 224–232
8) 木全心一,中澤 誠(編著):心機能評価法,心機能の臨床.東京,中外医学社,1981, pp 3–179
9) Mori Y, Nakanishi T, Ishii T, et al: Relation of pulmonary venous wedge pressures to pulmonary artery pressures in patients with single ventricular physiology. Am J Cardiol 2003; 91: 772–774
10) Dunbar D, Abman SH, Barst RJ, et al: Pediatric pulmonary hypertension. J Am Coll Cardiol 2013; 62 Suppl: D117–D126
11) 中西宣文,安藤太三,上田初江,ほか:循環器病の診断と診療に関するガイドライン(2011年度合同研究班報告) 肺高血圧治療ガイドライン(2012年改訂版)http://www.J-circ.or.jp/guideline
12) DeGroff CG: Doppler echocardiography, in Valdes-Cruz LM, Cayre RO (eds): Echocardiographic Diagnosis of Congenital Heart Disease: An Embryologic and Anatomic Approach. Philadelphia, Lippincott Williams & Wilkins, 1999, pp 101–157
13) Antman EM, Marsh JD, Grossman W: Blood oxygen measurement in the assessment of intracardiac left to right shunts: A critical appraisal of methology. Am J Cardiol 1980; 46: 265–271
14) Mori Y, Nakanishi T, Satoh M, et al: Catheterization of the pulmonary artery using a 3 French catheter in patients with congenital heart disease. Cathet Cardiovasc Diagn 1998; 45: 45–50
15) Visscher MB, Johnson JA: The Fick principle: Analysis of potential errors in its conventional application. J Appl Physiol 1953; 5: 635–638
16) Van Drondelle A, Ditchey RV, Groves BM, et al: Thermodilution method overestimates low cardiac output in human. Am J Physiol 1983; 245: H690–H692
17) LaFarge CG, Miettinen OS: The estimation of oxygen consumption. Cardiovasc Res 1970; 4: 23–30
18) Lundell BP, Casas ML, Wallgren CG: Oxygen consumption in infants and children during heart catheterization. Pediatr Cardiol 1996; 17: 207–213
19) Wessel Hu RD: Continuous determination of oxygen uptake in sedated infants and children during cardiac catheterization. Am J Cardiol 1969; 24: 376–385
20) Wolf A, Pollman MJ, Trindade PT, et al: Use of assumed versus measured oxygen consumption for the determination of cardiac output using the Fick principle. Cathet Cardiovasc Diagn 1998; 43: 372–380
21) Li J, Bush A, Schulze-Necick I, et al: Measured versus estimated oxygen consumption in ventilated patients with congenital heart disease. The validity of predictive equations. Crit Care Med 2003; 31: 1235–1240
22) Rutledge J, Bush A, Shekerdemian L, et al: Validity of the Lafarge equation for estimation of oxygen consumption in ventilated children with congenital heart disease younger than 3 years: A revisit. Am Heart J 2010; 160: 109–114
23) Gutgesell HP, Williams RL: Caval samples as indicators of mixed venous oxygen saturation: implications in atrial septal defect. Cardiovasc Dis 1974; 1: 160–164
24) Salim MA, Case CL, Sade RM, et al: Pulmonary/systemic flow ratio in children after cavopulmonary anastomosis. J Am Coll Cardiol 1995; 25: 735–1395
25) Downing TE, Whitehead KK, Dori Y, et al: Accuracy of conventional oximetry for flow estimation in patients with superior cavopulmonary connection. A comparison with passed-contrast cardiac MRI. Circ Cardiovasc Imaging 2013; 6: 943–949
26) Nihill MR, MacNamara DG, Vick RL: The effects of increased blood viscosity on pulmonary vascular resistance. Am Heart J 1992; 92: 65–72
27) 朴 仁三,中澤 誠,門間和男,ほか:フォンタン型手術適応の見直し:肺血管床.日小児循環器会誌 1993; 8: 501–508
28) Fellows FE, Kean JF, Freed MD: Angled views in cineangiography of congenital heart disease. Circulation 1977; 56: 485–490
29) Graham TP Jr., Jarmakani JM, Atwood GF, et al: Right ventricular volume determination in children. Normal value and observations with volume or pressure overloard. Circulation 1973; 47: 144–153
30) Nakazawa M, Mark RA, Isabel Jones J, et al: Right and left ventricular volume characteristics in children with pulmonary stenosis and intact ventricular septum. Circulation 1976; 53: 884–890
31) 青墳裕之,池田弘之,中島弘通,ほか:心室造影より右室容積計算をおこなう4種のコンピューターソフトウエアーについての比較検討.日小児循環器会誌 2004; 20: 16–23
32) Nakata S, Imai Y, Takanashi Y, et al: A new method for the quantitative standardization of cross-sectional areas of the pulmonary arteries in congenital heart disease. J Thorac Cardiovasc Surg 1984; 88: 610–619