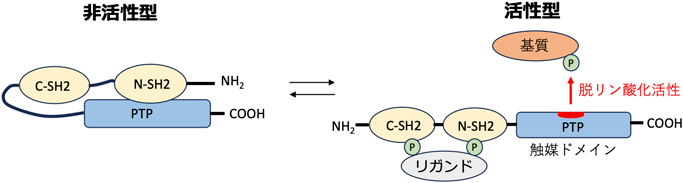
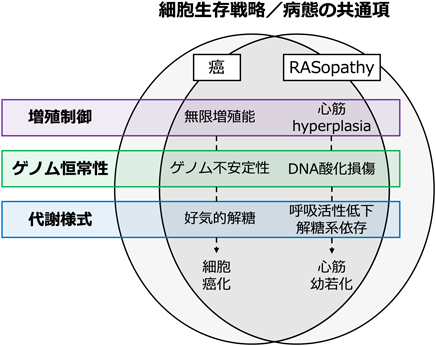
RASopathy心筋症病態理解の新たな展開Emerging Hypotheses on the Pathogenesis of Rasopathy-Associated Cardiomyopathies
1 東京医科歯科大学 大学院医歯学総合研究科 循環制御内科学Department of Cardiovascular Medicine, Graduate School of Medical and Dental Sciences, Tokyo Medical and Dental University ◇ Tokyo, Japan
2 東京大学 大学院医学系研究科 循環器内科学Department of Cardiovascular Medicine, Graduate School of Medicine, The University of Tokyo ◇ Tokyo, Japan
3 東京大学 大学院医学系研究科 先端臨床医学開発講座Department of Advanced Clinical Science and Therapeutics, Graduate School of Medicine, The University of Tokyo ◇ Tokyo, Japan
4 大阪公立大学 大学院医学研究科 ウイルス・寄生虫学Department of Virology & Parasitology, Graduate School of Medicine, Osaka Metropolitan University ◇ Osaka, Japan