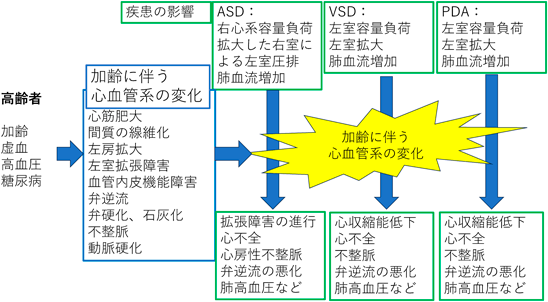
近年では先天性心疾患(congenital heart disease: CHD)のほとんどは乳幼児期に診断,治療が行われる.高齢者でみられるCHDは,乳幼児期に発見されて外科手術を受け,高齢にまで至った例,小児期に診断はされたが外科手術を受けずに成人し高齢に至った例,あるいは成人や高齢者になってはじめて診断された例に分類できる.高齢になると,加齢による変化,糖尿病,高血圧など様々な因子に修飾されて病態が複雑になってくる(Fig. 1).ここでは未治療のまま,あるいは診断されずに高齢に至った単純短絡心疾患の特徴と治療,管理における留意点について概説する.
最近の本邦の成人先天性心疾患対策委員会(JNCVD-ACHD)レジストリーの集計1)によると,全患者における疾患頻度は心室中隔欠損症(ventricular septal defect: VSD)21.9%,心房中隔欠損症(atrial septal defect: ASD)20.3%,ファロー四徴症(tetralogy of Fallot: TOF)14%の順に多かった.疾患別の平均年齢は,ASD,動脈管開存(patent ductus arteriosus: PDA),2尖弁大動脈弁で高い傾向にあった.この集計データを用いると,全患者9,743人中,65歳以上の患者は1,063人(11%)であり,65歳以上の患者の中の疾患頻度はASDが54.4%,VSDが11.9%,2尖弁大動脈弁が8.3%,PDAが6.2%という結果であり,高齢者ACHD通院患者のほとんどが単純短絡疾患である(Table 1).また,65歳以上の患者ではTOF,単心室症など人工心肺を用いた心内修復術を必要とする疾患の頻度が非常に低くなっている.
Table 1 日本成人先天性心疾患対策委員会に登録されたACHD外来通院全患者と65歳以上の患者の内訳| Main diagnostic name | (Abbreviation) | Registered cases |
|---|
| All N (%) | age (Dec 31st, 2020) All | 65 years or older N (%) |
|---|
| Aortic stenosis | (AS) | 108 (1.1) | 29.9±12.2 | 3 (0.3) |
| Atrial septal defect | (ASD) | 1,978 (20.3) | 47.4±21.6 | 578 (54.4) |
| Atrioventricular septal defect/Endocardial cushion defect | (AVSD/ECD) | 366 (3.8) | 35.8±15.4 | 27 (2.5) |
| Bicuspid aortic valve | (BAV) | 381 (3.9) | 44.7±20.0 | 88 (8.3) |
| Congenitally corrected transposition of the great arteries | (ccTGA) | 219 (2.2) | 39.0±14.8 | 16 (1.5) |
| Coactation of aorta/Interrupted aortic arch | (CoA/IAA) | 343 (3.5) | 29.8±10.8 | 8 (0.8) |
| Ebstein disease | (Ebstein) | 187 (1.9) | 42.2±17.9 | 31 (2.9) |
| Mitral valve disease | (MV) | 116 (1.2) | 30.8±9.7 | 1 (0.1) |
| Pulmonary atresia with intact ventricular septum | (PA-IVS) | 124 (1.3) | 28.0±6.8 | 0 (0) |
| Pulmonary atresia with ventricular septum defect | (PA-VSD) | 260 (2.7) | 31.1±9.8 | 1 (0.1) |
| Patent ductus arteriosus | (PDA) | 256 (2.6) | 44.1±21.9 | 66 (6.2) |
| Pulmonary stenosis | (PS) | 282 (2.9) | 32.6±14.2 | 15 (1.4) |
| Persistent truncus arteriosus | (PTA) | 22 (0.2) | 29.9±6.5 | 0 (0) |
| Total anomalous pulmonary venus return | (TAPVR) | 98 (1.0) | 29.5±9.7 | 2 (0.2) |
| Transposition of the great arteries | (TGA) | 414 (4.2) | 30.1±8.7 | 1 (0.1) |
| Tetralogy of Fallot | (TOF) | 1,360 (14.0) | 36.4±13.2 | 50 (4.7) |
| Univentricular heart/Single ventricle | (UVH/SV) | 619 (6.4) | 29.5±8.7 | 1 (0.1) |
| Ventricular septal defect | (VSD) | 2,135 (21.9) | 35.1±14.7 | 127 (11.9) |
| Others | | 475 (4.9) | 37.8±16.9 | 48 (4.5) |
| Total | | 9,743 (100) | 37.6±17.1 | 1,063 (100) |
| N: the number of patients. 文献1)より一部引用 |
ASDは成人で診断される先天性心疾患のなかで最も頻度が高い.ASD患者の多くは成人期までほとんど無症状に経過する.日本では,学校検診の普及により無症状の小児期に発見されることも多いが,成人期になって初めて発見される症例もまれではない.症状としては,通常の心不全症状(息切れ,動悸,易疲労感)が多く,心房細動などの不整脈の発症に伴って症状が出現することがある.近年では有意なシャント量のASDは閉鎖が行われるため自然歴を追うことは難しいが,1970年の報告では,未治療の場合,20歳までは経過良好だが,30歳を過ぎると年々生存率が低下し,36歳までに50%の症例が死亡,60歳では90%が死亡すると報告されている2).長期の左室圧排による左室内腔の減少,間質の線維化を含む加齢変化,高血圧による心肥大,糖尿病,冠動脈疾患の合併といった左室コンプライアンスを低下させる病態が疾患に影響を与える.体循環血液量(Qs)は低下し,安静時の左→右短絡の増加から肺血流量(Qp=Qs+ASD左右シャント量)は多いまま維持される.また,40歳以降には心房細動/心房粗動などの不整脈発生の頻度が増し,病態の悪化に関与する.長期的な心房負荷と加齢により,欠損孔自体が引き延ばされて拡大していきシャント量を増加させる側面もある2).閉鎖適応は,症状の有無にかかわらず,右房・右室拡大を認めるような有意な左右短絡,欠損孔の大きさにかかわらず,ASDによる奇異性塞栓症発症例または体位変換性低酸素血症(orthodeoxia-platypnea)が証明された症例とされており,右室拡大など右室負荷所見がでてきたら心不全や心房細動を引き起こす前に閉鎖を行うことが望ましいとされている3).24歳以下で治療を受けた症例の長期予後は健常者と同等であるとの報告4)もあり,近年ではほとんどの症例で治療介入がなされる.しかし,60~70歳になって初めて発見されるASDがしばしば経験されるのも現状である.高齢ASDの日常診療において注意するべき点として心不全,不整脈(心房細動),弁膜症などがあり,ただガイドラインに従って閉鎖を行えばよいわけではない症例も存在する.また,高齢者では悪性腫瘍などで全身麻酔下で非心臓手術の施行が必要になる場合もある.各々に対して概説する.
①心不全,弁膜症
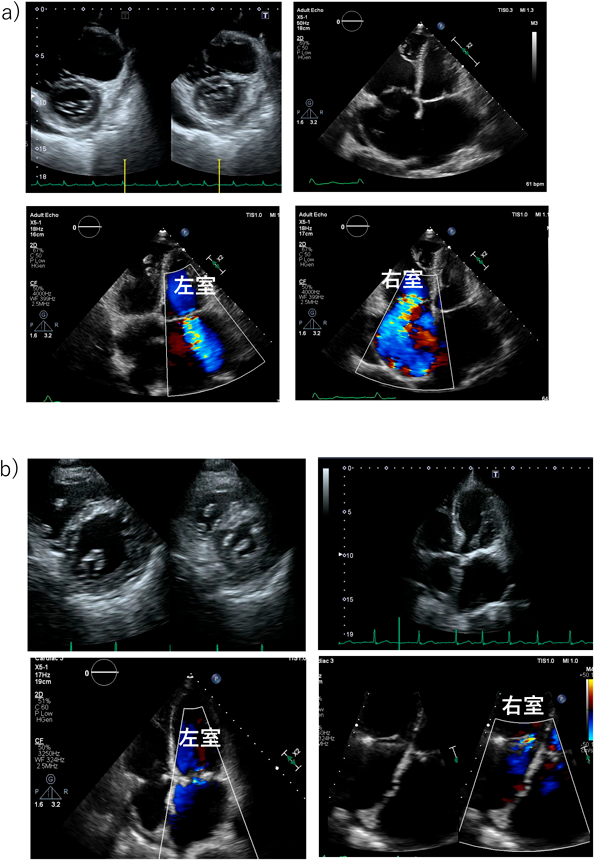
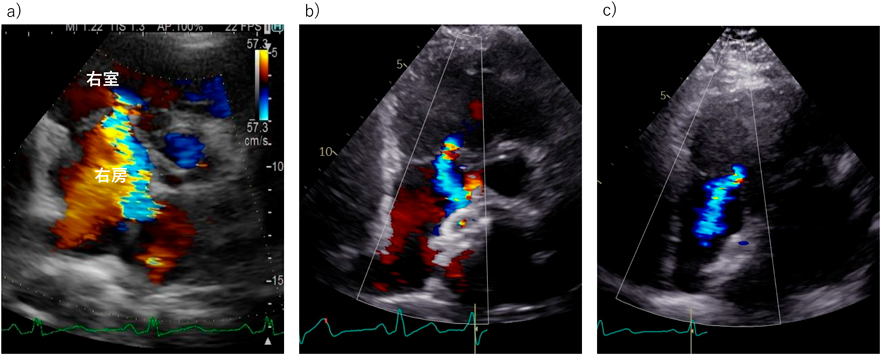
年齢とともにASDに心不全を合併する率は上昇する.しかしながら,どの程度のASDが将来的に心不全などを発症するのか,また,将来的に塞栓症などを発症するリスクがどの程度なのかが,閉鎖適応基準には十分には盛り込めていない.また,経皮的閉鎖と外科的閉鎖ではその侵襲性から,高齢者では明らかに適応基準は異なるはずである.すでに心不全を合併したASDでは基本的には心不全コントロール後に閉鎖が推奨されるが,高齢者の心不全に合併するASDはあくまでも心不全の増悪因子の一因に過ぎないことも多く,時として左房圧上昇を逃がす役割を果たしていることもあるのでその閉鎖を考えるうえでは注意が必要である.その心不全の病態を総合的に評価することが重要となる.カテーテル治療の普及によりASDの治療の主体は外科治療から経カテーテル閉鎖術に移行している.とくに高齢者では低侵襲のカテーテル閉鎖の有益性が高い.ただし高齢者では,心房性不整脈,房室弁逆流の合併頻度が高く,また,欠損孔の閉鎖に伴う(そして上昇した左房圧の逃げ道を失ったための)急性左室容量負荷から左室拡張障害,急性肺水腫を起こす危険性もある.治療前の適切な不整脈・心不全管理,さらに症例によっては周術期肺動脈楔入圧のモニターを含めた慎重な術後管理が必要である.シャントの位置・性状,弁膜症の程度,部分肺静脈還流異常など他の短絡性CHDの合併の程度と種類によっては外科的閉鎖術が推奨される場合もある.ASD閉鎖後には右室に押されて小さかった左室への容量負荷から僧帽弁閉鎖不全症(mitral regurgitation: MR)が発症・増悪する可能性が報告されている5).術前中等度以上のMRを伴う症例では高齢者であっても外科的閉鎖手術を選択し僧帽弁への介入が推奨される(Fig. 2).さらに,高齢ASD患者では長年の右心負荷により右心系が拡大し,それに伴う三尖弁輪の拡大と三尖弁閉鎖不全症(tricuspid regurgitation: TR)を認めることが多い.中等度以上のTRを合併した症例では原則として外科的ASD閉鎖術の適応と考えられている.しかし,この右心系拡大の場合は閉鎖術で右室内腔の減少およびTRの減少が期待できること6)(Fig. 3),ならびに利尿剤によるある程度の右房圧・静脈圧のコントロールが予測できることも多く,年齢に伴う開胸手術のリスクと併せて治療方針を決定する必要がある.開胸手術リスクの高い高齢者の場合には,TRを合併していても経カテーテルASD閉鎖術も治療選択肢として検討する余地がある.
②不整脈
成人期ASDでは左右短絡からの心房負荷により,心房性不整脈の発生頻度が高く,とくに年齢ともにその頻度が上昇する7).一般人口における心房細動(atrial fibrillation: AF)の罹患率はFramingham Studyにおいて50代で0.5%,80代で9%と報告されているが,未治療ASDにおけるAFの発生率は18~40歳で1%,40~60歳では30%,60歳以上では80%にのぼる8).AFは前述の心不全の原因にもなりえるためAFを合併したASDではAFとASDの双方を治療する必要がある.AFに関してはカテーテルアブレーションによる肺静脈隔離術が治療法として確立している.AF発症前にASD閉鎖を行えばAF発症頻度は減るが,発作性のAFであっても,ASD閉鎖前に一度AFが発症してしまうと,ASD閉鎖単独では明らかなAFの再発抑制効果は認められておらず9),経皮的ASD閉鎖前のカテーテルアブレーション,あるいは外科的ASD閉鎖時のMAZE手術が必要となる.
近年では,経皮的ASD閉鎖後に発症したAFに対して,心腔内エコー使用下に心房中隔穿刺あるいはデバイスの穿刺を行い肺静脈隔離術を施行した報告も散見されるが,医原性ASD発生のリスクもあり注意が必要である10).基本方針としては,ASD閉鎖前にカテーテルアブレーションでAFを治療し,再発のないことをしっかり確認した後,ASD閉鎖を行うことが望ましい.当院でのAFを合併したASDの治療方針も同様でありASD閉鎖前にまずアブレーションを行い,AF再発がないことを確認後,3か月後以降に経皮的欠損孔閉鎖を行っている.
③高齢者ASDの治療可否と治療前後の血行動態
高齢者ASDに対してカテーテル閉鎖を行うことの可否はこれまで明らかにされていなかった.最近報告されたメタアナリシスでは,60歳以上のASD患者に対する経皮的ASD閉鎖の後,57日~4.4年(中央値27.6か月)のフォローアップで右室拡張末期容積,収縮期肺動脈圧,三尖弁逆流の重症度,BNP,NYHA重症度が低下し,左室拡張末期容積が拡大したという結果となっており,高齢ASD患者に対して経カテーテル閉鎖を行うことの有効性が示唆されている11).高齢者では左室拡張機能の低下が懸念されるが,左室の拡張能に関しては,経カテーテルASD閉鎖術直後心エコーでの拡張能指標の改善を認めたとの報告もあり12)術後の肺鬱血に注意し十分に心不全コントロールを行いながらASD閉鎖を施行する価値はあると考える.
当院では2013年8月から2023年8月までに肺高血圧のない(平均肺動脈圧<20 mmHg)ASD患者57人に対してカテーテル閉鎖もしくは外科的閉鎖を行っている.うち,65歳以上の高齢者は16人であった.閉鎖前の血行動態および背景データはTable 2のようであり,心房細動合併率が高齢者で高かった.閉鎖前の血行動態では平均肺動脈圧と肺血管抵抗値が高齢者で高かった.また,閉鎖を行った患者のうち,閉鎖前および閉鎖後1年にMRI撮影を行った患者は15~64歳で25名,65歳以上で9名おり,閉鎖前後での両心室機能,および容積の変化はTable 3のようであった.64歳未満では閉鎖前後で左室,右室ともに容積が改善したが,65歳以上では右室の容積は小さくなるものの,左室容積の拡張は認めないという結果であった.このデータは閉鎖後1年でのMRIデータであり,高齢者ではASD閉鎖後,左室の容積が拡大してくるのに時間がかかる可能性があるため長期フォローアップが望まれる.また,閉鎖直後のみではなく長期的に左室拡張障害に注意しながら経過をみる必要がある.
Table 2 当院にてASD閉鎖を施行した肺高血圧のないASD患者の背景データ | 15–64歳
(n=41) | 65歳以上
(n=16) | p Value |
|---|
| 年齢 | 40.4±2.1 | 73.3±1.1 | <0.001 |
| 女性 | 28 (68%) | 12 (75%) | 0.753 |
| 心房細動合併 | 3 (7%) | 5 (31%) | 0.032 |
| 心不全合併 | 1 (2%) | 2 (13%) | 0.187 |
| 閉鎖前血行動態 | | | |
| mPAWP mmHg | 8.1±0.4 | 7.3±0.7 | 0.234 |
| mPAP mmHg | 15.6±0.5 | 17.7±0.9 | 0.032 |
| RAP mmHg | 5.7±0.3 | 4.8±0.7 | 0.16 |
| PVR WU | 1.0±0.1 | 1.7±0.1 | <0.001 |
| QpI L/min/m2 | 5.1±0.4 | 4.2±0.3 | 0.114 |
| Qp/Qs | 2.5±0.2 | 2.1±0.1 | 0.084 |
| Values are mean±SEM, n (%). Qp/Qs=肺体血流比,QpI=肺血流係数.Mann–WhitneyのU検定による比較を行った.カテゴリ変数の比較にはFisherの正確検定を行った.mPAP, mean pulmonary arterial pressure; mPAWP, mean pulmonary arterial wedge pressure; PVR, pulmonary vascular resistance; RAP, right atrial pressure. |
Table 3 当院にてASD閉鎖を施行した肺高血圧のないASD患者の閉鎖前後のMRIデータ | 15–64歳(n=25) | 65歳以上(n=9) |
|---|
| Before | After | p Value | Before | After | p Value |
|---|
| LVEDVI ml/m2 | 62.5±2.0 | 72.3±2.1 | <0.001 | 52.2±3.9 | 52.9±4.4 | 0.855 |
| LVESVI ml/m2 | 26.4±1.5 | 31.1±1.5 | <0.001 | 19.4±3.0 | 19.7±2.0 | 0.907 |
| LVEF % | 58.1±1.5 | 56.9±1.2 | 0.309 | 62.5±3.2 | 62.3±3.1 | 0.967 |
| RVEDVI ml/m2 | 130.9±4.8 | 94.6±2.8 | <0.001 | 121.2±12.1 | 74.9±4.4 | <0.001 |
| RVESVI ml/m2 | 66.5±3.6 | 50.2±1.9 | <0.001 | 55.9±7.3 | 36.3±3.4 | 0.004 |
| RVEF % | 49.8±1.5 | 47.1±0.9 | 0.021 | 54.7±2.4 | 51.9±2.5 | 0.465 |
| LVEDVI, left ventricular end-diastolic volume index; LVEF, left ventricular ejection fraction; LVESVI, left ventricular end-systolic volume index; RVEDVI, right ventricular end-diastolic volume index; RVEF, right ventricular ejection fraction; RVESVI, right ventricular end-systolic volume index. |
④肺高血圧
成人では長期にわたる肺血流量増加から,肺動脈性肺高血圧(pulmonary arterial hypertension: PAH)を合併する症例も少なくない.これまで肺高血圧を伴ったASDに対する閉鎖は推奨されていなかったが,近年の肺高血圧治療薬の進歩に伴い,PAH合併症例に対し,肺高血圧治療薬で肺動脈圧を十分にコントロールした後に,ASDを閉鎖する“Treat and Repair”という治療戦略が有効であることが報告されてきており,注目されている.Treat and Repairに関しての詳細は別項に譲る.
⑤非心臓手術における留意点
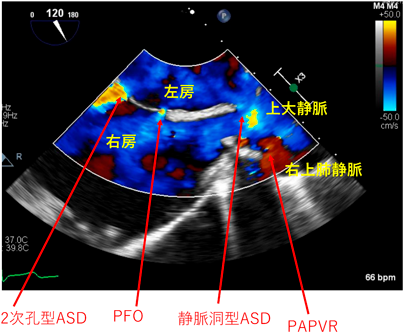
高齢患者では悪性腫瘍などで非心臓手術を行う機会も多い.ASDは心不全や肺高血圧症を来していなければ全身麻酔下での手術において血行動態的に問題になることはないが,手術術式において気をつけるべき点がある.近年,低侵襲な腹腔鏡手術やロボット支援手術が積極的に選択されることが多いが,いずれも二酸化炭素ガスで腹腔内を膨らませる(気腹)して手技を行うことから,気腹および二酸化炭素ガスの循環への影響に留意する必要がある.気腹による腹腔内圧上昇から胸腔内圧が上昇し,中心静脈圧は上昇する.また,高い気腹圧による塞栓症リスクもある.骨盤内手術においてはトレンデレンブルグ体位による循環動態の変化も起こる.ASD患者では気腹による塞栓症が脳梗塞につながるため,気腹しての手術はできる限り避け,必要時には厳密なモニタリングをしながら手術を行うことが望ましい.当院で,高齢のため前立腺癌に対するロボット支援手術を行ったASD, 部分的肺静脈還流異常(PAPVR)の72歳患者ではスワンガンツカテーテルおよび術中経食道超音波にて厳密なモニタリングをしながら手術を行った.頭低位25度で肺動脈圧の一過性上昇,また気腹を10 mmHgから15 mmHgに強化した際に高CO2血症と肺動脈圧の一時的な上昇を認めたものの,右左短絡は術中を通して認めなかった(Fig. 4).緊急性がなく悪性腫瘍の手術でない場合など状況に応じて短絡閉鎖を先行して行うことも検討される.
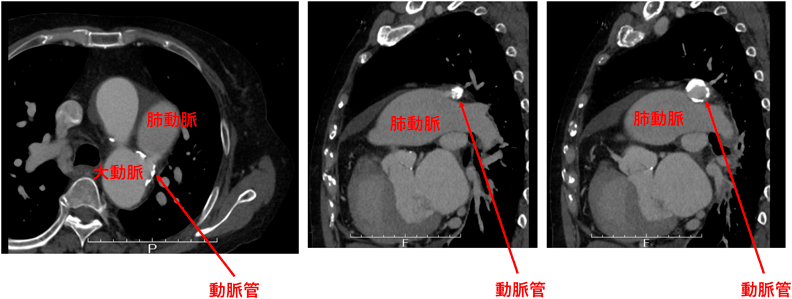
有意な短絡を伴うPDAの多くは小児期に診断・治療されており未治療で成人期に達することはまれである.しかし,小さい短絡の場合,小児期に症状が顕性化せず成人期に見つかることもある.高齢者では左室拡張能の低下から小短絡でもシャントによる左室容量負荷により心不全を来すことがある.近年心不全を契機に発見される高齢PDA症例が増えている.PDA自体が感染性心内膜炎,血栓形成のリスクにもなる.左室容量負荷を来していて,Eisenmenger化していないPDAでは閉鎖が推奨される13).しかし,成人期PDAを外科的に閉鎖するには小児期のように側開胸で直接結紮を行うことは困難で,人工心肺を用いた開心術を選択する必要があるためハイリスクであるという理由から,高齢PDA患者は経過観察されることも多かった.近年のカテーテル治療の普及により,閉鎖が行われる症例が増えている.高齢者の場合,PDA周囲やPDAそのものに石灰化を来していることが多く(Fig. 5)慎重に評価が必要である.造影CT検査による形態評価は成人のPDAではデバイス選択,治療方針決定のために非常に有用である.高齢PDAでは径が大きなものが多く,石灰化病変を伴っていることが多いためカテーテル治療後も残存短絡が生じやすく,溶血を合併するリスクも高い.術後のフォローアップは重要である.動脈管の径が大きい場合や石灰化でデバイス閉鎖が困難な場合には,大動脈ステントグラフトを使用して治療した報告もある14).