小児・先天性心疾患の心臓再同期療法CRTについてCardiac Resynchronization Therapy in Pediatrics
大阪市立総合医療センター小児不整脈科Department of Pediatric Electrophysiology, Osaka City General Hospital ◇ Osaka, Japan
心臓再同期療法(CRT)は,デバイスを用いて心不全を治療する方法である.成人では心不全の治療法の一つとして確立している.成人では拡張型心筋症(DCM)患者に多く用いられているが,小児のDCMに対するCRTの効果については確立していない.小児の完全房室ブロックに対するペースメーカ治療で,心室リードが右室自由壁や右室流出路に留置されていることが原因でペースメーカ誘発性心筋症を発症することがある.小児のペースメーカ誘発性心筋症に対してのCRTの効果は確立されている.それ以外の小児や先天性心疾患(CHD)に対するCRTについても有効であるという報告は散見されるが,小児やCHD症例は,その特殊性や多様性からCRTのガイドライン化は困難であり,症例ごとにその適応を十分検討する必要がある.
Cardiac resynchronization therapy (CRT) is a method of treating heart failure using a device. It is an established treatment for heart failure in adults, most commonly in patients with dilated cardiomyopathy (DCM). However, its efficacy in children with DCM has not been established. Pacemaker-induced cardiomyopathy may occur during pacemaker therapy for complete atrioventricular block in children because the ventricular lead is placed in the right ventricular free wall or outflow tract. The efficacy of CRT for pacemaker-induced cardiomyopathy in children is well established. However, the uniqueness and diversity of pediatric and congenital heart diseases make it difficult to establish guidelines for CRT; thus, CRT indications should be carefully considered in each case.
Key words: cardiac resynchronization therapy; congenital heart disease; pediatric
© 2023 特定非営利活動法人日本小児循環器学会© 2023 Japanese Society of Pediatric Cardiology and Cardiac Surgery
心臓再同期療法(cardiac resynchronization therapy: CRT)は,デバイスを用いて心不全を治療する方法である.
心不全に対しては,2000年までは薬物療法が主流であった.症状が改善しない重症心不全に対する次の治療手段は,心臓移植しかないという状況であった.CRTはそれを補完する心不全に対する薬物療法以外の選択肢の一つとして重要な役割を果たすようになった.
CRTが日本で保険償還されたのは2004年である.CRTはこれまで行われてきた通常のペースメーカ治療,右心房と右心室のペーシングに加え,左心室にリードを留置してペーシングすることにより心室の同期性を改善するという治療概念である.成人では主に,左脚ブロック(left bundle branch block: LBBB)を伴う拡張型心筋症(dilated cardiomyopathy: DCM)の病態に効果が報告されるようになり,約7割で心機能の改善が期待できるとされてきた.しかし,小児患者は心不全の原因が先天性心疾患(congenital heart disease: CHD)によるなど多岐にわたり,成人の典型的なCRTの基準は適合しない.小児の心不全症例の多様性は,小児に対するCRTの効果を議論するときに常に大きな問題となるが,これまで様々な報告が重ねられてきていた.本稿では,小児およびCHDにおけるCRTについてこれまでの報告を概説し自験例を呈示する.
成人の領域において,CRTは重度の収縮機能障害を認めるLBBBのDCM患者に最も多く用いられており,その効果は多数報告されている.Cardiac Resynchronization Heart Failure(CARE-HF)試験では,3か月以内に左室収縮能(LVEF)が4%向上し,Multicenter InSync Randomized Clinical Evaluation(MIRACLE)試験では,CRT導入後6か月以内に5%の向上が認めらた1, 2).しかしCRTが反応しない症例が約3割あり,CRT不応症例の層別化が問題となっている.QRS時間,LBBBの有無,症状の重症度(NYHA)による層別化が図られている.成人のCRTの適応基準の概略をTable 13)に示す.
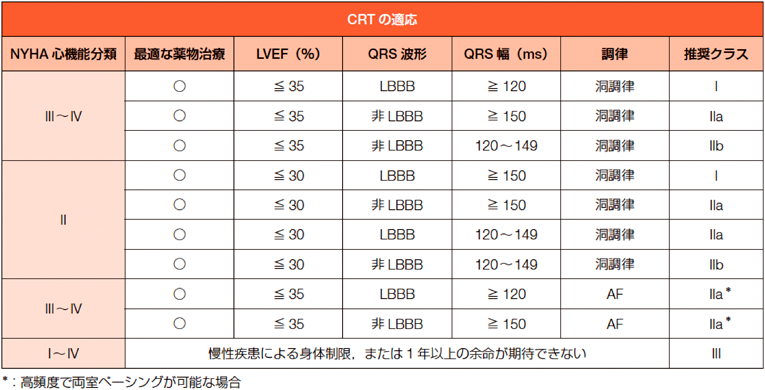 |
| 日本循環器学会/日本不整脈心電学会合同ガイドライン 不整脈非薬物治療ガイドライン2018年改訂版,表37 |
成人に対するCRT適応を小児症例に応用することが試みられてきた.しかし小児の心不全症例は,解剖学的にも心不全の病因も多彩であり,単純に成人の経験を小児に適応することはできない.
小児では,原因となる心疾患が,DCMや虚血性心疾患が主な適応となる成人とは大きく異なる.小児患者を対象とした研究のレビュー4–7)によると,成人とは異なり,CHDが大半を占め,次いで心筋症,完全房室ブロックが多く,LBBB等の伝導障害は少数であった(Table 2)8).Dubinらは,103人の小児および成人のCHD患者(年齢中央値:12.8歳)の大規模コホートを報告している4).この報告ではCHD患者73人(71%),心筋症患者16人(15%),先天性完全房室ブロック患者14人(13%)の3群を比較検討している.ほぼ半数(45%)は,CRTデバイスを装着する前にペースメーカを装着していた.追跡期間中(平均4.5か月),QRS時間は38 ms(166 msから126 ms),EFは14%(26%から40%)改善した.QRS期間とEFの改善は3群すべてで認められ,3群間の予後に有意差はなかった.11%がCRT不応例症例だった.CRT不応例の定義は,CRT留置後にEFが悪化した,または変化がなかった症例と定義した.CRT不応症例はベースラインのEFが高かったが(32% vs 24%; p=0.04),CRTによる心不全改善症例群との間にほかの有意差を認めていない.
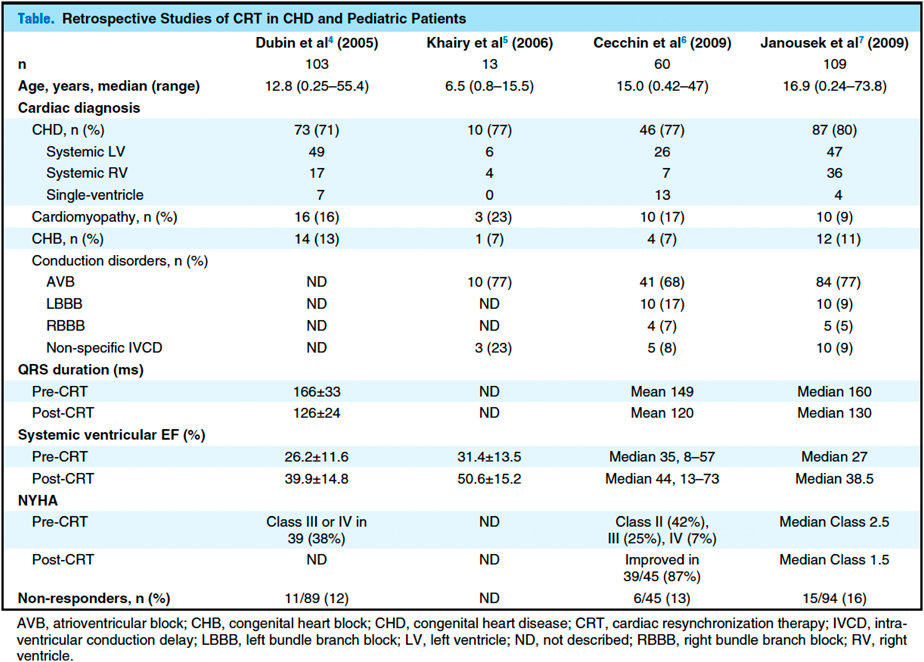 |
| 文献8,p. 1581より転載. |
Janoušekらは,Dubinらの研究に比べてCHD患者の割合が高い(80%)109人のCRT症例の多施設コホートを報告している7).このコホートの症例の77%は,右心室ペーシングに伴う心室非同期を認めており,23%は脚や心室の伝導障害による心室非同期を認めたと記載している.23%の内訳は,9%が体心室左室を伴うLBBB, 5%が体心室右室を伴う右脚ブロック(RBBB),9%は心室の伝導障害によるQRS延長を認めていた.追跡期間中(中央値:7か月),QRS時間(CRT前160 msからCRT後120 ms)とEF(CRT前27%からCRT後39%)に同様の改善がみられた.Janoušekらは,Dubinらと比較して,より多くの患者(19%)がCRT治療に不応であったことを示し,CRT治療に不応の予測因子は,NYHA機能分類が高値であることとDCMであったと解析している7).CRT後の心機能改善の予測因子は,体心室が左心室形態であることであった.
これら2つのCRTの報告は,小児心不全患者の解剖学的多様性,心不全の原因の多様性を示しており,成人のCRTデータをそのまま小児患者に適応することは適切ではないことが示されている.
小児のCRTを議論するとき,心室非同期をどのように評価するかという技術的な課題もある.小児の拡張型心筋症では,電気的非同期(electrical dyssynchrony)と機械的非同期(mechanical dysshynchrony)が共存していない症例が多いと報告されている9, 10).この問題については小児のDCMの項で解説する.
機械的非同期の評価方法の一つとして,カテーテル心室圧波形のdP/dt maxがCRTにより15%以上増加することが,NYHA分類の改善と相関することが示されている11).
心エコー検査も機械的左室非同期の評価に用いられており,多くのパラメータが提案されている.しかし,日本で行われた多施設共同前向き研究(J-CRT研究)12)では,CRTの反応を有意に予測できる単一の心エコー基準は見つからなかった.この報告ではさらにCRTの反応はECGのLBBBと強く相関していると報告されている.この結果は,LBBBではなくRBBBがQRS時間が広くなる原因であることが多い小児症例や,様々な心室形態が含まれるCHD症例ではCRTの反応を予測することが困難であることを示している.
Seoらは電気的非同期の評価の指標としてCARTO 3D mapping systemを用いた,心室の電気的興奮伝播を示すactivation mapを使用し,機械的非同期の評価の指標として心エコーのスペックルトラッキングを使用して両者の比較を行い,その有用性を報告した13).この方法は,単心室を含む様々な心室形態を有するCHD患者においても有用である可能性がある.
小児,CHDにおけるCRTは,様々な要因により制限される.
成人で使用される経静脈リードの使用は,右左シャントを有するCHD症例では禁忌とされている.細い静脈,小さい体格も経静脈リードの使用を困難にする.CHD症例では左室リード留置に使用する冠静脈洞の形態異常も多い.
2014年の全国調査では,15歳以下の小児症例の約90%で,心筋リードを用いたCRTを施行されていた14).
CRTの心筋リードを留置する心室の部位も大きな問題である.
両心室の,もっとも遅れて興奮している場所を造影所見やエコー所見から同定し,その場所とその対側の心室に留置するのが基本的な考え方である.QRS時間がもっとも狭くなる場所も電気的非同期を改善させる一つの指標だが,最終的には機械的非同期が改善する場所に留置することを優先してペーシングする場所を決めることが重要である.
Miyazakiらは,CRTを施行した24症例,27手技について報告している15).CRTが有効だった症例は27手技中,17手技,63%に認めた.CRT不応例の10例の理由として,CRTのリード位置が適切ではなかった症例が4例,心室内伝導遅延がない症例,心不全症状がなかった症例が5例存在し,この9例を除くと,CRTの有効率は16手技中14手技,88%になる.特に体心室右室では,短軸方向だけでなく,長軸方向の非同期にも配慮してリード位置を検討する必要がある,と考察している15).
Friedbergらは,小児DCM症例の約65%が機械的非同期を示したが,機械的非同期の有無でQRS時間に差を認めなかったことを報告した(平均87 ms vs 85 ms)9).Chenらは,小児のDCM 89例の平均QRS時間は93 msで,120 msを越える症例は18%しかいなかったと報告している16).
小児患者における機械的左室非同期と電気的左室非同期に相関がないことは,成人に置いてCRTがもっともよい適応とされているDCMについて,小児ではCRT不応例が多いことの理由と一つとして挙げられている.
Schillerらは,52症例のDCM症例の検討で,小児のDCM症例はLBBBが少なく,QRS時間が短い症例が多く,CRTの成人クラスI基準を満たした患者はいなかったと報告している17).
小児DCM症例のCRT適応を検討する場合は,機械的非同期と電気的非同期の違いを考慮しながら,留置する場所について十分検討することが重要だが,CRTの適応となるかどうかについても症例ごとに十分検討して判断する必要がある.
左室非同期による心不全を有する小児患者の重要な疾患群の一つとして,ペースメーカ誘発性心筋症があげられる.Gebauerらは,恒久的ペースメーカで心室ペーシングしている小児患者の約13%が,右心室に留置したリードによる左室非同期により心不全を来すと報告している18).特に,右室流出路ペーシングや右室心外膜ペーシングは,左室収縮能の低下(EF<45%)のオッズ比が10.7となり,左室心尖部や左室中側壁のペーシングは左室収縮能維持(EF≧55%)のオッズ比が8.3となると報告している19).
ペースメーカ誘発性心筋症患者では,CRTによるQRS時間の有意な改善(37~40 ms)が報告されている4, 7).ペースメーカ誘発性心筋症患者のQRS時間がかなり延長する傾向があることも関連している(中央値155 ms).これらの患者では,CRTにより,EFも16~23%改善していることが示されている.
小児のペースメーカ誘発性心筋症症例は,CRTを受けた小児症例の約半数以上になると報告されている(45~78%)7, 20).
Janoušekらの報告では,DCM患者とは対照的に,ペースメーカ誘発性心筋症患者はCRTにより安定した臨床状態の改善を示している.NYHA機能クラスの中央値がクラスIIから1レベル改善しており,CRT不応例は16%と報告している7).
ペースメーカ誘発性心筋症におけるCRTが,ほかの小児CRT症例と比較して明らかに反応が良い理由として,ペースメーカ誘発性心筋症の心室筋の機能は比較的正常であることが原因かもしれない,と考察している.
CHD症例に対するCRTについては,CHDの多様性により,それぞれ個別の評価,判断が必要であり,ガイドライン化は難しい.
CHDのCRT適応に関するガイドラインへの記載は,成人先天性心疾患(ACHD)に対して2014年,PACES/HRS expert consensus statementで初めて記載された21).ここでは,ACHDを体心室左室,体心室右室,単心室に分けて,それぞれEF 35%以下,QRS時間150 m以上,120~149 ms,心室pacing率が40%以上の項目で層別化して記載している.
2020年のESCのACHDに対するガイドラインには,体心室左室症例について,EF<35%,narrow QRSに対してCRTが推奨されると記載されているが,CRTに関してそれ以上の記載はなく,表も記載されていない22).
2021年に発表された小児に対するデバイス治療のPACES expert consensusにもCRTの記載はないが,今後,cardiac physiological pacingに関してのHRS expert consensus statementで小児のCRTについて言及すると記載されており,今後の報告が待たれる23).
2018年に作成された不整脈非薬物治療ガイドラインには,CHDのCRTの適応について記載されている(Table 3)3).成人のCRT基準に準じて,体心室左室,体心室右室,単心室に分けて,EF 35%,QRS時間120 ms,心室ペーシング率40%を基準として層別化している.
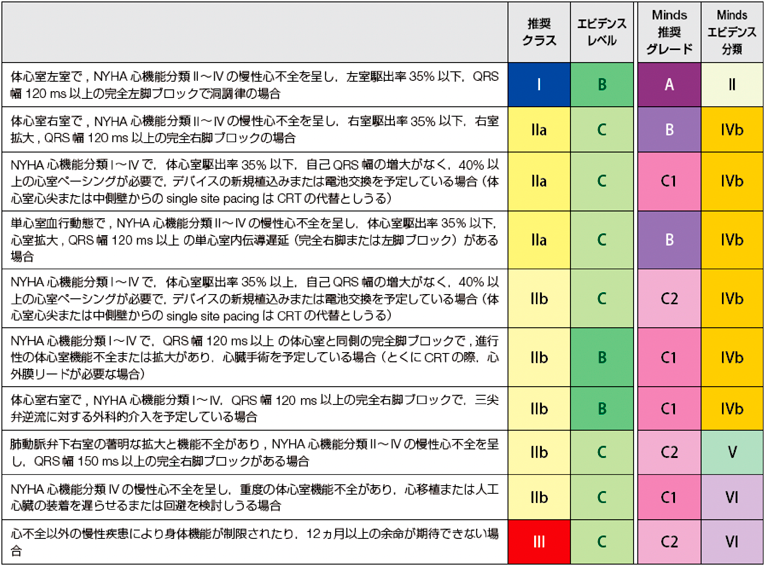 |
| 日本循環器学会/日本不整脈心電学会合同ガイドライン 不整脈非薬物治療ガイドライン2018年改訂版,表43 |
修正大血管転位(congenitally corrected transposition of the great arteries: ccTGA)やdouble switch手術(double switch operation: DSO)後の完全大血管転位(transposition of the great arteries: TGA)は,体心室が右室形態となり,成人後に体心室右室の心機能低下を来すことがある24, 25).これらの疾患群は,体心室右室の同期不全を合併していることがあり,CRTの適応が議論されている4, 5, 7).ccTGAは房室ブロックを併発することもあり,房室ブロックの対する治療介入の時に最初からCRTにしたほうがよいのか,心機能が良い症例では,最初からCRTにしないでDDDペーシングにするのがよいのか議論されている.これらの報告ではCRTによりQRS時間は短縮し,EFが増加することが報告されている.しかし臨床状態が改善した症例の割合は25%から100%と幅がある.
近年の報告では,Jacquemartらが,CHD 85症例を体心室右室31症例と体心室左室49症例を比較検討して報告している26).CRT後のQRS時間の変化は,体心室左室と体心室右室でほぼ同等(体心室左室35 ms±32 ms vs 体心室右室46 ms±26 ms,p=0.16)であった.EF 10%以上の改善,もくしはNYHA 1グレード以上の改善をCRTによる心不全改善,と定義して,6か月,12か月,24か月後の改善症例について検討している.体心室左室は66.7%, 64.3%, 69.6%,体心室右室は82.6%, 80.0%, 77.8%と解析し,両群に差がないと報告した.この報告では体心室右室の約80%にCRTの効果があり,体心室左室と比較して差を認めなかったと結論している.
体心室右室は,体心室の房室弁逆流が問題となるが,CRTにより体心室の房室弁逆流が改善するというデータはこれまで示されていない.体心室右室に対するCRTの効果は報告により様々であり,CRTの適応を決定する基準は今後も議論が必要である.
単心室は,さらに症例ごとに異なる心室形態と病態となり,心筋線維化や容積負荷,容量負荷,房室弁逆流によって心不全の病態も異なるため,定型的なガイドラインの作成は困難である.
そのようななかでも,単心室に対するCRTの報告の記載も散見される4, 5, 7).CRTはQRS時間を短縮させるが,臨床的な改善の割合については様々である(26~91%).単心室形態においても,CRTの臨床効果がQRS時間の短縮と必ずしも相関しない理由の一つとして,Motonagaらは電気的非同期と機械的非同期の相関がないことをあげている10).左心低形成症候群の11例において,心エコーによる評価を検討すると,著明な機械的非同期を認めたが,電気的非同期の指標であるQRS時間はcontrol群と差を認めなかった.
単心室のCHDに対するCRT適応の判断も,他の疾患群と同様に,個別の症例ごとのCRT適応判断とリード位置の検討,植込み後のpacing条件の設定を十分検討することが必要である.
本院での小児のCHDのCRTの自験例2例を呈示する.
完全大血管転位,術後完全左脚ブロック
生後2か月で肺動脈絞扼術,生後7か月でJatene手術を施行し,術後完全左脚ブロックとなった.術後の左室収縮能は60~70%と正常範囲内であったが,その後の経過で徐々に低下を認めた.10年間,利尿剤,ACE阻害薬,ベータブロッカー投与を行ったが,11歳の時は運動時息切れを認め,生活管理指導区分は「C」で管理されていた.Fig. 1に胸部レントゲンの経過を示す.
11歳時の心電図は洞調律のLBBBで,QRS時間は170 msであった.BNP 238 pg/mL,NTproBNP 2,296 pg/mLまで上昇した.エコー所見はLVIDd 62 mm,155% of Normal,LVEFはTeichholzで25%,Simpsonで31%と低下していた(Fig. 1).
LBBBの左室非同期による心不全症例でCRTの適応と判断した.11歳で体重は身長142 cm,38 kgの体格に対して,経静脈的にCRTPデバイスの植込みを行った.CRTにより,心電図のQRS時間は170 msから150 msに短縮した(Fig. 2).
その後の胸部レントゲン,BNP値の経過を示す(Fig. 3).
胸部レントゲンCTRは術前の68%から3か月後には56%,4年後には52%に改善した.
心エコーのLVIDdは62 mm,155% of Nから4年後には46 mm,93% of N,LVEFはTeichholzで25%から62%,Simpsonで31%から54%まで改善した.臨床的にも活発になり,運動時の息切れなども消失した.生活管理指導区分は「D」で管理中である.
CHD術後のLBBB,左室非同期による心不全症例で,CRTが著効した症例である.
ファロ−四徴症,術後完全房室ブロック
生後14日,生後5か月で左右にBTシャント手術を施行し,1歳1か月で心内修復手術を施行した.術後完全房室ブロックを来し,1歳3か月で心筋リードによるペースメーカ留置手術が行われた.心室リードは右室流出路に装着されていた.2歳の時,臨床的には心不全症状を認めなかったが,胸部レントゲンで心内修復手術前54%のCTRは67%まで拡大を認めた.BNP 634 pg/mL,NTproBNP 5,384 pg/mLと上昇しており,心電図はQRS時間180 msの右室pacing波形でLBBBを呈していた.CRTの適応と判断し,開胸して左室リード追加手術を施行した.2か月後の心臓カテーテル検査では,LVEFは32%から50%に改善した.BNPは2か月で634 pg/mLから167 pg/mL,NTproBNPは5,384 pg/mLから1,578 pg/mLまで改善した.経過をFig. 4に示す.
本症例は,CRT手術の1年後にリード感染のため,CRTシステム全抜去を余儀なくされ,その後もリード感染を繰り返した経過から最終的にVVIのsingle pacingでの管理された.しかし心不全の増悪は認めなかった.心室リードが左室心尖部に装着されていたことが,再度の心不全惹起をきたさなかった原因と考えられた.16歳で経静脈的アプローチによるCRT systemに変更した.
Matsuhisaらは,右室心外膜ペーシングによる心不全が左室単独ペーシングにより改善すると報告している27).症例2のように,左室非同期による心不全は,CRTだけでなく,左室心尖部単独ペーシングでも心不全が改善する可能性があることを知っておくことは治療の選択肢の幅を広げてくれる.
CRTは成人の心不全患者において有効な治療法であることが証明されているが,EFが低く,LBBBによりQRS時間が延長しているという従来の成人のCRTの基準を満たしている小児患者は少ない.小児のペースメーカ誘発性心筋症におけるCRTの役割は明確であると思われるが,他の小児症例,CHD症例に対するCRTの適応については今後もさらなる検討が必要である.
本稿について申告すべき利益相反はありません.
本稿は小児循環器学会第19回教育セミナーの内容を中心に執筆した.
1) Cleland JGF, Daubert J-C, Erdmann E, et al: Cardiac Resynchronization-Heart Failure (CARE-HF) Study Investigators: The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352: 1539–1549
2) Abraham WT, Fisher WG, Smith AL, et al: MIRACLE Study Group. Multicenter InSync Randomized Clinical Evaluation: Cardiac resynchronization in chronic heart failure. N Engl J Med 2002; 346: 1845–1853
3) 栗田隆志,野上昭彦,草野研吾ほか:日本循環器学会/日本不整脈心電学会合同ガイドライン:不整脈非薬物治療ガイドライン(2018年改訂版).http://www.j-circ.or.jp/guideline/pdf/JCS2018_kurita_nogami.pdf (2022年12月閲覧)
4) Dubin AM, Janousek J, Rhee E, et al: Resynchronization therapy in pediatric and congenital heart disease patients. J Am Coll Cardiol 2005; 46: 2277–2283
5) Cecchin F, Frangini PA, Brown DW, et al: Cardiac resynchronization therapy (and multisite pacing) in pediatrics and congenital heart disease: Five years experience in a single institution. J Cardiovasc Electrophysiol 2009; 20: 58–65
6) Khairy P, Fournier A, Thibault B, et al: Cardiac resynchronization therapy in congenital heart disease. Int J Cardiol 2006; 109: 160–168
7) Janousek J, Gebauer RA, Abdul-Khaliq H, et al: Working Group for Cardiac Dysrhythmias and Electrophysiology of the Association for European Paediatric Cardiology: Cardiac resynchronisation therapy in paediatric and congenital heart disease: Differential effects in various anatomical and functional substrates. Heart 2009; 95: 1165–1171
8) Horigome H: Current status and future direction of cardiac resynchronization therapy for congenital heart disease and pediatric patients. Circ J 2014; 78: 1579–1581
9) Friedberg MK, Roche SL, Balasingam M, et al: Evaluation of mechanical dyssynchrony in children with idiopathic dilated cardiomyopathy and associated clinical outcomes. Am J Cardiol 2008; 101: 1191–1195
10) Motonaga KS, Miyake CY, Rajesh P, et al: Insights into dyssynchrony in Hypoplastic Left Heart Syndrome. Heart Rhythm 2012; 9: 2010–2015
11) Karpawich PP, Bansal N, Samuel S, et al: 16 years of cardiac resynchronization pacing among Congenital heart disease patients: Direct contractility (dP/dt-max) screening when the guidelines do not apply. JACC Clin Electrophysiol 2017; 3: 830–841
12) Seo Y, Ito H, Nakatani S, et al: J-CRT investigators: The role of echocardiography in predicting responders to cardiac resynchronization therapy. Circ J 2011; 75: 1156–1163
13) Seo Y, Yamasaki H, Kawamura R, et al: Left ventricular activation imaging by 3-dimensional speckle-tracking echocardiography: Comparison with electrical activation mapping. Circ J 2013; 77: 2481–2489
14) Suzuki T, Sumitomo N, Yoshimoto J, et al: Current trends in use of implantable cardioverter defibrillators and cardiac resynchronization therapy with a pacemaker or defibrillator in Japanese pediatric patients: results from a nationwide questionnaire survey. Circ J 2014; 78: 1710–1716
15) Miyazaki A, Negishi J, Hayama Y, et al: Evaluating the response to cardiac resynchronization therapy performed with a new ventricular morphology-based strategy for congenital heart disease. Heart Vessels 2019; 34: 1340–1350
16) Chen CA, Hsiao CH, Wang JK, et al: Implication of QRS prolongation and its relation to mechanical dyssynchrony in idiopathic dilated cardiomyopathy in childhood. Am J Cardiol 2009; 103: 103–109
17) Schiller O, Dham N, Greene EA, et al: Pediatric dilated cardiomyopathy patients do not meet traditional cardiac resynchronization criteria. J Cardiovasc Electrophysiol 2015; 26: 885–889
18) Gebauer RA, Tomek V, Salameh A, et al: Predictors of left ventricular remodelling and failure in right ventricular pacing in the young. Eur Heart J 2009; 30: 1097–1104
19) Janoušek J, van Geldorp IE, Krupičková S, et al: Working Group for Cardiac Dysrhythmias and Electrophysiology of the Association for European Pediatric Cardiology: Permanent cardiac pacing in children: Choosing the optimal pacing site: A multicenter study. Circulation 2013; 127: 613–623
20) Motonaga KS, Dubin AM: Cardiac resynchronization therapy for pediatric patients with heart failure and congenital heart disease: A reappraisal of results. Circulation 2014; 129: 1879–1891
21) Khairy P, Van Hare GF, Balaji S, et al: PACES/HRS expert consensus statement on the recognition and management of arrhythmias in adult congenital heart disease: Developed in partnership between the Pediatric and Congenital Electrophysiology Society (PACES) and the Heart Rhythm Society (HRS). Endorsed by the governing bodies of PACES, HRS, the American College of Cardiology (ACC), the American Heart Association (AHA), the European Heart Rhythm Association (EHRA), the Canadian Heart Rhythm Society (CHRS), and the International Society for Adult Congenital Heart Disease (ISACHD). Heart Rhythm 2014; 11: e102–e165
22) Baumgartner H, Backer JD, Babu-Narayan Sonya V: 2020 ESC Guidelines for the management of adult congenital heart disease: The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC). Eur Heart J 2020; 42: ehaa554
23) Shah MJ, Silka MJ, Silva JNA, et al: Writing Committee Members: 2021 PACES expert consensus statement on the indications and management of cardiovascular implantable electronic devices in pediatric patients. Heart Rhythm 2021; 18: 1888–1924
24) Rosenthal D, Chrisant MR, Edens E, et al: International Society for Heart and Lung Transplantation: Practice guidelines for management of heart failure in children. J Heart Lung Transplant 2004; 23: 1313–1333
25) Khairy P, Landzberg MJ, Lambert J, et al: Long-term outcomes after the atrial switch for surgical correction of transposition: A meta-analysis comparing the Mustard and Senning procedures. Cardiol Young 2004; 14: 284–292
26) Jacquemart E, Combes N, Duthoit G, et al: Cardiac resynchronization therapy in patients with congenital heart disease and systemic right ventricle. Heart Rhythm 2022; 19: 658–666
27) Matsuhisa H, Oshima Y, Maruo A, et al: Pacing therapy in children. Circ J 2014; 78: 2972–2978
This page was created on 2023-12-08T11:07:47.925+09:00
This page was last modified on 2023-12-25T10:34:09.000+09:00
このサイトは(株)国際文献社によって運用されています。