症例
29歳,女性
主訴
腹部膨満,失神,動悸,息切れ,易疲労感
既往歴
特記すべきことなし
家族歴
特記すべきことなし
現病歴
在胎41週3日.出生時体重3,129 g.出生後すぐチアノーゼと努力呼吸認めA病院新生児集中治療室に搬送され,心エコーで肺動脈閉鎖を伴う心房位逆位の修正大血管転位症と診断された.手術目的にB病院に転送され,生後1か月時に右肋間開胸アプローチで右体肺動脈短絡術(original Blalock–Taussig shunt),さらに4日後に左肋間開胸アプローチで左体肺動脈短絡術(original Blalock–Taussig shunt)施行された.5歳時にB病院でMustard-REV typeのダブルスイッチ手術および僧帽弁形成術が行われたが,僧帽弁閉鎖不全の増悪により2日後に機械弁St. Jude Medical®(SJM)23 mm(St. Jude Medical, Inc., St. Paul, MN, USA)で僧帽弁置換術施行され2日後に2期的胸骨閉鎖となった.さらに1か月後,人工弁周囲逆流に対して逆流修復術が行われた.9歳時には左室流出路狭窄とREV procedureによる右室流出路再建部の狭窄兼閉鎖不全に対してC病院で心室中隔欠損の後方拡大と再心室内血流転換による左室流出路狭窄解除および再右室流出路再建術が施行された.以後転居に伴い当院小児科に紹介され外来経過観察となる.17歳時,三尖弁閉鎖不全進行による心不全および心房内のbuffle leakによるチアノーゼが進行したためC病院紹介し機械弁ATS® 29 mm(ATS Medical, Inc., Minneapolis, MN, USA)での三尖弁置換およびbuffle leakの閉鎖術が施行され数日後に2期的胸骨閉鎖されている.その後の経過は比較的安定し再び当院小児科で経過観察継続されたが,21歳頃から左室流出路狭窄が再進行するようになるとともに動悸,息切れ,易疲労感出現し,抗不整脈やβ遮断薬などの薬物治療が強化された.26歳時,当院小児科入院し心臓カテーテル検査が施行され,右房圧18 mmHg,左室流出路圧較差30 mmHg, Sellers II度の大動脈弁逆流が確認されていた.29歳になると腹水貯留による腹部膨満が出現して食事摂取困難となり,腹腔穿刺ドレナージのために入退院を繰り返すようになった.また,食事中に30秒程度の失神発作出現.植え込み型心電計により非持続性心室頻拍が確認され,精査目的に当院小児科入院となった.
入院時所見
身長160.1 cm,体重41.3 kg,腹囲75.0 cm.経皮的酸素飽和度96%.脈拍102回/分・不整,胸部聴診上胸骨左縁第3肋間に最強点を有するLevine III/VIの収縮期駆出性雑音および拡張期雑音を聴取し,人工弁のクリック音は正常であった.腹部は著明に膨満し打診により波動を触知した.
術前検査所見
血液検査
白血球4,680/µL,ヘモグロビン12.0 g/dL,血小板15.5×104/µL,総ビリルビン2.8 mg/dL,直接ビリルビン1.0 mg/dL, AST 24 U/L, ALT 10 U/L, BUN 33.0 mg/dL, Cr 0.69 mg/dL, BNP 655.9 pg/mL
胸部X線所見
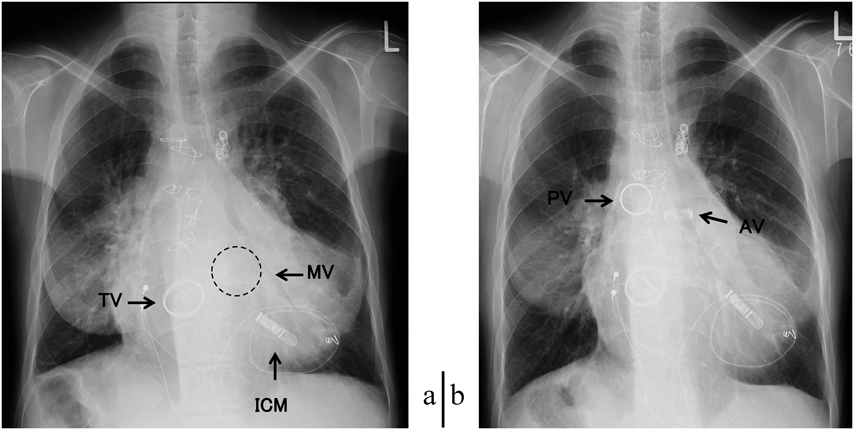
心胸郭比70%と拡大し左第4弓と右第2弓の突出を認めた.僧帽弁位と三尖弁位人工弁が確認される.内臓逆位のために気管支分岐も左右逆となっている(Fig. 1a).
心電図
心房細動88回/分f波は小さくはっきりしない.RV5+SV1で4.36 mVと左室肥大と完全右脚ブロック(QRS幅0.16秒)を認める.
心エコー検査
ドップラー上,左室流出路の最大圧較差116.2 mmHgと高度の左室流出路狭窄および中等度の大動脈弁閉鎖不全と高度の肺動脈弁閉鎖不全を認めた.左室駆出率は52.9%と低下していた.5度の胸骨正中切開の影響による描出不良の影響で左室流出路の流速の評価は過剰評価となった可能性はあった.僧帽弁位,三尖弁位機械弁の開閉は良好で明らかな弁周囲逆流はなく,人工弁における平均圧較差は僧帽弁位が7.4 mmHg,三尖弁位が2.9 mmHgであった.以前の他院での心エコー記録からの初期診断は,心房位逆位,d-loop, d-transposition,修正大血管転位,肺動脈閉鎖,単心房,大動脈弁下型心室中隔欠損,右側大動脈弓,両側上大静脈であった.
MDCT検査
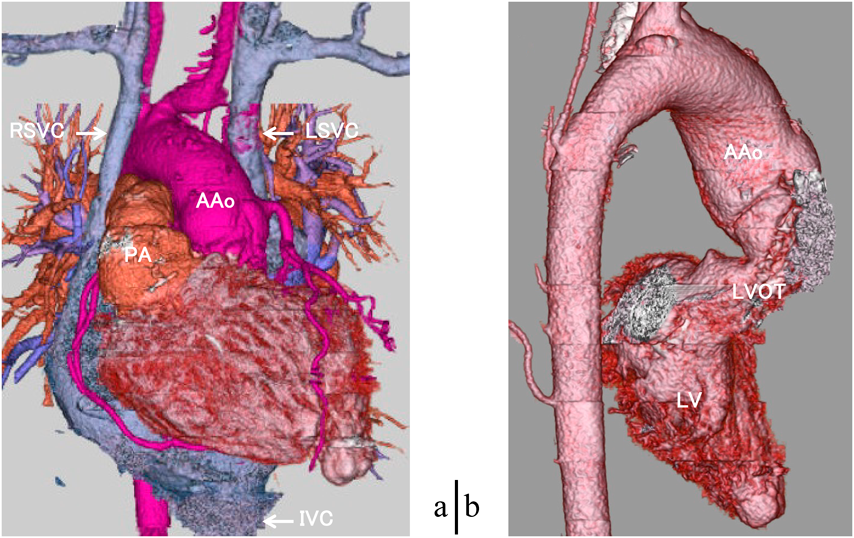
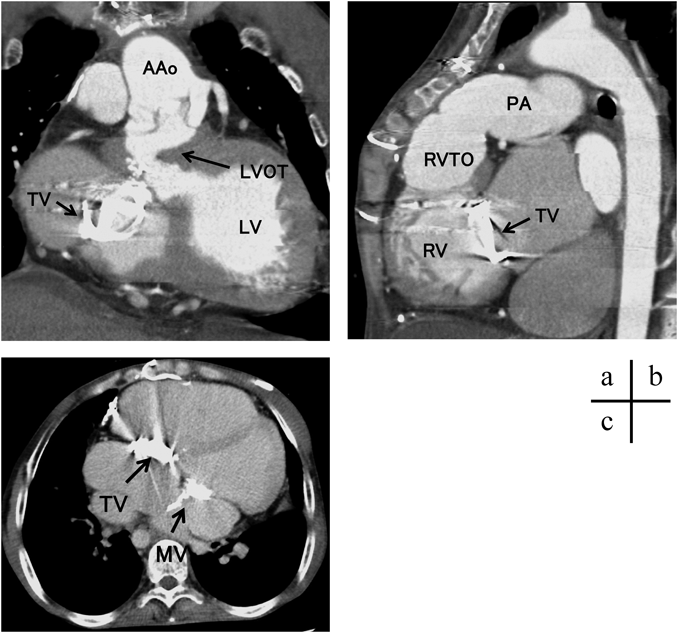
内臓逆位である.ダブルスイッチ手術後で大動脈は左,肺動脈は右,右側大動脈弓で両側鎖骨下動脈はoriginal Blalock–Taussig shunt後で閉塞.左側優位の両側上大静脈で下大静脈は椎体の左側で心房に還流し(Fig. 2a),左腸骨静脈は閉塞していた.大動脈弁下の左側を中心に著明な心筋の張り出しを認め左室流出路狭窄を形成していた(Fig. 2b, 3a).右室および右室流出路から肺動脈は拡張し胸骨を押し上げ(Fig. 3b, c),両心室はほぼ同等に拡大していた(Fig. 3c).
心臓カテーテル検査
右房圧19 mmHg,左室収縮期圧164 mmHg,左室拡張末期圧16 mmHg,上行大動脈圧90/40 mmHg,左室—大動脈引き抜き圧較差77 mmHg,左室駆出率47%,左室拡張末期容積215% of normal, Sellers III度の大動脈弁逆流を認めた.3年前に比較して左室流出路狭窄と大動脈弁閉鎖不全の進行が確認された.機械弁のために右室および肺動脈圧測定や右室造影はできなかったがMDCTで両心室が同等に拡大していることから,左室同様に右室の強い容量負荷も推測された.三尖弁位人工弁直前の右房から下大静脈への引き抜き圧較差はなくMustard procedureによる心房内血流転換による狭窄は認めなかった.
術前病態と治療方針
術前の状態をまとめると,①肺動脈閉鎖を合併したIDD型の修正大血管転位症に対するMustard-REV typeのダブルスイッチ手術後,②SJM 23による僧帽弁置換術後で,人工弁機能は問題ないが成長に伴う相対的軽度僧帽弁狭窄状態,③ATS 29による三尖弁置換術後で人工弁機能に問題なし,④圧較差77 mmHgと重度に進行した左室流出路狭窄,⑤左室流出路狭窄に起因すると思われる中等度以上の大動脈弁閉鎖不全,⑥右室流出路再建部における肺動脈弁機能消失による重度肺動脈弁閉鎖不全,⑦②④⑤⑥に起因すると思われる著明な中心静脈圧上昇,となる.以上により難治性腹水貯留,心室頻拍に伴う失神・動悸,息切れ,易疲労感などが進行した状態と思われた.治療方針としては,左室流出路狭窄は漏斗部中隔の張り出しを可及的に切除することで狭窄を確実に解除する.心電図上f波は不明確で心房細動に対する外科的治療適応はないと思われ,房室ブロック出現時はペースメーカー植え込みで対応することとした.さらに機械弁による大動脈弁位と肺動脈弁位の人工弁置換を予定し,僧帽弁位人工弁で平均圧較差7.4 mmHgの中等度狭窄所見があったが手術侵襲を考慮して放置することとした.
手術所見
5度目の胸骨正中切開に際して心臓と胸骨の癒着に備え,胸骨切開前に体外循環を確立することとした.径6 mm程度の細い両側大腿動脈に8 mm ePTFE graftを端側吻合し送血路とすることで長時間人工心肺中の下肢虚血に留意した.左大腿静脈閉塞のため右大腿静脈から下大静脈,左内頚静脈から左上大静脈に脱血カニューレを挿入して人工心肺を開始し,慎重に胸骨正中切開して開胸器をかけたが,心臓周囲の癒着が高度で通常の2/3程度にしか胸骨を広げることはできなかった.右室流出路から肺動脈前面は流出路パッチの石灰化と硬い癒着があった.上行大動脈も厚い癒着組織で覆われており,表面からエコーをあてて大動脈を確認しつつ大動脈遮断と大動脈弁上の切開が可能になるまで剥離し,その他の剥離は行わなかった.大動脈遮断し心筋保護液を順行性に注入したが心停止は得られず,大動脈切開して選択的冠還流後に心停止が得られた.切開部から大動脈弁越しに左室ベントを挿入した.大動脈弁下左側半周にわたり心筋の張り出しによる著明な左室流出路狭窄があり,可及的な心筋の切除により狭窄を解除した.大動脈弁は3弁であったが弁尖が厚く変性しており左室流出路狭窄の影響と思われた.弁尖を切除後Carbomedics®(CM)21 mm(Carbomedics, Inc., Austin, Tex, USA)でintra-anular positionに大動脈弁置換した.次いで肺動脈を切開すると異種心膜と思われるパッチが硬く変性し縫合不可能な組織であったため,変性した右室流出路パッチは全切除した.肺動脈弁機能に関係するような組織は確認できなかった.弁置換部位は想定外に狭くCM®21は装着できないためATS® 20 mm(ATS Medical, Inc., Minneapolis, MN, USA)を選択し肺動脈後壁に半周縫合固定した.右室流出路から肺動脈の欠損部はHemashield® woven graft fabric(Intervascular SA, Inc., Provence, France)でパッチ閉鎖,機械弁の前方半周をこのパッチに縫合固定した.右室流出路パッチ縫合前に大動脈遮断解除し,肺動脈ベントを使用して左室の拡張障害を予防した.さらにあらかじめ人工心肺開始前に剥離し肋骨弓下から引き出しておいた前回手術時に植え込まれた心室心外膜リードを使用して心室ペーシングし心拍動は再開した.止血中に自己心拍が再開し人工心肺から離脱した.大動脈遮断201分,人工心肺時間503分の長時間であったが,止血され胸骨閉鎖可能であった.バックアップペーシングとしてペースメーカーのジェネレーターを肋骨弓下に留置した.
術後経過
術後の循環動態は安定し中心静脈圧は7~10 mmHg程度と術前の19 mmHgから著明に低下していた.術翌日に抜管され術後3日目にICUから一般病棟に帰室した.腹水貯留や非持続性心室頻拍も出現なく術後16日目に退院した.
術後検査
術後2年時の外来では,腹水貯留や失神なく労作時の動悸,息切れも消失して経過良好であった.通常の機械弁の抗凝固療法と同様にWarfarinを服用し1か月毎にPTINRをチェックして2.0から3.0に調整されており血栓性および出血性合併症を認めていない.胸部レントゲン上CTRは60%と縮小していた(Fig. 1b).心電図ではf波の小さな心房細動のままバックアップペーシングの下,75回/分ほどの自己リズムで経過し,RV5+SV1で1.97 mVと左室肥大が改善していた.BNPは術前の655.9 pg/mLから77.6 pg/mLと著明に低下していた.
心エコー検査のドップラー上,左室流出路の最大圧較差は22.3 mmHgと術前の116.2 mmHgから著明に低下し,左室駆出率も59.6%まで改善していた.僧帽弁位人工弁における平均圧較差は7.4 mmHgで術前と変わりなかった.
修正大血管転位症は房室逆位と心室大血管逆位を伴う心奇形で臓器心房位により正位のSLL(situs solitus, l-loop, l-transposition)型と逆位のIDD(situs inversus, d-loop, d-transposition)型があり,本症例は約5%と稀なIDD型であった1).修正大血管転位症の外科治療に関しては生理学的修復術と解剖学的修復術があるが,前者においては体循環を維持する右心室や三尖弁が遠隔期に機能不全を発生する可能性が高いとの理由から後者が導入されるようになった.本症例においては解剖学的修復術であるMustard-REV typeのダブルスイッチ手術が施行され,その術後に生ずる可能性が想定される左室流出路狭窄や右室流出路狭窄兼閉鎖不全,buffle leakに加えて僧帽弁および三尖弁閉鎖不全など種々の合併症を引き起こし頻回な再手術を必要とした.しかし左心室は十分な機能を維持したと思われ,解剖学的修復術の効果であったと言えるかもしれない.Hraskaら2)は修正大血管転位症に対して解剖学的修復術を施行した63例を経過観察し,15年で95%の生存率と,5年で80%,10年で71%の無イベント生存率という良好な成績を報告している.死亡および左室機能低下および心移植回避率も15年で93%であった.本症例においては29年前の初回手術から今回手術に至るまでの治療戦略,特に解剖学的修復術の選択と術式決定とその後の合併症との関連に関しては,他施設での治療内容の記録もわずかであったため振り返っての検討は困難であった.
術前の病態を検討するなかで,反復する腹水貯留の原因と思われた右房圧の著明な上昇の原因を特定することはできなかった.三尖弁位人工弁の機能障害やMustard procedureに関連した心房内血流転換の影響も認めなかった.考え得る原因としては,①大動脈弁閉鎖不全と反復する再手術に起因する癒着に伴う左室拡張障害による左室拡張末期圧上昇,②患者成長に伴う僧帽弁位人工弁の相対的僧帽弁狭窄の進行,③REV procedure後肺動脈弁機能障害による高度肺動脈弁逆流,などを検討したが,三尖弁位人工弁が機械弁であり心臓カテーテル検査で肺動脈圧や右室圧の測定ができず確定には至らなかった.
術式を決定するに当たり患者の術前状態と高度癒着が予想される高リスク手術であることを考慮して,可能な範囲で手術侵襲を減らし効果を上げる術式をチーム内で検討した.僧帽弁位人工弁はSJM 23でありサイズアップの再弁置換が望ましいとは考えたが,広範囲の癒着剥離と心房内バッフルの開放など手術侵襲を上げる手技を必要とすると思われ,体重41.3 kgと比較的低体重ではあることと現状の機械弁の開閉状態が問題ないことから,僧帽弁狭窄は放置し大動脈弁置換と左室流出路狭窄解除および肺動脈弁置換術を行うこととして患者・家族にも了承を得た.
複雑心奇形の遺残病変に対する成人期追加手術における問題点の1つは癒着剥離に伴う出血であるが,本症例においては5度目の胸骨正中切開,著明な心拡大による後方からの胸骨圧迫,人工物使用による高度癒着・石灰化など,複数のリスク因子があり,MDCTを詳細に検討して出血回避に留意した.さらに内臓逆位や過去の手術に伴う血管閉塞・狭窄が複数あり,人工心肺導入にも工夫が必要であった.長時間人工心肺中の下肢虚血に留意し,両側大腿動脈に人工血管を端側吻合して送血路とし,大腿静脈と内頚静脈からのカニュレーションにより脱血路を確保して胸骨切開前から体外循環を確立することで大出血を回避することが可能であった.また,高度癒着により開胸器による視野展開にも制限があり,癒着剥離範囲を上行大動脈と右室流出路周囲のみに限定して3つの病変を修復した.
人工弁置換において大動脈弁と僧帽弁の2弁置換は比較的多く行われているが,これらに肺動脈弁位や三尖弁位の人工弁置換が加わる3弁置換以上が行われることは稀で,4弁すべての弁置換に至っては,検索し得た範囲では本邦報告例は認められず,世界でも数えるほどであった3–6).その多くは感染性心内膜炎とカルチノイド心臓疾患であり,本症例のように先天性心疾患に伴って段階的に4弁置換に至った報告例は認められなかった.人工弁の選択に関しては,大動脈弁位における機械弁の選択は29歳という年齢から異論はないと思われるが,肺動脈弁置換に関しては議論の余地はある.一般的に右心系人工弁は血栓性合併症が多いといわれ特に本邦では生体弁が選択される場合が多い.しかし若年者における生体弁置換は経年劣化による再弁置換の問題がある.特に本症例においては先行して三尖弁置換も行われており,厳重な抗凝固療法が必要であることは変わらないことから経年劣化による再弁置換のリスクを減らすことにメリットがあると考え機械弁を選択した7).術後2年経過した現時点で抗凝固療法に伴う血栓性・出血性合併症や人工弁機能不全,心機能低下は認めていない.しかし今後の経過観察においても十分な注意が必要であると思われる.