特発性肺動脈性肺高血圧症に対する新規治療戦略Recent Advances and Current Topics on Therapeutic Approaches in Pulmonary Arterial Hypertension
東邦大学医療センター大森病院 小児科Department of Pediatrics, Toho University Omori Medical Center ◇ Tokyo, Japan
肺動脈性肺高血圧症の治療はここ20年間で大きく進歩し,肺高血圧患者の生命予後を飛躍的に改善させてきた.肺血管拡張薬薬は,プロスタサイクリン経路,一酸化窒素経路,エンドセリン経路の3種類に分類され,それぞれの経路において複数の薬剤が使用できるようになった.小児領域でも肺血管拡張薬が承認されるようになり,国内においても臨床試験が次々と計画され,今後もさらに適応外使用の薬剤が減っていくことが期待される.しかし,一部の肺高血圧症ではこの3系統の薬剤に対し抵抗性の症例が存在する.近年,新しい治療経路の薬剤やカテーテルや外科治療により,臨床症状や肺循環動態の改善が報告されており,重症肺高血圧症に対する新規の治療戦略となることが期待されている.本稿では,近年報告された治療に関するデータを紹介し,今後臨床応用が期待されているものについて解説する.
Despite deeper understanding of the pathophysiology of pulmonary artery hypertension (PAH), idiopathic and heritable PAH remains fatal. Specific therapies have advanced the clinical management of this challenging disease. Clinical trials have provided evidence of the effectiveness of targeted therapies, but data are limited for pediatric patients with PAH. Potential therapeutic approaches have been assessed, such as new pulmonary vasodilators, cell-based therapy and devices. The present investigation describes the novel and potential treatments that are available or under development. This paper provides an overview of the novel treatment options for PAH.
Key words: pulmonary vasodilator agents; surgical and catheter intervention; new drug targets; clinical trial failures
© 2021 特定非営利活動法人日本小児循環器学会© 2021 Japanese Society of Pediatric Cardiology and Cardiac Surgery
肺動脈性肺高血圧症(pulmonary arterial hypertension, PAH)の治療は大きく進歩し生存率は目覚しく改善しているが,治療抵抗例のため肺移植を回避できず移植の待機中に死亡する症例も未だに存在する.近年のPAHの基礎研究の結果から,新たな経路による治療の開発が行われている.表に示したように,従来の3経路とは異なる薬剤や,Pottsシャント,肺動脈自律神経叢除神経療法などによる治療も報告されている(Table 1).今回,PAHの治療目標となる各経路の解説と,個々の治療における基礎研究および臨床研究について概説する.
| Targets | Classification | Drug name/intervention |
|---|---|---|
| Sympathetic nervous system | Non selective β-adrenergic blockade | Carvedilol |
| Selective β-adrenergic blockade | Bisoprolol, Metoprolol, Atenolol, Nebivolol | |
| Interventions | Pulmonary artery denervation | |
| Renin-angiotensin-aldosterone system | Aldosterone receptor antagonists | Spironolactone |
| Angiotensin II receptor blocker | Losartan | |
| Apelin receptor agonist | Apelin, Elabela | |
| Pulmonary to systemic shunt | Surgical or catheter intervention | Potts shunt (valved conduit) |
| Cell | Stem cell | Mesenchymal stem cell |
| Progenitor cell | Endothelial progenitor cell | |
| Serotonin | 5-hydroxytryptamine receptor 1B antagonist | Not available |
| Serotonin transporter inhibitor | Not available | |
| Inflammation | High mobility group box-1 inhibitor | Glycyrrhizin |
| Cardioprotective | Antianginal drug | Ranolazine |
| Estrogen metabolism | Selective estradiol receptor agonist | Not available |
| Aromatase inhibitor | Anastrozole | |
| Cell signaling | Tyrosine kinase inhibitor | Imatinib |
PAH患者では血中のカテコラミン値,レニン活性,アンギオテンシンIIやアルドステロン濃度が高値を示し,交感神経系の過緊張状態やレニン–アンギオテンシン–アルドステロン系(renin–angiotensin–aldosterone system, RAAS)の活性が報告されている1–3).欧州のPAHガイドラインではβ遮断薬とRAAS阻害薬に関して推奨はしていないが4),新たな治療薬も開発されており,この経路における薬剤は今後も試されていくと考えられる.
PAH患者では心拍出量を維持するために,交感神経系の亢進によって心拍数を増加させる代償が働いている.このため,PAHに対してβ遮断薬は従来禁忌と考えられており,過去の報告では運動耐容能や肺循環動態への有効性は見いだせていない5).しかし,PAHの病態においてβ1受容体の活性化が関与しており,この受容体を遮断することで肺血管の平滑筋細胞の増殖抑制や炎症性サイトカイン分泌抑制による心筋線維化を抑制することが可能であり,さらにα1受容体の抑制によっても肺血管の攣縮を改善させることがわかってきた6).そのβ1, 2およびα1受容体を抑制する非選択的β受容体阻害薬のカルベジロールが,PAHモデルにおいて右室リモデリングや右心機能を改善させることが報告された7).そこで,PAH患者に対するカルベジロールの二重盲検ランダム化比較試験(randomized controlled trial, RCT)が行われたが,用量依存性(6.25~50 mg/日)に運動時の心拍数を減少させたものの体血圧は10 mmHg程度低下し,臨床的な有効性は得られなかった8).次に試されたβ遮断薬のビソプロロールでも忍容性はあるものの,カルベジロール同様に右心機能や予後において改善は認められなかった9, 10).また,PAH患者に対してメトプロロール,アテノロール,カルベジロールのいずれかを使用した過去の報告からメタ解析を行ったところ,明らかな臨床的増悪を来さないものの右心機能や予後は改善しないという結論であった11).
しかし,近年になり選択的β遮断薬であるネビボロールの有効性が示された.ネビボロールは選択的β1受容体遮断薬であると同時にβ3受容体の作動薬でもあり,血管内皮由来の一酸化窒素(nitric oxide, NO)産生の促進や,活性酸素種を除去する作用を併せ持つ12).この機序によってPAHにおいて血管内皮障害を改善し,肺血管のリモデリングや右心機能の改善を示すことが報告されており13),PAHの病態進展を抑制する治療薬の1つとして期待されている.
PAH患者ではレニン活性,アンギオテンシンIIやアルドステロンの濃度が高いことが知られており,RAAS阻害薬による治療効果が検討されている14, 15).しかし,アルドステロンの血中濃度は肺循環動態や重症度と相関はなく,RAAS阻害薬であるスピロノラクトン併用療法の検討でも臨床的改善は認められなかった16, 17).一方,ロサルタン治療で肺循環動態が改善したという報告があるが,少数例の検討であり十分なエビデンスがあるとは言えない18).
RAASに作用する物質で近年注目されているのがapelinである.Apelin(APJ endogenous ligand)は13のアミノ酸から成るペプチドで,APJ受容体(apelin receptor)に結合するアゴニストである.APJ受容体は肺,心臓,胎盤などの様々な組織に発現しており,血管拡張作用,心筋収縮力増強,体液調節,血管新生などに関与する19–21).APJ受容体はアンギオテンシンII1型受容体と高い相同性を示し,apelinが結合するとアンギオテンシン変換酵素2の発現促進とアンギオテンシンII1型受容体の抑制作用を示し,アンギオテンシンIIを阻害する.Apelin自体が強力な陽性変力作用を有し用量依存性に心筋細胞の収縮力を増加させるため,心不全治療薬になる可能性も示唆されている.他にもapelinはバソプレッシンの分泌抑制を示すなどRAASに対する強力な抑制作用を持つことで心保護に働く.また,apelinは血管内皮細胞に多く発現しており,NO産生を促進することで血管拡張作用を有する他,血管内皮細胞の増殖作用を持ち,血管新生に重要な役割があることもわかってきた.PAHにおける報告では,apelin欠損マウスで肺動脈圧が上昇することや肺動脈の内皮細胞でその発現が減弱していたことから,apelinがPAHの病態に関与していることが疑われる22).
APJ受容体に結合するもう一つのペプチドにelabelaがある.ElabelaはAPJ受容体と結合しapelinと似たような作用を示すが,心臓発生において重要な役割を持つことが知られており,apelinとは異なるAPJ受容体リガンドとして存在する23).Apelinとの関連性についてはまだ十分わかっていないが,PAHモデルへのelabela投与により右室圧の低下,右室や肺血管のリモデリングの改善がみられることから24),この経路に対する治療薬として期待されている.
肺動脈自律神経叢除神経療法(pulmonary artery denervation, PADN)とは,PAHにおける交感神経系の過緊張状態に対し,肺動脈に分布する自律神経叢へのカテーテル焼灼術を行う治療である.既に高血圧症例に対してカテーテルにより腎交感神経を焼却除神経する治療が行われていたが,これと同様の治療コンセプトでPAHモデルに対し主にPADNが施行された25).自律神経叢は主肺動脈の左側壁に存在しており,そこへ高周波電流(20~40 W)によるカテーテルアブレーションを行い,合計120秒以内の焼却時間で十分な効果が得られるようである.2013年に中国から報告されたPADN-1 study(pulmonary artery denervation for treatment of pulmonary artery hypertension)では,13例の特発性PAH(idiopathic pulmonary artery hypertension, IPAH)に対して行われた26).PADN治療3か月後の平均肺動脈圧が55 mmHgから36 mmHgへ低下し,6分間歩行距離やWHO(World Health Organization)肺高血圧症機能分類の改善を認め,重篤な周術期の合併症はなかった.その後もPADNによるPAHへの臨床試験は主に中国から報告されている27–29).治療は局所麻酔で行われており,術中の胸痛はほとんどの症例で認められる.想定される合併症として肺動脈穿孔,心タンポナーデ,出血,反回神経麻痺などが挙げられるが,そのリスクは高くないとされている.第II相臨床試験で66例のPAH患者に対する治療効果が検討されており27),94%の症例で平均肺動脈圧が10%以上低下した.この治療効果は1年後にも維持されていたが,経過観察中10例でPAH増悪または死亡があった.しかし,この研究の対象患者は治療前の平均肺動脈圧が40 mmHg前後であり,ほとんどがNYHA(New York Heart Association)機能分類でIIまたはIII度であったことから重症例ではリスクが高くなる可能性が考えられる.
経皮的心房中隔裂開術(balloon atrial septostomy, BAS)は重症PAHにおいて,右左短絡による心拍出量の増加を目的として行われてきた.成人PAHにおいて最大限の内科的治療に不応の場合,肺移植までのブリッジ・セラピーとしてclass IIbの推奨度で紹介されている.しかしBASは小児例には推奨はされておらず肺移植までの待機中に増悪した場合,膜型人工肺が残された治療戦略となる.BASによる短絡の作成は,Eisenmenger症候群がIPAHに比してより安定した肺循環動態であり生命予後が良いことから発想されたものである.ワールド・シンポジウムでも取り上げられ,1980年代から重症PAH患者に対して施行されてきた.しかし,心房間短絡の自然閉鎖があり効果が一過性であることや全身の組織低酸素が生じることなどの理由から,その臨床的効果は決して高くはなかった.
Pottsシャントは1946年にWillis J. Pottsによって報告された術式である30).1945年にBlalock–Taussigシャントが新しい術式として報告された時期であり,このシャント術が鎖骨下動脈を犠牲にする必要があることから,大動脈と左肺動脈を直接吻合する別の術式として紹介された.結局このPottsの術式はBlalock–Taussigシャントにとって代わることはなかったが,その後高度PAHを呈する症例に対する姑息的な治療法として再び注目されるようになる.前述のようにBASでは心房レベルの右左短絡によって全身のチアノーゼを来すのに対しPottsシャントでは下半身のみにチアノーゼを認めるため,脳や冠動脈への酸素供給が保たれるメリットがある(Table 2).小児例へのPottsシャントは2004年にBlancらにより報告されており,4歳と14歳の重症PAHに対し行われ劇的な回復が認められた31).2009年にはLabombardaらが,失神を繰り返していた2例の小児PAHに対しPottsシャントを行い症状の改善に成功している32).これら2つの報告によって,PottsシャントはPAHに対する新しい治療戦略として知られるようになり,2012年にBaruteauらによって小児IPAHの長期成績が報告された33).WHO肺高血圧症機能分類がIV度の2歳から17歳の8例に対し9 mm程度の短絡を作成し,2例が術後に肺高血圧クリーゼによって死亡したが,生存した6例はWHO機能分類のIまたはII度で維持できていた.その後,小児PAH症例に対するPottsシャントの症例報告があるが,いずれも良好な成績である34, 35).2018年のワールド・シンポジウムでも小児重症PAHへの治療として議論されており36),今後の新たな治療戦略になる可能性がある.
| Balloon atrial septostomy | Potts shunt | |
|---|---|---|
| Image | 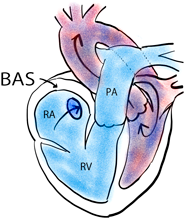 | 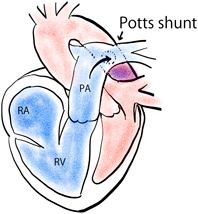 |
| Procedure | Creating a communication in the interatrial septum | Creating a communication between left pulmonary artery and descending aorta |
| Cyanosis | Intracardiac right-to-left shunt cause systemic desaturation | Postcardiac right-to-left shunt did not provoke arterial oxygen desaturation in coronary and cerebral circulations |
Pottsシャントの術式は下行大動脈と左肺動脈に直接吻合する方法であり,短絡血流の方向はコントロールすることはできない欠点が指摘されていたが,近年改良された術式が報告されている.下行大動脈と左肺動脈の間に距離がある症例に対しダクロン・グラフトを造設する術式や37),弁付きPottsシャントによって血流が肺動脈から大動脈方向にしか流れないような工夫をした術式などが考案されている38).弁付きPottsシャントは卵円孔と似た機序で,肺動脈圧が大動脈圧を超える場合のみ弁が開いて右左短絡が生じるようになっており,さらに改良された3弁付き導管を造設する術式も紹介されている39).
成人領域では外科的Pottsシャントは周術期で死亡率が高く,小児例に比して有効な治療戦略ではなかった.そこで,カテーテルによる経皮的Pottsシャントが試みられるようになった40).先行研究の動物モデルでの結果を参考に,2013年に18歳から44歳までの4例のIPAHに対して肺動脈大動脈の間にcoveredステントを留置する経皮的Pottsシャントが行われた41).大腿動脈に固定したロングシースからBrockenbrough針を出して穿通させ,この大動脈と肺動脈間に冠動脈用のバルーンカテーテルを通過させた後,このバルーンカテーテル先端から出してあったワイヤを予め左肺動脈に留置したスネアワイヤで掴みバルーンを拡張させる(Fig. 1).拡張後,coveredステントを短絡部位に置いて再度バルーン拡張させて左肺動脈と下行大動脈の間にシャントを作成する.この報告では,4例中3例が成功,1例は術中に血胸で死亡し,成功した3例中の1例も術後合併症によって死亡したが,2例は生存している.この結果からも,経皮的Pottsシャントは難易度が高く,限定された施設においてのみ施行されるべきである.
近年,再生療法が様々な領域において応用されている.勿論PAH患者に対する血管再生療法の臨床応用にはまだ時間がかかると考えられるが,この新しい治療には大きな期待が寄せられている.循環器領域の再生療法には,胚性幹細胞(embryonic stem cell, ESC),間葉系幹細胞(mesenchymal stem cell, MSC),血管内皮前駆細胞(endothelial progenitor cells, EPC)など様々な細胞が使用されてきた.一般に生体の幹細胞は多分化能を持ち,組織において必要とされる細胞に分化する.ESCは初期胚から分離される細胞で生体内の全ての細胞に分化する能力を持つことから多能性幹細胞(pluripotent stem cells, PSC)とも呼ばれ,人工的に作製したinduced PSCが今後の再生医療において重要な位置を占めている.PAHの実験モデルにおいて,幹細胞移植が肺の微小血管を再生することは報告されているが,細胞の培養増殖が難しい,生体内で増殖や分化が得られない,目標臓器で生着させられないなど臨床応用の前に解決すべき様々な課題が残されている.
多分化能幹細胞と呼ばれるMSCはPSCとは異なり分化できる細胞が限定されているが,自己再生能を持つ細胞である.自己の骨髄から採取でき,その高い増殖能力から大量に培養することが可能である.MSCは血管内皮細胞や平滑筋細胞へ分化するだけでなく成長因子やケモカインを放出し,細胞増殖抑制,血管新生の促進,抗炎症作用など様々な作用によってPAHの病態を改善に導くことが可能と考えられている42).2006年以降MSCを用いたPAHに対する有効性が報告され,モノクロタリンのPAHモデルではMSCの経静脈的移植により平均肺動脈圧の低下だけでなく組織学的な改善を認めた43–46).このMSC治療の重大な問題点は肺塞栓のリスクが高いことで,動物モデルの40%程度が肺塞栓によって死亡している47).他にも投与する適切な細胞数や投与経路など,多くの課題があるが,今後可能性のある治療として期待されている.
PAHの病態は,肺血管の内皮細胞障害から始まると考えられているが,これは血管損傷と修復のバランスが崩壊していることに基づいている.近年,EPCがPAHにおける血管修復に関与することがわかってきた48).EPCは単一の細胞ではなく様々な脈管形成にも関与するEPC様の細胞も存在し,循環血管内皮前駆細胞(circulating endothelial precursor)や循環血管新生細胞(circulating angiogenic cells)の名称でも呼ばれている.EPCはMSCから分化するが,末梢血中には極めて少数しか存在しないため,MSCと異なり採取と増殖は極めて難しい.2004年にPAHモデルにEPCの自家移植を行った報告では,肺動脈圧や肺血管抵抗,心拍出量が改善し,肺血管の組織学的な改善も得られている49).2008年には13例の小児IPAHに対し経静脈的なEPCの自家移植が行われ,重篤な有害事象は認めず肺循環動態やNYHA機能分類などが改善した50).また,先天性心疾患の小児PAH患者において,EPCの数が肺動脈圧に逆相関しておりEPC自体が肺循環動態に影響している可能性が指摘された51).2015年に行われたpulmonary hypertension and angiogenic cell therapy(PHACeT)の検討では,7例のIPAH患者に対し血管内皮由来のNO合成酵素を導入させたEPCを右心房内に経静脈的に投与したところ,3日目には肺循環動態の改善が得られた52).しかし,その治療効果は投与3か月後には消失し1例は死亡している.この結果からもMSC同様に臨床応用には時間が必要と考えられるが,PAHの病態からはEPC治療は有望と考えられ今後の研究成果が期待されている.
治療薬の開発において,ある薬剤が動物モデルで効果が得られた後にPAH患者に対する臨床試験が行われたものの,安全性や有効性に問題が生じて臨床応用が中止になることがあるが,ここではイマチニブの例について紹介する.
蛋白質のリン酸化されるアミノ酸残基の1つがチロシンであり,これを特異的にリン酸化する酵素をチロシンキナーゼ(tyrosine kinase, TK)と呼ぶ.TKは細胞膜表面に存在する受容体型と細胞内の非受容体型に大別され,細胞の増殖,分化,アポトーシスに関わる.イマチニブはTK阻害薬として細胞のシグナル伝達を阻害し,細胞増殖を抑制,癌細胞などのアポトーシスを誘導する.慢性骨髄性白血病のがん細胞におけるTK活性を選択的に阻害するイマチニブにより予後の改善が認められている.
PAHの病態において,癌細胞と同様に無秩序な血管リモデングが生じているが,血小板由来増殖因子(platelet derived growth factor, PDGF)が肺動脈平滑筋細胞の過剰増殖に関与していることが知られている53).イマチニブはこのPDGF受容体にも抑制的に作用することで,新たなPAH治療薬として期待された.2005年,61歳のPAHの男性患者に対しイマチニブ200 mg/日の投与を行った症例報告で3か月後のNYHA機能分類,6分間歩行,および肺血管抵抗値の改善が得られ,その効果は6か月後も維持していた54).その後,第II相臨床試験を経てRCTであるIMPRES(imatinib in pulmonary arterial hypertension, a randomized efficacy study)が行われた55, 56).この試験では,既に肺血管拡張薬治療を受けている202例のPAH患者に対し,200~400 mgのイマチニブまたはプラセボが投与された.6分間歩行距離や肺循環動態に対してある程度の効果を示したが,予後の改善は得られず重篤な合併症として硬膜下血腫が認められたため,PAH治療に対する承認申請は取り下げられた.その後,他のTK阻害薬であるニロチニブやソラフェニブによるPAH治療が行われたが,逆にTK阻害薬自体がPAH発症に関与することがわかってきた57).
ダサチニブはTK阻害薬の1つであり,フィラデルフィア染色体陽性の急性リンパ球性白血病や慢性骨髄性白血病に対し投与される抗癌剤であり,薬剤性PAHの原因の1つとして考えられている.本薬剤によるPAH発症機序は明らかではないが,他のTK阻害薬よりもそのリスクが高いことが知られている58).一般にダサチニブによるPAHは可逆性であるが重篤例も報告されているため,血液腫瘍の治療中にはPAHのスクリーニングを行うことが推奨されている.また,ダサチニブ以外のTK阻害薬でもPAH発症への関連性が報告されている59).TK経路阻害による細胞の過剰増殖,肺血管リモデリングの抑制を行う発想は,新たなPAH治療薬として期待されたが,この経路の治療薬開発は難しいと考えられる.
まだ大規模な臨床研究は行われていないものの,PAHモデルでは有効性を見いだしている新たな治療経路は多く報告されており,有望なものをいくつか挙げて紹介する.
セロトニン(5-hydroxytryptamine, 5HT)は脳の神経伝達物質でドーパミンやノルアドレナリンを制御し,その分泌が抑制されると鬱症状などの精神症状を引き起こす.5-HTは必須アミノ酸であるトリプトファンから産生され,5-HT受容体に結合し活性化する.この受容体には1~7型あり,さらにサブタイプにもわかれているが5-HT1B受容体がPAHの病態に関与する60).この5-HT1B受容体はPAH患者の肺血管において多く発現しており,5-HTが肺血管平滑筋細胞から5-HT輸送体(serotonin transporter, SERT)を介して5-HT1B受容体に運ばれて結合すると,肺血管平滑筋の収縮や細胞増殖,繊維化を引き起こす.この作用は5-HT1B受容体を介した酸化ストレスに伴う活性酸素種によってさらに増強される61).
鬱病に対して選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor, SSRI)が用いられているが,SSRIはSERTの抑制を行うことで脳内神経伝達物質としての5-HTの再取り込みを阻害し,脳内での5-HT作用は増強され抗鬱作用を示す.一方,PAHモデルではSERTが過剰発現しており,このSSRIによってPAH進行が改善する可能性が示唆されている62, 63).しかし,妊娠第3期の後期に母体にSSRIが投与されると,新生児遷延性肺高血圧症の発症リスクが高くなることや,PAH患者でSSRIが投与されている場合は予後不良になる症例が多いこと,SSRIの使用例にPAH発症が多いとする報告もあり,SSRIがPAHの発症や進行に対して抑制的に作用するのか促進的に作用するのかは不明なところが多い64–66).現状,選択的5-HT1B受容体阻害薬の臨床的な評価が不十分であり,更なる検討が必要と考えられる.
HMGB1(high mobility group box-1)は,DNA構造の維持や機能発現に重要な生体内の核内タンパクである.HMGB1は細胞の壊死や活性化に伴い核から細胞外に放出され,Toll様受容体–4などを介して炎症性サイトカインの発現を誘導することから,“ダメージ関連分子パターン”と考えられている.グリチルリチンはHMGB1と結合して,その作用を中和する作用がある67).生薬の甘草に含まれるグリチルリチンは,砂糖より甘味の強い物質であり強力ネオミノファーゲンシー®の主成分として肝機能障害に対して使用されている.作用機序は不明なところが多いが主に抗炎症作用によるものであり,マクロファージの活性化を抑え,炎症性ケミカルメディエーター放出を抑制する.また,内因性のインターフェロンγを産生し免疫応答を増強させることで,ウイルスの増殖抑制に働くことも知られている.
PAHの肺血管のリモデリングにおいて,炎症が大きく関わっていると考えられている.PAHでは様々な血清中のケモカイン,サイトカインの上昇が認められ,マクロファージ,リンパ球などが血管内皮細胞に浸潤している68, 69).さらに,低酸素によるPAHモデルやIPAH患者ではHMGB1が上昇していることが報告されており,PAH患者の病態の進行においてこのHMGB1による炎症が重要な役割をもっていることがわかってきた70–72).PAHモデルに対して,グリチルリチン投与した検討では,HMGB1の発現抑制に加え肺循環動態が改善した73, 74).この結果から,PAHの病態における“炎症”を抑制することは,疾患の進行に影響することが考えられ,今後新しい治療標的になることが期待される.
ラノラジンは2006年に慢性狭心症の治療薬として承認された薬剤で,その薬理作用は十分解明されていないものの,アデノシン三リン酸の産生促進による心筋血流の増加をきたし心保護作用を示すと考えられている75).心拍数の減少や血圧低下を来さずに心筋酸素消費量の改善させることができることが特徴である.また,Na channelの感受性を低下させ抗不整脈作用を併せ持つが,副作用としてQT延長を来すことが知られている76).ラノラジンによるPAHモデルへの治療効果を検討した報告では,右室駆出率と右室リモデリングの改善が得られた77–79).その後,12例のPAH患者に対して単施設におけるラノラジン治療のRCTが行われたが,12週間の投与によって明らかな効果が得られなかった80).また,11例のPAH患者に対するラノラジン治療の前向き臨床試験の検討では,NYHA機能分類の改善と右室容積の縮小や右室機能の改善が得られたが,明らかな肺循環動態の改善は得られなかった81).本薬剤の薬理作用からはPAHへの治療効果が期待されたが,今後有効な治療となり得るかは更なる検討が必要である.
PAHにおける女性ホルモンのエストロゲンの関与については長く議論されてきた.一般的に小児期PAHでは発症率に性差がないのに対し,成人領域では思春期を超えると女性の方が男性に比して2~4倍もの発症リスクがある82).しかし,PAHの重症度は女性よりも男性の方が高く予後においても男性の方が不良である83).このようにPAH発症には女性ホルモンの影響が疑われるが,重症度や予後とは解離した結果を示すことから“エストロゲン・パラドックス”と呼ばれており,その病態への関与についてはまだ十分解明されていない.
エストロゲンはプロスタサイクリンやNO分泌を促進しエンドセリン1の発現を抑制するが,一方で肺血管の平滑筋においてその増殖に関与すると考えられている84).このエストロゲンの肺血管における相反する作用を示す機序は,エストロンとエストラジオールの異なる作用によって説明される85).エストラジオールの代謝産物である2-methoxy-estradiol, 2-OH-estradiolは増殖抑制と抗炎症作用を示し,一方でエストロンの代謝産物の16α-OH-estradiolは増殖促進と炎症作用を亢進させる(Fig. 2).チトクロームP450分子種の一つとして同定されたCYP1B1(cytochrome P450 1B1)は乳癌の発症に関与する酵素として知られているが,健常ではエストラジオールから2-methoxy-estradiolに分解する酵素である.このCYP1B1を抑制すると,エストロンから16α-OH-estradiolへの変換が相対的に増加し,PAHにおいて病態を悪化させる方向に働く86).また,BMPR2(bone morphogenetic protein receptor type II)遺伝子変異を持つ症候性PAHの女性例におけるCYP1B1の発現は,無症候性のBMPR2遺伝子変異の症例に比して有意に低下していたが男性ではこの傾向は認められていない87).さらにBMPR2遺伝子変異を持つ無症候性のキャリアにおいても,遺伝子変異のない症例に比して2-OH-estradiol/16α-OH-estrone比が著しく低下していた88).これらの結果から,女性のPAHではCYP1B1の発現の低下によって2-methoxy-estradiolよりも16α-OH-estradiolが増加しており,一方男性では,この代謝系によるPAHの病態への関与は認められないことが考えられる.このエストロゲンを標的としたPAH治療の検討がされており,PAHのモデルに対するエストラジオール受容体の選択的アゴニストの投与により肺循環動態の改善を認めたことが報告されている89–91).また,生体内で男性ホルモン(アンドロステンジオン,テストステロン)から女性ホルモン(エストロン,エストラジオール)に分解する酵素のアロマターゼが,閉経後の女性の肺動脈平滑筋に多く発現しており,肺高血圧の進展に関与している可能性が示唆された92).このアロマターゼの抑制によりPAHの改善が得られる可能性があり,アロマターゼ阻害薬(アナストロゾール)によるRCTが行われた93).18例のPAH患者(女性9例)に対しアナストロゾール治療群とプラセボ群で比較検討されたが,治療開始3か月後に治療群では6分間歩行距離の延長を認めたものの,NTproBNP値やNYHA機能分類は改善がなかった.アナストロゾールがエストロンとエストラジオールの経路を同時に抑制したことで,臨床的な改善が得られなかった可能性はあるが,まだこの経路への治療は難しいことが考えられる.このようにPAHの病態においてエストロゲンの関与は明らかであるものの,動物モデルとは異なり実際の患者への治療においては未解決なものが多く残されている.また生体内のホルモンバランスを崩す可能性もあり問題点は多いと考えられる.長くこの分野への取り組みはなされているが治療への応用には到達できておらず,治療薬開発にはまだ時間がかかりそうである.
2OH-estradiol and 2-methoxy-estradiol have antiproliferative and anti-inflammatory effects in pulmonary arterial smooth muscle cell, whereas 16α-OH-estrone has proliferative and inflammatory effects. CYP1B1 is an estradiol hydroxylase and the 2-OH-estradiol/16α-OH-estrone ratio is an indicator of CYP1B1 activity. CYP1B1, cytochrome P450 1B1; 2OH-estradiol, 2-hydroxy-estradiol; 16α-OH-estrone, 16α-hydroxy-estrone.
本稿では,PAH治療の最新の話題をまとめたが,ここで紹介できなかった基礎研究や臨床試験のデータは数多くある.基礎研究では期待された薬剤であっても,実際の患者においては有効性が得られなかったり,思いがけない副作用などで臨床試験が中断されることも多い.そのため,実際に第III相臨床試験を経て承認される薬剤はほんの一握りになる.さらに,成人患者で承認された後に小児の承認薬として使用できるようになるためには,さらに時間が必要となる.しかし,その薬剤に命を預ける患者にとっては十分に有効性と安全性が確認されたものであることが重要であり,市場に出てからも臨床医によって継続的に評価を行っていくことが必要である.PAH治療が進歩した現在においても一部の患者は治療抵抗性であり,今後もこの分野において新たな治療薬が登場してくることに期待したい.
本稿を執筆するにあたり御指導を賜りました,高知大学小児科の中山智孝先生に深謝いたします.
本稿に関する利益相反はありません.
1) Ciarka A, Doan V, Velez-Roa S, et al: Prognostic significance of sympathetic nervous system activation in pulmonary arterial hypertension. Am J Respir Crit Care Med 2010; 181: 1269–1275
2) de Man FS, Tu L, Handoko ML, et al: Dysregulated renin-angiotensin-aldosterone system contributes to pulmonary arterial hypertension. Am J Respir Crit Care Med 2012; 186: 780–789
3) Vaillancourt M, Chia P, Sarji S, et al: Autonomic nervous system involvement in pulmonary arterial hypertension. Respir Res 2017; 18: 201
4) Galiè N, Humbert M, Vachiery JL, et al: ESC Scientific Document Group: 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016; 37: 67–119
5) Provencher S, Herve P, Jais X, et al: Deleterious effects of beta-blockers on exercise capacity and hemodynamics in patients with portopulmonary hypertension. Gastroenterology 2006; 130: 120–126
6) Grinnan D, Bogaard HJ, Grizzard J, et al: Treatment of group I pulmonary arterial hypertension with carvedilol is safe. Am J Respir Crit Care Med 2014; 189: 1562–1564
7) Bogaard HJ, Natarajan R, Mizuno S, et al: Adrenergic receptor blockade reverses right heart remodeling and dysfunction in pulmonary hypertensive rats. Am J Respir Crit Care Med 2010; 182: 652–660
8) Farha S, Saygin D, Park MM, et al: Pulmonary arterial hypertension treatment with carvedilol for heart failure: A randomized controlled trial. JCI Insight 2017; 2: e95240
9) van Campen JS, de Boer K, van de Veerdonk MC, et al: Bisoprolol in idiopathic pulmonary arterial hypertension: An explorative study. Eur Respir J 2016; 48: 787–796
10) Rijnierse MT, Groeneveldt JA, van Campen JSJA, et al: Bisoprolol therapy does not reduce right ventricular sympathetic activity in pulmonary arterial hypertension patients. Pulm Circ 2020; 10: 2045894019873548
11) Bandyopadhyay D, Bajaj NS, Zein J, et al: Outcomes of β-blocker use in pulmonary arterial hypertension: A propensity-matched analysis. Eur Respir J 2015; 46: 750–760
12) Gauthier C, Leblais V, Kobzik L, et al: The negative inotropic effect of beta3-adrenoceptor stimulation is mediated by activation of a nitric oxide synthase pathway in human ventricle. J Clin Invest 1998; 102: 1377–1384
13) Perros F, Ranchoux B, Izikki M, et al: Nebivolol, a vasodilating selective β1-blocker, Is a β3-adrenoceptor agonist in the nonfailing transplanted human heart. J Am Coll Cardiol 2015; 65: 668–680
14) de Man FS, Tu L, Handoko ML, et al: Dysregulated renin-angiotensin-aldosterone system contributes to pulmonary arterial hypertension. Am J Respir Crit Care Med 2012; 186: 780–789
15) Safdar Z, Thakur A, Singh S, et al: Circulating aldosterone levels and disease severity in pulmonary arterial hypertension. J Pulm Respir Med 2015; 5: 295
16) Maron BA, Waxman AB, Opotowsky AR, et al: Effectiveness of spironolactone plus ambrisentan for treatment of pulmonary arterial hypertension (from the [ARIES] study 1 and 2 trials). Am J Cardiol 2013; 112: 720–725
17) Safdar Z, Frost A, Basant A, et al: Spironolactone in pulmonary arterial hypertension: Results of a cross-over study. Pulm Circ 2020; 10: 2045894019898030
18) Bozbaş SS, Bozbaş H, Atar A, et al: Comparative effects of losartan and nifedipine therapy on exercise capacity, Doppler echocardiographic parameters and endothelin levels in patients with secondary pulmonary hypertension. Anadolu Kardiyol Derg 2010; 10: 43–49
19) Zhang ZZ, Wang W, Jin HY, et al: Apelin is a negative regulator of angiotensin II-mediated adverse myocardial remodeling and dysfunction. Hypertension 2017; 70: 1165–1175
20) Eberlé D, Marousez L, Hanssens S, et al: Elabela and Apelin actions in healthy and pathological pregnancies. Cytokine Growth Factor Rev 2019; 46: 45–53
21) Boulkeroua C, Ayari H, Khalfaoui T, et al: Apelin-13 regulates vasopressin-induced aquaporin-2 expression and trafficking in kidney collecting duct cells. Cell Physiol Biochem 2019; 53: 687–700
22) Kim J, Kang Y, Kojima Y, et al: An endothelial apelin-FGF link mediated by miR-424 and miR-503 is disrupted in pulmonary arterial hypertension. Nat Med 2013; 19: 74–82
23) Liu W, Yan J, Pan W, et al: Apelin/Elabela-APJ: A novel therapeutic target in the cardiovascular system. Ann Transl Med 2020; 8: 243
24) Yang P, Read C, Kuc RE, et al: Elabela/Toddler is an endogenous agonist of the apelin APJ receptor in the adult cardiovascular system, and exogenous administration of the peptide compensates for the downregulation of its expression in pulmonary arterial hypertension. Circulation 2017; 135: 1160–1173
25) Chen SL, Zhang YJ, Zhou L, et al: Percutaneous pulmonary artery denervation completely abolishes experimental pulmonary arterial hypertension in vivo. EuroIntervention 2013; 9: 269–276
26) Chen SL, Zhang FF, Xu J, et al: Pulmonary artery denervation to treat pulmonary arterial hypertension: The single-center, prospective, first-in-man PADN-1 study (first-in-man pulmonary artery denervation for treatment of pulmonary artery hypertension). J Am Coll Cardiol 2013; 62: 1092–1100
27) Chen SL, Zhang H, Xie DJ, et al: Hemodynamic, functional, and clinical responses to pulmonary artery denervation in patients with pulmonary arterial hypertension of different causes: Phase II results from the pulmonary artery denervation-1 study. Circ Cardiovasc Interv 2015; 8: e002837
28) Zhang H, Zhang J, Chen M, et al: Pulmonary artery denervation significantly increases 6-min walk distance for patients with combined pre- and post-capillary pulmonary hypertension associated with left heart failure: The PADN-5 study. JACC Cardiovasc Interv 2019; 12: 274–284
29) Garcia-Lunar I, Pereda D, Santiago E, et al: Effect of pulmonary artery denervation in post capillary pulmonary hypertension: Result of a randomized controlled translational study. Basic Res Cardiol 2019; 114: 5
30) Potts WJ, Smith S, Gibson S: Anastomosis of the aorta to a pulmonary artery. JAMA 1946; 192: 627–631
31) Blanc J, Vouhé P, Bonnet D: Potts shunt in patients with pulmonary hypertension. N Engl J Med 2004; 350: 623
32) Labombarda F, Maragnes P, Dupont-Chauvet P, et al: Potts anastomosis for children with idiopathic pulmonary hypertension. Pediatr Cardiol 2009; 30: 1143–1145
33) Baruteau AE, Serraf A, Lévy M, et al: Potts shunt in children with idiopathic pulmonary arterial hypertension: Long-term results. Ann Thorac Surg 2012; 94: 817–824
34) Baruteau AE, Belli E, Boudjemline Y, et al: Palliative Potts shunt for the treatment of children with drug-refractory pulmonary arterial hypertension: Updated data from the first 24 patients. Eur J Cardiothorac Surg 2015; 47: e105–e110
35) Gorbachevsky SV, Shmalts AA, Barishnikova IY, et al: Potts shunt in children with pulmonary arterial hypertension: Institutional experience. Interact Cardiovasc Thorac Surg 2017; 25: 595–599
36) Galiè N, Vallerie VM, Lewis JR, et al: An overview of the 6th World Symposium on Pulmonary Hypertension. Eur Respir J 2019; 53: 1802148
37) Bui MT, Grollmus O, Ly M, et al: Surgical palliation of primary pulmonary arterial hypertension by a unidirectional valved Potts anastomosis in an animal model. J Thorac Cardiovasc Surg 2011; 142: 1223–1228
38) Keogh AM, Nicholls M, Shaw M, et al: Modified Potts shunt in an adult with pulmonary arterial hypertension and recurrent syncope-three-year follow-up. Int J Cardiol 2015; 182: 36–37
39) Rosenzweig EB, Ankola A, Krishnan U, et al: A novel unidirectional-valved shunt approach for end-stage pulmonary arterial hypertension: Early experience in adolescents and adults. J Thorac Cardiovasc Surg 2021; 16: 1438–1446
40) Levi DS, Danon S, Gordon B, et al: Creation of transcatheter aortopulmonary and cavopulmonary shunts using magnetic catheters: Feasibility study in swine. Pediatr Cardiol 2009; 30: 397–403
41) Esch JJ, Shah PB, Cockrill BA, et al: Transcatheter Potts shunt creation in patients with severe pulmonary arterial hypertension: Initial clinical experience. J Heart Lung Transplant 2013; 32: 381–387
42) Kobayashi K, Suzuki K: Mesenchymal stem/stromal cell-based therapy for heart failure. Circ J 2018; 82: 2222–2232
43) Kanki-Horimoto S, Horimoto H, Mieno S, et al: Implantation of mesenchymal stem cells overexpressing endothelial nitric oxide synthase improves right ventricular impairments caused by pulmonary hypertension. Circulation 2006; 114 Suppl.: I181–I185
44) Baber SR, Deng W, Master RG, et al: Intratracheal mesenchymal stem cell administration attenuates monocrotaline-induced pulmonary hypertension and endothelial dysfunction. Am J Physiol Heart Circ Physiol 2007; 292: H1120–H1128
45) Takemiya K, Kai H, Yasukawa H, et al: Mesenchymal stem cell-based prostacyclin synthase gene therapy for pulmonary hypertension rats. Basic Res Cardiol 2010; 105: 409–417
46) Fukumitsu M, Suzuki K: Mesenchymal stem/stromal cell therapy for pulmonary arterial hypertension: Comprehensive review of preclinical studies. J Cardiol 2019; 74: 304–312
47) Furlani D, Ugurlucan M, Ong L, et al: Is the intravascular administration of mesenchymal stem cells safe? Mesenchymal stem cells and intravital microscopy. Microvasc Res 2009; 77: 370–376
48) Hill JM, Zalos G, Halcox JP, et al: Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med 2003; 348: 593–600
49) Takahashi M, Nakamura T, Toba T, et al: Transplantation of endothelial progenitor cells into the lung to alleviate pulmonary hypertension in dogs. Tissue Eng 2004; 10: 771–779
50) Zhu JH, Wang XX, Zhang FR, et al: Safety and efficacy of autologous endothelial progenitor cells transplantation in children with idiopathic pulmonary arterial hypertension: Open-label pilot study. Pediatr Transplant 2008; 12: 650–655
51) Sun HX, Li GJ, Du ZH, et al: The relationship between endothelial progenitor cells and pulmonary arterial hypertension in children with congenital heart disease. BMC Pediatr 2019; 19: 502
52) Granton J, Langleben D, Kutryk MB, et al: Endothelial NO-synthase gene-enhanced progenitor cell therapy for pulmonary arterial hypertension: The PHACeT trial. Circ Res 2015; 117: 645–654
53) Perros F, Montani D, Dorfmüller P, et al: Platelet-derived growth factor expression and function in idiopathic pulmonary arterial hypertension. Am J Respir Crit Care Med 2008; 178: 81–88
54) Ghofrani HA, Seeger W, Grimminger F: Imatinib for the treatment of pulmonary arterial hypertension. N Engl J Med 2005; 353: 1412–1413
55) Ghofrani HA, Morrell NW, Hoeper MM, et al: Imatinib in pulmonary arterial hypertension patients with inadequate response to established therapy. Am J Respir Crit Care Med 2010; 182: 1171–1177
56) Hoeper MM, Barst RJ, Bourge RC, et al: Imatinib mesylate as add-on therapy for pulmonary arterial hypertension: Results of the randomized IMPRES study. Circulation 2013; 127: 1128–1138
57) Weatherald J, Chaumais MC, Montani D: Pulmonary arterial hypertension induced by tyrosine kinase inhibitors. Curr Opin Pulm Med 2017; 23: 392–397
58) Minami M, Arita T, Iwasaki H, et al: Comparative analysis of pulmonary hypertension in patients treated with imatinib, nilotinib and dasatinib. Br J Haematol 2017; 177: 578–587
59) Weatherald J, Chaumais MC, Savale L, et al: Long-term outcomes of dasatinib-induced pulmonary arterial hypertension: A population-based study. Eur Respir J 2017; 50: 1700217
60) Archer SL, Weir EK, Wilkins MR: Basic science of pulmonary arterial hypertension for clinicians: New concepts and experimental therapies. Circulation 2010; 121: 2045–2066
61) Bowers R, Cool C, Murphy RC, et al: Oxidative stress in severe pulmonary hypertension. Am J Respir Crit Care Med 2004; 169: 764–769
62) Marcos E, Adnot S, Pham MH, et al: Serotonin transporter inhibitors protect against hypoxic pulmonary hypertension. Am J Respir Crit Care Med 2003; 168: 487–493
63) Guignabert C, Raffestin B, Benferhat R, et al: Serotonin transporter inhibition prevents and reverses monocrotaline-induced pulmonary hypertension in rats. Circulation 2005; 111: 2812–2819
64) Dhalla IA, Juurlink DN, Gomes T, et al: Selective serotonin reuptake inhibitors and pulmonary arterial hypertension: A case-control study. Chest 2012; 141: 348–353
65) Ali S, Kari ER, Ioana RP, et al: Use of selective serotonin reuptake inhibitors and outcomes in pulmonary arterial hypertension. Chest 2013; 144: 531–541
66) Krista FH, Brian TB, Kristin P, et al: Antidepressant use late in pregnancy and risk of persistent pulmonary hypertension of the newborn. JAMA 2015; 313: 2142–2151
67) Mollica L, De Marchis F, Spitaleri A, et al: Glycyrrhizin binds to high-mobility group box 1 protein and inhibits its cytokine activities. Chem Biol 2007; 14: 431–441
68) Price LC, Wort SJ, Perros F, et al: Inflammation in pulmonary arterial hypertension. Chest 2012; 141: 210–221
69) Groth A, Vrugt B, Brock M, et al: Inflammatory cytokines in pulmonary hypertension. Respir Res 2014; 15: 47
70) Bauer EM, Shapiro R, Zheng H, et al: High mobility group box 1 contributes to the pathogenesis of experimental pulmonary hypertension via activation of Toll-like receptor 4. Mol Med 2013; 18: 1509–1518
71) Li WJ, Hu K, Yang JP, et al: HMGB1 affects the development of pulmonary arterial hypertension via RAGE. Eur Rev Med Pharmacol Sci 2017; 21: 3950–3958
72) Nogueira FR, Ferreira PMJ, Silva AF, et al: HMGB1 down-regulation mediates terameprocol vascular anti-proliferative effect in experimental pulmonary hypertension. J Cell Physiol 2017; 232: 3128–3138
73) Yang PS, Kim DH, Lee YJ, et al: Glycyrrhizin, inhibitor of high mobility group box-1, attenuates monocrotaline-induced pulmonary hypertension and vascular remodeling in rats. Respir Res 2014; 15: 148
74) Dai M, Xiao R, Cai L, et al: HMGB1 is mechanistically essential in the development of experimental pulmonary hypertension. Am J Physiol Cell Physiol 2019; 316: C175–C185
75) Venkataraman R, Belardinelli L, Blackburn B, et al: A study of the effects of ranolazine using automated quantitative analysis of serial myocardial perfusion images. JACC Cardiovasc Imaging 2009; 2: 1301–1309
76) Belardinelli L, Shryock JC, Fraser H: Inhibition of the late sodium current as a potential cardioprotective principle: Effects of the late sodium current inhibitor ranolazine. Heart 2006; 92 suppl. 4: iv6–iv14
77) Liles J, Oliver J, Chi L, et al: Ranolazine reduces monorotaline-induced pulmonary hypertension when administered following disease induction. Circulation 2012; 126 suppl.: A11990
78) Rocchetti M, Sala L, Rizzetto R, et al: Ranolazine prevents INaL enhancement and blunts myocardial remodeling in a model of pulmonary hypertension. Cardiovasc Res 2014; 104: 37–48
79) Liles JT, Hoyer K, Oliver J, et al: Ranolazine reduces remodeling of the right ventricle and provoked arrhythmias in rats with pulmonary hypertension. J Pharmacol Exp Ther 2015; 353: 480–489
80) Gomberg MM, Schilz R, Mediratta A, et al: Phase I safety study of ranolazine in pulmonary arterial hypertension. Pulm Circ 2015; 5: 691–700
81) Khan SS, Cuttica MJ, Beussink NL, et al: Effects of ranolazine on exercise capacity, right ventricular indices, and hemodynamic characteristics in pulmonary arterial hypertension: A pilot study. Pulm Circ 2015; 5: 547–556
82) Umar S, Rabinovitch M, Eghbali M: Estrogen paradox in pulmonary hypertension: Current controversies and future perspectives. Am J Respir Crit Care Med 2012; 186: 125–131
83) Humbert M, Sitbon O, Chaouat A, et al: Survival in patients with idiopathic, familial, and anorexigen-associated pulmonary arterial hypertension in the modern management era. Circulation 2010; 122: 156–163
84) Tofovic SP: Estrogens and development of pulmonary hypertension: Interaction of estradiol metabolism and pulmonary vascular disease. J Cardiovasc Pharmacol 2010; 56: 696–708
85) Farhat MY, Vargas R, Dingaan B, et al: In vitro effect of oestradiol on thymidine uptake in pulmonary vascular smooth muscle cell: Role of the endothelium. Br J Pharmacol 1992; 107: 679–683
86) Zuckerman SH, Ahmari SE, Bryan-Poole N, et al: Estriol: A potent regulator of TNF and IL-6 expression in a murine model of endotoxemia. Inflammation 1996; 20: 581–597
87) West J, Cogan J, Geraci M, et al: Gene expression in BMPR2 mutation carriers with and without evidence of pulmonary arterial hypertension suggests pathways relevant to disease penetrance. BMC Med Genomics 2008; 1: 45
88) Austin ED, Cogan JD, West JD, et al: Alterations in oestrogen metabolism: Implications for higher penetrance of familial pulmonary arterial hypertension in females. Eur Respir J 2009; 34: 1093–1099
89) Liu A, Schreier D, Tian L, et al: Direct and indirect protection of right ventricular function by estrogen in an experimental model of pulmonary arterial hypertension. Am J Physiol Heart Circ Physiol 2014; 307: H273–H283
90) Chen X, Austin ED, Talati M, et al: Oestrogen inhibition reverses pulmonary arterial hypertension and associated metabolic defects. Eur Respir J 2017; 50: 1602337
91) Wang YD, Li YD, Ding XY, et al: 17β-estradiol preserves right ventricular function in rats with pulmonary arterial hypertension: An echocardiographic and histochemical study. Int J Cardiovasc Imaging 2019; 35: 441–450
92) Mair KM, Wright AF, Duggan N, et al: Sex-dependent influence of endogenous estrogen in pulmonary hypertension. Am J Respir Crit Care Med 2014; 190: 456–467
93) Kawut SM, Archer-Chicko CL, DeMichele A, et al: Anastrozole in pulmonary arterial hypertension. A randomized, double-blind, placebo-controlled trial. Am J Respir Crit Care Med 2017; 195: 360–368
This page was created on 2021-11-26T14:40:02.602+09:00
This page was last modified on 2021-12-17T09:59:32.000+09:00
このサイトは(株)国際文献社によって運用されています。