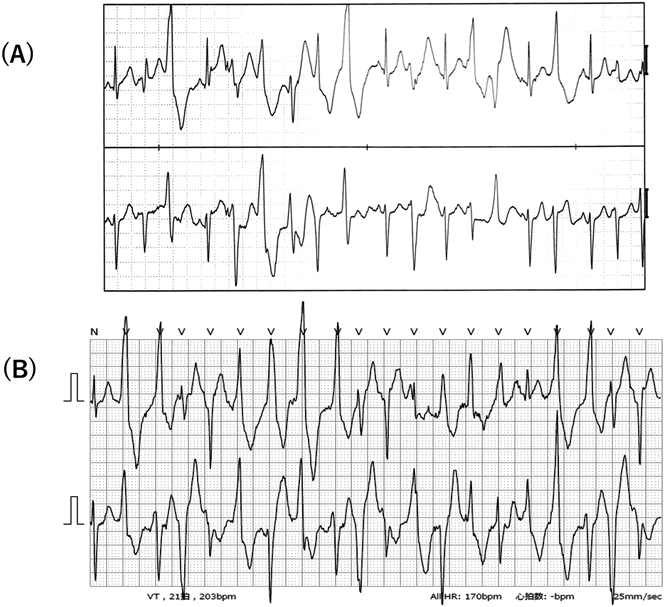
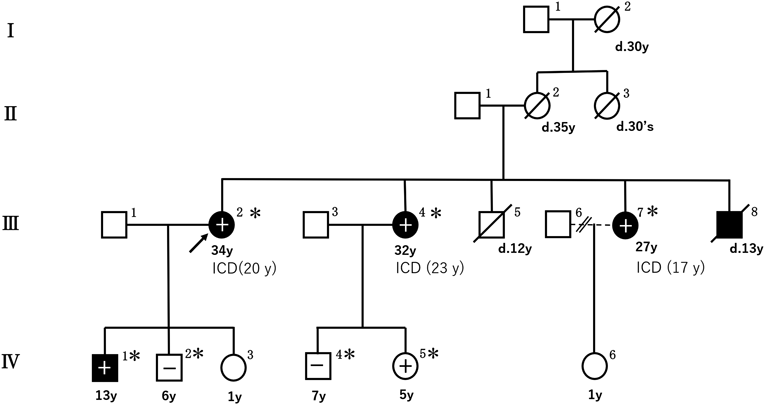
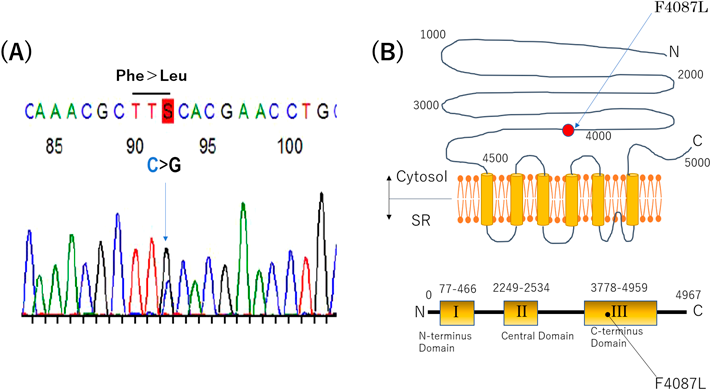
複数の突然死を有するカテコラミン誘発多形性心室頻拍の一家系A Large Family Report of Catecholaminergic Polymorphic Ventricular Tachycardia with Sudden Cardiac Death
1 船橋市立医療センター小児科Department of Pediatrics, Funabashi Municipal Medical Center ◇ Chiba, Japan
2 君津中央病院小児科Department of Pediatrics, Kimitsu Chuo Hospital ◇ Chiba, Japan
3 国立循環器病研究センター不整脈科・臨床検査部Department of Cardiovascular Medicine, National Cerebral and Cardiovascular Center ◇ Osaka, Japan