A. 急性期治療の概要
1. 適応
KDの診断は,2019年に改訂された「川崎病診断の手引き改訂6版」14)に基づいて行う.6つの主要症状のうち経過中に5症状以上を呈する場合はKDと診断する.このような典型例は,発熱があればIVIGとアスピリン(ASA)を含む標準治療が推奨される.手引きによれば,4主要症状でも他の疾患が否定され心エコーでCAAを呈する場合はKDと診断し,4主要症状でCAAがないか3主要症状以下の場合は鑑別診断を行った上で不全型KDと診断する.不全型KDはCAA合併のリスクが典型例と同等(全国調査ではより高値)という報告もあるため15),他の疾患を否定した上で典型例と同様に標準治療を行うことが推奨される.
2. 病態に基づく治療目標
系統的血管炎症候群の定義ではKDは中型血管炎に分類され16),炎症は大動脈・小動脈にも及ぶが,主に中型筋型動脈の冠動脈に生じる.冠動脈炎の病理組織学的検討によれば17),発症後第6~8病日には,中膜が水腫のため離開し,単球/マクロファージを主体とした炎症細胞は内膜と外膜に限局している.第8~10病日には,炎症細胞が内膜と外膜から中膜に浸潤し,動脈壁全層に及ぶ汎動脈炎を呈する.炎症細胞が産生するサイトカイン,蛋白分解酵素,活性酸素などによって,内弾性板の断裂や中膜平滑筋層の傷害が生じて血管が脆弱化する.第10~12病日には,脆弱化した血管に血圧がかかり,風船が膨れるように遠心性に拡大しCAAを形成する.
KD急性期治療の目標は,炎症を早期に終息させCAAの発生を抑制することなので,可能な限り汎動脈炎が始まる前の第7病日までにIVIGを投与することが望ましい.IVIG不応で発熱が持続・再燃する場合でも一般に冠動脈拡大が始まる前の第9病日までに治療が奏功することを目指す2, 3).追加治療は,CAAが出現した後に実施しても拡張を抑制できない場合があり,IVIG不応例の判定を早期に行うことが勧められる.
3. 急性期治療の方針
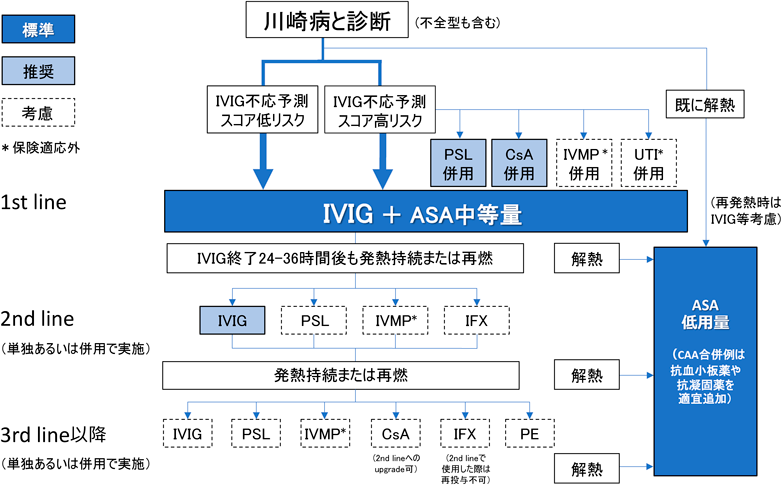
(1)治療のアルゴリズム(Fig. 1)
新たに追加された研究結果に基づき,旧ガイドライン3)に提示された急性期治療のアルゴリズムを改訂した.改訂に当たっては各治療法のクラス分類ならびにエビデンスレベル,さらに薬事承認や保険適用の有無を参考として,急性期治療における各時相(lineと表示)の標準的な治療,推奨する治療,考慮する治療の3種類に分類した.IVIGとASAによる初期治療以外では,適応・使用法・組み合わせ・順番の優劣は十分確立していないため,実際の治療に当たっては本文中のクラス分類やエビデンスレベルを参考に,各施設で治療法を選択することが望ましい.また,本ガイドラインは,各施設が独自の経験的治療法を行うことを制限するものではないが,実施する場合は患者・家族に十分に説明し同意を得て治療するだけでなく,必要に応じて臨床研究審査委員会や倫理審査委員会等の承認を受けて行うべきである.
(2)初期治療
①標準治療
初期治療の1st lineでは,発熱があればIVIG 2 g/kgの点滴静注とASA 30~50 mg/kg/日の中等量による標準治療を行う(クラス分類I,エビデンスレベルA;以下クラス,レベルと表示).発熱がなければASA 3~5 mg/kg/日の経口投与のみでもよいが,注意深く経過観察し,微熱の持続・血液検査上の炎症反応の悪化・心エコー検査上のCAAの徴候などがあれば,いわゆる「くすぶり型」と診断して18)IVIGの投与を考慮することが望ましい.
初期治療後に解熱し,再発熱しない場合は,ASAを3~5 mg/kg/日に減量する.IVIG投与終了後24~36時間の時点で,発熱(腋下体温で37.5度以上または深部体温で38.0度以上)を認める場合は不応例と判定して19),2nd lineの追加治療を行うことが推奨される.IVIG不応例は,旧ガイドラインではIVIG投与終了後24時間で判定していたが,製剤の種類が増え投与時間が異なっている現状を踏まえ,IVIG不応を判断するタイミングは投与終了後24~36時間19)(基本は投与開始後48時間の判定)とした.追加治療の必要性については,発熱以外の症状や血液検査なども勘案し,総合的に判定することが望ましい.いったん解熱した後,主要症状の増悪・再出現を認める再燃例も,他の発熱性疾患が否定的であれば,不応例と同様に2nd line以降の追加治療を行うことが推奨される.
②初期併用治療
日本では,年齢・診断病日・血液検査結果を組み合わせ,IVIGによる初期治療前に標準治療への反応性を予測するリスクスコアが提唱されている(Table 1)20–22).IVIG不応予測例の治療としてKobayashiスコア20)の高リスク例に対する通常量のPSL(2 mg/kg/日から開始し漸減)4)またはCsA(5 mg/kg/日,5日間)11)の併用,Egamiスコア21),Sanoスコア22)の高リスク例に対するIVMP(30 mg/kg/回,1回)23, 24)の併用によって,不応例もCAAの割合も低下することが示された.後方視的研究であるが,UTI(5000単位/kg/回3~6回/日)の併用によっても同様の効果が報告されている25).
Table 1 代表的なIVIG不応例予測スコア| 1. Kobayashi(群馬)スコア20): 5点以上;感度76%,特異度80% |
|---|
| 閾値 | 点数 |
|---|
| 血清ナトリウム133 mmol/L以下 | 2点 |
| 治療開始(診断)病日 第4病日以前 | 2点 |
| AST 100 IU/L以上 | 2点 |
| 好中球比率80%以上 | 2点 |
| CRP 10 mg/dL以上 | 1点 |
| 血小板数30.0×104/mm3 | 1点 |
| 月齢12か月以下 | 1点 |
| 2. Egami(久留米)スコア21): 3点以上;感度78%,特異度76% |
|---|
| 閾値 | 点数 |
|---|
| ALT 80 IU/L以上 | 2点 |
| 治療開始(診断)病日 第4病日以前 | 1点 |
| CRP 8 mg/dL以上 | 1点 |
| 血小板数30.0×104/mm3以下 | 1点 |
| 月齢6か月以下 | 1点 |
| 3. Sano(大阪)スコア22): 2点以上;感度77%,特異度86% |
|---|
| 閾値 | 点数 |
|---|
| AST 200 IU/L以上 | 1点 |
| 総ビリルビン0.9 mg/dL以上 | 1点 |
| CRP 7 mg/dL以上 | 1点 |
よって,本ガイドラインでは,IVIG不応予測例に対しては,保険適用のあるPSL(クラスI,レベルA)あるいはCsA(クラスIIa,レベルB)の併用を推奨する.保険適応外ではあるが,IVIG不応予測例に対するIVMP(クラスIIa,レベルB),UTI(クラスIIb,レベルC)の併用を考慮してもよい.なお,国外では日本で開発された予測スコアの感度が悪いことが課題となっている.米国では初期治療前の冠動脈拡大(Zスコア2.0~2.5以上)などによって6週後のCAAを予測する方法が提唱され26),このような症例に対して標準治療にPSLやIFXを併用する初期治療の有用性が報告されている27).
(3)追加治療
2nd lineの追加治療としては,IVIG再投与が推奨される(クラスI,レベルC).PSL(IVIGとの併用としてクラスIIa,レベルC),IVMP(クラスIIa,レベルB),IFX(5 mg/kg/回;クラスIIa,レベルB)の単独投与あるいはIVIGとの併用も考慮される.PSL, CsA, UTIを初期併用していた場合は同薬を継続使用して他の追加治療を行う場合が多い.初期治療にCsAを使用しなかった患者に対しては,十分な経験はないものの,CsA(クラスIIb,レベルC)を2nd lineの追加治療として使用することも可能である.2nd lineの追加治療終了後に解熱し再発熱しない場合は,ASAを3~5 mg/kg/日の低用量に減量する.
発熱が持続または再燃した場合は,3rd lineの追加治療としてIVIG, PSL, IVMP, CsA, IFX,血漿交換(PE;クラスIIa,レベルC)を選択する.2nd lineでIFXを使用した患者には,3rd line以降での再投与は控えるべきである(クラスIII,レベルC).IVIGは追加治療のいずれの時相でも選択肢となるが,初期治療や2nd lineの追加治療で使用していない薬剤を3rd lineで使用する意義はある.3rd lineにも不応であれば,さらに本ガイドラインで提示された治療法を患者の状態に応じて選択することが望ましい.
(4)補完的治療
CAA以外にも心筋炎,心膜炎,弁膜症,不整脈,ショックなどの循環器系合併症が生じることがあり,病態に応じて適切な補完的治療を行うことが推奨される.心不全,浮腫28),抗利尿ホルモン不適切分泌症候群(SIADH)による低ナトリウム血症29)を呈している際は,体液量が過剰にならないように輸液量に注意する.一方,脱水徴候がある場合は十分な輸液を要する.麻痺性イレウス,胆嚢炎,膵炎,脳炎・脳症,血球貪食症候群など全身臓器の合併症に対する対症療法も重要である.
いわゆる川崎病ショック症候群(KDSS)は30, 31),低血圧を伴い集中治療が必要な患者群と考えられる.年長児・女児に好発し,炎症反応高値・血小板数減少・低ナトリウム血症などを呈し,IVIG不応でCAAも合併することが多く,積極的な初期強化療法の選択や追加治療も想定した厳重な全身管理が必要となる.このほか,等張晶質液の輸液,カテコラミン投与,人工呼吸器といったショックの一般的治療を行う場合がある.報告例は欧米が主体で日本ではまれで,人種差が関係している可能性があり,KDSSの実態と適切な治療法は今後の検討課題である.
4. 全国調査からみた急性期治療の実態
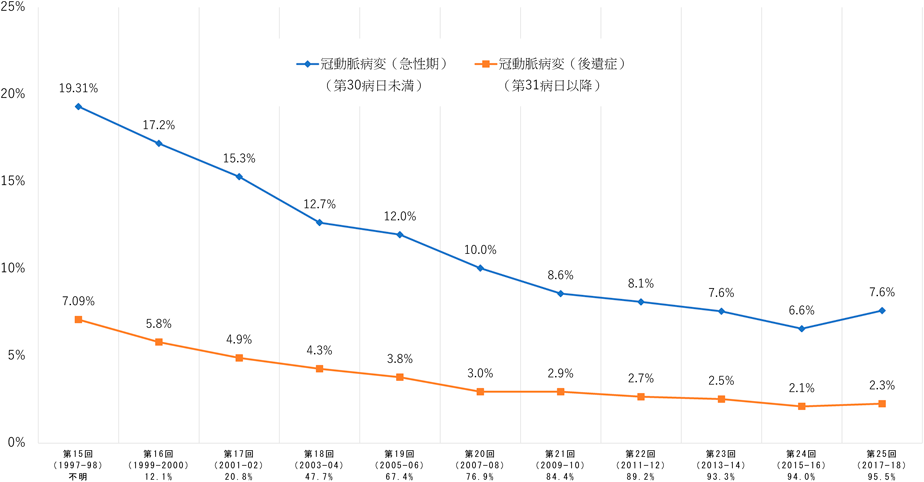
第25回川崎病全国調査によれば1),初期治療としてIVIGは94.6%に投与されていた.ステロイドの初期併用は13.2%に行われ,このうちPSLは84.6%,IVMPは17.1%であった.初期IVIG投与例に対する追加治療として,IVIG追加が21.6%,ステロイドが6.3%,IFXが2.6%,CsA(免疫抑制剤と表記)が1.5%,PEが0.5%など種々の治療が使用されていた.発症1か月未満の急性期の異常は,巨大瘤(0.1%)や拡大(6.5%)を含むCAAが計7.6%で,冠動脈狭窄・心筋梗塞・弁膜病変を含めると計8.9%であった.発症1か月以降の心後遺症は,巨大瘤(0.1%)や拡大(1.5%)を含むCAAが計2.2%で,冠動脈狭窄・心筋梗塞・弁膜病変を含めると計2.6%であった.死亡例は6例(0.002%)あり,以前に比べ死亡率は減少しているが,少数ながら発生していることに留意するべきである.
B. 医療経済
KDの治療にはIVIG等の高額治療を要することが多いことから,海外では急性期入院医療費用に関する報告がなされている.
Belay et al.は32)米国における1997年~1999年の5歳以下のKD入院症例7,431例の医療費を調査したところ,中央値が6,169ドルであり,RSウイルス細気管支炎,下痢症,ロタウイルス感染症における入院費用よりも高額であったと報告している.比較的最近の報告として,Ghimire et al.は33)米国における2009年~2012年の入院症例10,486例の入院期間と入院医療費を調査したところ,入院期間は週末入院だと4.10日,平日入院だと3.72日であった.CAAを有する症例では5.95日であり,有しない症例3.76日よりも長かった.入院費用は週末入院で平均31,294ドル,平日入院で34,303ドルであった.CAAを有する症例では56,089ドルで,有しない症例31,178ドルよりも高額であった.人種や医療保険の種類によっても在院日数や費用に違いが認められており,米国の医療システム固有の課題が示唆された.
複数の治療戦略の医療費比較に関する研究もみられる.Klassen et al.は34)カナダにおけるASAのみによる治療,低用量のIVIG,高用量のIVIGの3通りの治療戦略を比較したところ,高用量のIVIGがCAAの形成が最も少なく,しかも医療費の期待値が最も安くなると推計している.長期的な医療費削減効果について推計した研究は数少ない.Arj-ong et al.は35)タイにおけるIVIGの費用便益分析を実施しており,急性期ではIVIG群の方が高額となるが,長期的にはむしろ低額になるものと推計している.
我が国のSato et al.による医療経済研究によれば36),1991年~1995年に入院した原田スコア4点以上のKD患者145名のうち72名のIVIG2 g/kgの1回投与例では,73名の400 mg/kg/日の5日間投与例に比較し,CAAの発生率が減少するとともに,在院日数と医療費も有意に少なかった.Ogata et al.は37)2004年4月~2007年5月にIVIG投与に不応のKD患者27例を対象に,IVMP追加投与(14例)とIVMP療法(13例)を比較したところ,CAAの発生率および追加入院期間に有意差はなかったが,平均医療費は各々918,300円と290,610円であり,IVMP群の方が有意に低かったことを報告している.一方,IVMP後の追加治療の必要性のため,医療費も有意差がなかったという検討もある38).
最近ではOkubo et al.が39)2010年7月~2015年3月のDPCデータを用いて24,517人の入院患者を対象に,急性期治療ガイドライン導入前後におけるステロイド早期使用の実施状況に基づき病院を分類し,医療費の推移を比較している.その結果,ガイドライン導入前はステロイド早期使用をしていなかったが導入後に早期使用を開始した17病院については入院医療費が289,294円から266,495円に減少していた.IVIG不応予測例に対し,初期併用治療を行うことは,IVIG追加投与やCAA合併率を減らすことで医療費の軽減に寄与すると思われる.
以上より,KDの急性期治療は高額ではあるが,診療ガイドライン等に基づき適切かつ効率的な治療を実施することにより,急性期における医療費を削減できることが示されている.一方,長期的な費用対効果に関する研究は限られていることから,今後はKDへの適切な治療介入によりCAAの発生を減少させることによる患者のQOLや生命予後について,改善効果や長期的な医療費への影響についてさらに研究を行い,治療の有効性に加えその価値を示していく必要があると考えられる.
I. 免疫グロブリン
1. 目的
現時点で最も信頼できる抗炎症療法で,早期に大量の完全分子型のIVIGを開始することでCAAを減少させることが可能である40–43).
2. 作用機序
疾患の原因が不明なため推測であるが,Table 2に示すような機序により免疫異常を調節する可能性が考えられている44–47).
Table 2 IVIGの免疫調節作用30–33)| 1. Fc受容体を介する中和抗体としての抗炎症作用 |
| ・補体を介する障害作用の軽減 |
| ・免疫複合体を介する炎症の軽減 |
| ・抗炎症性サイトカインの誘導 |
| ・血管内皮細胞の活性化抑制 |
| ・細菌性毒素・スーパー抗原の中和 |
| ・Matrix metalloproteinase (MMP)の調節 |
| 2. 免疫細胞と抗体への作用 |
| ・T細胞のサイトカイン,ケモカイン産生の調節 |
| ・T細胞スーパー抗原の中和 |
| ・樹状細胞の分化・成熟阻害と炎症性サイトカイン,ケモカイン産生の調節 |
| ・血管内皮細胞に対する自己抗体産生抑制 |
| ・好中球・マクロファージの食作用亢進(オプソニン効果) |
| ・単球に発現する炎症関連遺伝子(S100)のmRNA抑制 |
3. 適応(Fig. 2)
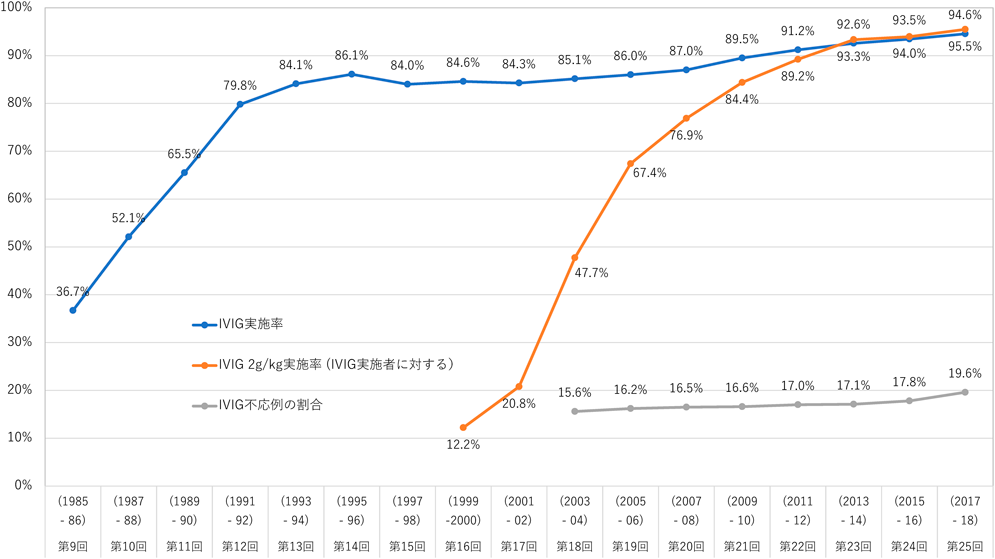
CAAを合併する可能性がある急性期KD症例,すなわち急性期症状が診断の手引き改訂6版に示された基準14)を満たし,KDと診断された典型的な有熱例はほぼ全例が適応である.また,診断方法での記載のように,主要症状が4つ以下で拡大病変を含むCAAが見られない患者や,3症状以下の場合でも他疾患が除外されて不全型と診断される患者ではCAAを合併することがある15)ため,鑑別診断を踏まえ可能な限り早期にIVIGを開始することが推奨される.Fig. 2に示すように,1980年代後半以降,IVIGの投与が全国的に普及し,最近ではほぼ全例に実施されており,第25回川崎病全国調査の結果では,全症例の94.6%がIVIGの投与を受けた1).軽症例や自然に解熱した例では,各施設での重症度基準48)を参考にして投与されない例も少数ある.
4. 用法・用量
(1)投与時期
第7病日以前にIVIGが開始されることが望ましい.特にCAAの出現が始まるとされる前の第9病日までに治療が奏効し,解熱を含め炎症が鎮静化することが重要である.具体的には,より早期に解熱し,CRPなど血管炎の炎症マーカーも低下することを目指す.
2019年の診断の手引き改訂6版では14),早期診断例の増加を反映し,主要症状としての発熱の判断に日数の基準は削除された.第5病日以前の治療開始例は,第6~9病日での治療開始例と比較して,治療開始後から解熱までの時間はやや長いが,発熱日数全体は短縮され,再発熱やIVIGの追加投与の頻度,入院日数に差はなく,発症後1年でのCAA合併率は少ないと報告されている49).
第25回川崎病全国調査の結果1)では,IVIGを開始した病日として最も多かった順に,第5病日(34.8%),第4病日(25.2%),第6病日(16.4%),第3病日(9.1%),第7病日(7.3%),第8病日(2.9%),第2病日(1.6%),第9病日(1.2%),第1病日(0.1%)であった.
(2)用量(Fig. 2)
急性期のIVIG投与量は,添付文書状の記載では通常下記のいずれかである.
- ① 2 g/kg/日(単回投与)
- ② 200~400 mg/kg/日を3~5日間(分割投与)
2 g/kg/日の単回投与は分割投与に比べてCAAの発生率が明らかに少なく,炎症マーカーを早期に鎮静化させ,解熱効果も高い42, 43).Fig. 2のIVIG 2g/kg実施率のグラフに示す様に,この10年ではほぼ90~95%の例でこの方法が用いられている.旧ガイドライン3)で記載した,1 g/kg/日×1日または2日連続(単回投与変法)は2 g/kg単回投与への移行段階で行われていたが,添付文書には記載されていない用法・用量で,現在では例外的である.体重が大きな年長児における用量については医療費が高額となるため意見の統一をみていないが,2.0 g/kg単回投与で治療されていることが多い.
単回投与は,製剤間に注入速度の違いはあるが,一般に日本では12~24時間で,米国では10~12時間で2 g/kgを点滴静注されている.IVIG投与中は,急激な容量負荷による心不全の発症および心機能低下の増悪に十分留意し,投与速度が速過ぎないように注意する.分割投与が行われる場面は,現在では極めて少ないと思われる.
(3)種類と使用法
現在,国内では完全分子型免疫グロブリン製剤として,薬事承認が得られている製剤として2種類のポリエチレングリコール処理製剤,スルホ化製剤,pH 4(酸性)処理製剤の4種類がある.製剤間で効果に明らかな差はないとされている.Table 3に添付文書に基づいて詳細を記載した.
Table 3 IVIG製剤の種類と用法・用量| 商品名 | 献血ベニロン—I静注用 | 献血グロベニン—I静注用 | 献血ヴェノグロブリンIH 5%静注 | 献血ヴェノグロブリンIH 10%静注 | 献血ポリグロビンN 5%静注 | 献血ポリグロビンN 10%静注 |
|---|
| 一般名 | 乾燥スルホ化人免疫グロブリン | 乾燥ポリエチレングリコール処理人免疫グロブリン | ポリエチレングリコール処理人免疫グロブリン | ポリエチレングリコール処理人免疫グロブリン | pH 4処理酸性人免疫グロブリン | pH 4処理酸性人免疫グロブリン |
| 会社名(製造-販売) | KMバイオロジクス-帝人ファーマ | 日本製薬-武田 | 日本血液製剤機構 | 日本血液製剤機構 | 日本血液製剤機構 | 日本血液製剤機構 |
| 剤 形 | 凍結乾燥製剤 | 凍結乾燥製剤 | 液状製剤 | 液状製剤 | 液状製剤 | 液状製剤 |
| 組成(2.5G製剤) | スルホ化人免疫グロブリンG 2,500 mg, グリシン975 mg, 人血清アルブミン125 mg, D-マンニトール450 mg, 塩化ナトリウム500 mg. | ポリエチレングリコール処理人免疫グロブリンG 2,500 mg, D-マンニトール750 mg, グリシン225 mg, 塩化ナトリウム450 mg. | 人免疫グロブリンG 2,500 mg, D-ソルビトール 2,370 mg, 水酸化ナトリウム適量,塩酸適量. | 人免疫グロブリンG 2.5 g, グリシン0.38 g, 水酸化ナトリウム適量,塩酸適量. | 人免疫グロブリンG 2.5 g, マルトース水和物5 g, 水酸化ナトリウム適量,塩酸適量. | 人免疫グロブリンG 2.5 g, グリシン0.75 g, 水酸化ナトリウム適量,塩酸適量. |
| 用法・用量 | 通常,1日に200 mg (4 mL)/kgを5日間点滴静注または直接静注,もしくは2,000 mg (40 mL)/kg体重を1回点滴静注する.なお,年齢および症状に応じて5日間投与の場合は適宜増減,1回投与の場合は適宜減量する. | 通常,1日に200 mg (4 mL)/kgを5日間点滴静注または直接静注,もしくは2,000 mg (40 mL)/kg体重を1回点滴静注する.なお,年齢および症状に応じて5日間投与の場合は適宜増減,1回投与の場合は適宜減量する. | 通常,1日400 mg (8 mL)/kgを5日間点滴静注または直接静注,もしくは2,000 mg (40 mL)/kg体重を1回点滴静注する.なお,年齢および症状に応じて適宜減量する. | 通常,1日400 mg (4 mL)/kgを5間点滴静注または直接静注,もしくは2,000 mg (20 mL)/kgを1回点滴静注する.なお,年齢および症状に応じて適宜減量する. | 通常,1日200 mg (4 mL)/kg体重を5日間点滴静注または直接静注,もしくは人免疫グロブリンGとして2,000 mg (40 mL)/kg体重を1回点滴静注する.なお,年齢および症状に応じて5日間投与の場合は適宜増減,1回投与の場合は適宜減量する. | 通常,1日400 mg (2 mL)/kgを5日間点滴静注または直接静注,もしくは2,000 mg (20 mL)/kg体重を1回点滴静注する.なお,年齢及び症状に応じて5日間投与の場合は適宜増減,1回投与の場合は適宜減量する. |
| 用法・用量に関連する使用上の注意 | 急速に注射すると血圧降下を起こす可能性がある(特に低または無ガンマグロブリン血症の患者には注意すること). |
| 投与速度:1)初日の投与開始から30分間は0.01~0.02 mL/kg/分で投与し,副作用等の異常所見が認められなければ,0.03~0.06 mL/kg/分まで徐々に投与速度を上げてもよい.2日目以降は,前日に耐容した速度で投与することができる.2)川崎病に対し2,000 mg (40 mL)/kgを1回投与する場合には,基本的には1)の投与速度を遵守することとするが,目安としては12時間以上かけて点滴静注すること. | 投与速度:ショック等の副作用は初日の投与開始1時間以内,また投与速度を上げた際に起こる可能性があるので,これらの時間帯について特に注意すること.1)初日の投与開始から1時間は0.01 mL/kg/分で投与し,副作用等の異常所見が認められなければ,徐々に速度を上げてもよい.ただし,0.06 mL/kg/分を超えないこと.2日目以降は,前日に耐容した速度で投与する.2)川崎病の患者に対し,2,000 mg (40 mL)/kgを1回で投与する場合は,基本的には1)の投与速度を遵守することとするが,急激な循環血液量の増大に注意し,12時間以上かけて点滴静注すること. | 投与速度:ショックなどの副作用は初日の投与開始1時間以内,また投与速度を上げた際に起こる可能性があるので,これらの時間帯について特に注意すること.1)初日の投与開始から1時間は0.01 mL/kg/分で投与し,副作用等の異常所見が認められなければ,徐々に速度を上げてもよい.ただし,0.06 mL/kg/分を超えないこと.2日目以降は,前日に耐容した速度で投与する.2)川崎病の患者に対し,2,000 mg (40 mL)/kgを1回で投与する場合は,基本的には1)の投与速度を遵守することとするが,急激な循環血液量の増大に注意し,12時間以上かけて点滴静注すること. | 投与速度:ショックなどの副作用は初日の投与開始1時間以内,また投与速度を上げた際に起こる可能性があるので,これらの時間帯について特に注意すること.1)初日の投与開始から1時間は0.01 mL/kg/分で投与し,副作用等の異常所見が認められなければ,徐々に速度を上げてもよい.ただし,0.06 mL/kg/分を超えないこと.2日目以降は,前日に耐容した速度で投与する.2)川崎病の患者に対し,2,000 mg (20 mL)/kgを1回で投与する場合は,基本的には1)の投与速度を遵守することとするが,急激な循環血液量の増大に注意し,6時間以上かけて点滴静注すること. | 投与速度:1)初日の投与開始から30分間は0.01~0.02 mL/kg/分で投与し,副作用等の異常所見が認められなければ,0.03~0.06 mL/kg/分まで徐々に投与速度を上げてもよい.2日目以降は,前日に耐容した速度で投与することができる.2)川崎病に対し2,000 mg (40 mL)/kgを1回投与する場合には,基本的には1)の投与速度を遵守することとするが,目安としては12時間以上かけて点滴静注とすること. | 投与速度:1)初日の投与開始から30分間は0.01~0.02 mL/kg/分で投与し,副作用等の異常所見が認められなければ,0.03~0.06 mL/kg/分まで徐々に投与速度を上げてもよい.2日目以降は,前日に耐容した速度で投与することができる.2)川崎病に対し2,000 mg (20 mL)/kgを1回投与する場合には,基本的には1)の投与速度を遵守することとするが,目安としては6時間以上かけて点滴静注とすること. |
各製剤の主な相違点としては,以下の点があげられる.
- ①スルホ化製剤は,5%の凍結乾燥製剤で,血清アルブミンを少量含有しており,ナトリウム濃度は生理食塩水と同じ154 mEq/Lである.
- ②ポリエチレングリコール処理製剤には5%の凍結乾燥製剤と液状製剤(5%および10%)がある.前者は,ナトリウム濃度が154 mEq/Lである.後者は冷蔵保存なので,注意点として投与前には室温程度に戻してから投与し,静脈内投与に際しては薬剤が血管外に漏れないよう注意が必要である.
- ③pH 4酸性処理製剤(5%および10%)は,液状化製剤で冷所保存なので,投与前には室温程度にしてから投与し,静脈内投与に際しては,薬剤が血管外に漏れないよう注意が必要である.また,5%製剤ではマルトースを添加しているため,投与後の血糖測定時に影響を受けるグルコース脱水素酵素法を用いた血糖測定法は使用しないよう注意する.
- ④製剤の濃度について,10%製剤が使用され始めており,5%製剤に比べて投与液量が半分になり,投与時間を約2分の1に短縮することが可能で,解熱効果も早いという報告もあるが50),製剤間の相違は今後の検討を要する.これに伴い,IVIG不応例の判定は,従来はIVIGの終了後24時間で行われていたが,本ガイドラインでは終了後24~36時間とした19).
いずれの製剤でも,アナフィラキシーなどの副作用は投与開始1時間以内や,投与速度が速いときに起こる可能性があるため,投与開始後30分~1時間の時間帯については,特に注意が喚起されている.異常がなければ,2 g/kgの残量について,5%製剤は12~24時間,10%製剤は6~12時間かけて投与する.
(4)IVIG不応例に対するIVIG追加投与(Fig. 2)
Fig. 2のIVIG不応例のグラフに示すように,IVIGとASAによる標準治療後,おおむね15~20%(第25回川崎病全国調査では19.7%1))に解熱効果が十分でない症例(IVIG不応例)が存在し,その割合は15年前の15%台からわずかに増加してきている.これらは,一般にIVIGの再投与によって治療されている.第25回川崎病全国調査の結果では1),初回IVIG不応例6,061例についての追加治療の内訳は,IVIG再投与を行った例が91.1%と大多数であった.IVIGの再投与によって,不応例の約半数には症状改善効果がみられるとされる51).
5. 有用性(Fig. 3)
IVIGは安全性も高く,現時点で最も信頼性の高い治療法で,その有用性は世界的に広く認められており,多くの教科書やガイドラインにも記載されている40–43).IVIGはFurusho et al.40)による非盲検化ランダム化比較試験の後,Newburger et al.41, 42)による2つの二重盲検ランダム化比較試験によって確立した.Cochrane Libraryの系統的レビュー・メタ解析によれば43),IVIGはプラセボに比較して,第30病日のCAA合併率を有意に抑制する(統合オッズ比0.74, 95%信頼区間[CI]0.61–0.90).また,2 g/kgの単回投与は,400 mg/kg/日の5日間分割投与に比べ,CAA合併率をより抑制する(統合オッズ比4.47, 95% CI 1.55–12.86)ことが示されている.
KDに対するIVIGの有用性の指標としては,CAAを含む心合併症の発生率が最も重要であり,全国調査ではFig. 3のように2 g/kg/日の単回投与例の増加に伴い心合併症は減少し,第25回全国調査では,第30病日までの急性期冠動脈障害の割合は7.6%,第30病日以降も残存する冠動脈後遺症の割合2.3%であった.冠動脈以外に弁膜病変も第30病日以内に1~2%,第31病日以後に0.5%以下ではあるが合併する.冠動脈合併症の発生率は2 g/kgの単回投与がほとんど行われていなかった時期(1997~1998年)と比較しておおむね3分の1に減少した.
6. 副作用(Table 4)52, 53)
日本において,これまで完全分子型免疫グロブリンによるウイルス感染の報告はない.献血者の血液については,HBs抗原,抗HCV抗体,抗HIV-1抗体,抗HIV-2抗体および抗HTLV-I抗体陰性で,かつALT値でスクリーニングが実施されている.さらに,プールした試験血漿は,HAV, HBV, HCV, HIVおよびヒトパルボウイルスB19について核酸増幅検査を実施し,適合した血漿のみが使用されている.現在の各製剤の製造工程では,異常プリオンとヒトパルボウイルスB19など核酸増幅検査の検出限界以下のウイルス混入による感染の可能性を否定はできないが,投与後に感染が発生した報告はない.
Table 4 IVIGの一般的副作用52, 53) | 高頻度 | まれ |
|---|
| 総合的 | 疲労感,発熱,顔面発赤,悪寒 | アナフィラキシー |
| 全身的副作用 | 食欲不振,筋痛,関節痛,関節腫脹 | 感冒症状,アナフィラキシー,眼瞼浮腫 |
| 神経学的 | 頭痛,片頭痛,めまい | 無菌性髄膜炎,脱力,感覚異常 |
| 呼吸器 | 息切れ,咳,気管支攣縮 | 胸水,輸血関連肺障害,肺水腫 |
| 心血管系 | 低血圧,高血圧,胸痛 | 不整脈,心筋梗塞 |
| 消化器 | 食欲不振,嘔気,嘔吐,腹痛,下痢 | 味覚異常 |
| 腎臓系 | | 尿細管障害,腎不全 |
| 皮膚 | 蕁麻疹,紅斑,丘疹,瘙痒症 | 多形滲出性紅斑 |
| 血液系 | 溶血 | 血栓塞栓症,過粘度症候群,白血球減少 |
これまで報告されている副作用としては,頻度は高くないが,投与による悪寒戦慄,ショック(チアノーゼ,血圧低下),アナフィラキシー様反応,無菌性髄膜炎54),溶血性貧血55),肝障害,黄疸,急性腎不全,血小板減少,肺水腫などがあり,十分な観察が必要である.特に,点滴静注開始直後と投与速度上昇後に,悪寒戦慄,意識障害,不穏,振戦,チアノーゼ,血圧低下,ショックの状態に注意する.急性期には潜在的な心筋障害や心不全の可能性があることに留意し,急激な循環血液量の増大,バイタルサインに注意しながら点滴静注する.そのほかの注意点として,次の場合には慎重に投与する.
- ①IgA欠損症の患者:抗IgA抗体を保有する患者では過敏反応を起こす恐れがある.
- ②腎障害のある患者:腎機能を悪化させる恐れがある.
- ③脳・心臓血管障害またはその既往歴のある患者:大量投与による血液粘度の上昇などにより,脳梗塞または心筋梗塞などの血栓塞栓症を起こす恐れがある.
- ④血栓塞栓症の危険性の高い患者:大量投与による血液粘度の上昇などにより,血栓塞栓症を起こす恐れがある.
- ⑤溶血性・失血性貧血の患者,免疫不全患者・免疫抑制状態の患者:ヒトパルボウイルスB19の感染を起こす可能性を否定できない.感染した場合には,発熱と急激な貧血をともなう重篤な全身症状,持続性の貧血を起こすことがある.
- ⑥心機能の低下している患者:大量投与により,心不全を発症または悪化させる恐れがある.
KDにおける大規模使用成績調査によれば,副作用は使用総数7,259例中484例697件(9.6%)で,重篤な有害事象は68例78件(1.1%)であった56).このようにIVIGは副作用がまれで安全性の高い治療法であるが,血液製剤であるため使用に際しては患者や家族に十分に説明し同意を得ることが必須である.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIGによる初期治療 | I | A |
| IVIG不応例に対するIVIGによる追加治療 | I | C |
II. ステロイド(Table 5)
Table 5 IVIG以外の急性期治療| 一般名 | 作用機序 | 投与経路・用法用量 | 主な副作用 | 注意事項 |
|---|
| プレドニゾロン | ステロイド受容体を介した炎症性蛋白質遺伝子の転写活性抑制. | 有熱期は2 mg/kg/日を分3で経静脈的に投与.解熱し全身状態が改善した後に同量で経口に変更.CRPが陰性化した後に同量で5日間継続.再燃の兆候がなければ1 mg/kg/日,分2を5日間,その後0.5 mg/kg/日,分1を5日間投与し中止. | ウイルス感染症の罹患(数%),満月様顔貌(投与例の大部分),解熱直後の低体温(数%),便潜血陽性(1%程度),高脂血症(数10%),好中球優位の白血球増多(ほぼ全例). | 投与中は体温やCRP値などの変化による再燃の判断が時に困難であるため,血液検査や心エコーを慎重にモニタリングする.再燃が疑われる場合は適切な介入を行うことが望ましい.再燃は投与開始後4~5日目,もしくは1 mg/kg/day減量後に発生することが多い. |
| メチルプレドニゾロン | 上記のほか,細胞膜の機能変化など非ゲノム作用による免疫細胞や炎症性サイトカインの抑制. | メチルプレドニゾロン30 mg/kgを1日1回点滴静注,1~3日間.終了後にプレドニゾロンの後療法を行うこともある. | 洞性徐脈(6~82%),高血圧(10~91%),高血糖(6~55%),低体温(6~9%)など.その他,まれであるが,ステロイド全般の副作用として,感染症,消化性潰瘍,精神障害,大腿骨頭壊死,副腎機能抑制など. | 心電図モニター,体温・血圧測定などによるバイタルサインの観察が必要. |
| シクロスポリンA | 転写因子NFAT阻害によるIL-2などのサイトカイン産生抑制. | 5 mg/kg/日,朝夕食前2回に分けて経口投与で開始.目標トラフ値60~200 ng/mLで調整する. | 一般的な有害反応として血圧上昇,悪心・嘔吐,振戦,高血糖,高尿酸血症,高脂血症(1~5%)など. | 無症候性の高カリウム血症(血清では認めることがあるが血漿では認めない),低マグネシウム血症の報告があるが,現在までに不整脈などの有害事象は認めていない. |
| インフリキシマブ | 可溶性TNF-αの生物活性を中和,膜結合型TNF-α発現細胞を補体依存性・抗体依存性細胞傷害により傷害,TNF-α受容体に結合したTNF-αを解離. | 5 mg/kgを点滴静注(投与回数は1回のみ). | 発疹(2.7%),ウイルス・細菌感染症(2.1%),infusion reaction (1.4%),白血球減少(0.3%),肝機能障害(0.3%)など. | 投与前に結核,ウイルス性肝炎の検査を提出.投与時は心電図モニター,体温・血圧測定などによるバイタルサインの観察が必要. |
| ウリナスタチン | 好中球や血小板からのエラスターゼの放出阻害と放出後の不活化. | 5,000単位/kgを1日3~6回,数日間点滴静注.1日量は30万単位を超えない. | アナフィラキシー(頻度不明),肝機能異常(0.5%),白血球減少(0.2%),発疹,掻痒感などの過敏症状(0.1%),下痢(0.1%),血管痛(0.1%),一過性AST・ALT上昇,好酸球増多,注射部位の血管痛など. | IVIG製剤との同一ルート内での混注は避ける. |
| 血漿交換 | 炎症性サイトカイン等の物理的除去. | 置換液を5%アルブミンとし,循環血漿量の約1~1.5倍を交換.通常3日間実施する(最大日数6日間). | 低血圧,ショック,アナフィラキシー様反応,低Ca血症,発熱・悪寒・戦慄,悪心・嘔吐,凝固系異常,カテーテル挿入血管の血栓形成や損傷など. | |
A. プレドニゾロン
1. 目的
川崎病血管炎を強力な抗炎症作用を持つPSLを投与することによってより早期に血管炎を鎮静化させ,結果として生じる冠動脈のリモデリングを抑制することが主たる目的である.
2. 作用機序
PSLは最も一般的に使用される合成副腎皮質ホルモンである.コルチゾールと比べ糖質コルチコイド作用が強く,細胞質に存在するステロイド受容体を介して炎症性蛋白質遺伝子の転写活性を抑制し,抗炎症蛋白質遺伝子の転写を亢進することにより強力な抗炎症作用を有する.PSLは腫瘍壊死因子(TNF)-α,インターロイキン(IL)-6, IL-8, IL-17, G-CSFといった各種の炎症性サイトカインやケモカインや細胞接着分子の産生を抑制し,lipocortin, IL-1受容体拮抗薬,β2受容体,NF-κB等の抗炎症性蛋白質の産生を亢進させることによって血管炎を鎮静化する57).
3. 適応
KDの急性期(重症であり,冠動脈障害の発生の危険がある場合)に対し保険適用がある.RAISE Study4, 20)の治療法に基づき,IVIG不応例を予測するKobayashiスコア5点以上の重症例に対して,初期治療からIVIG 2 g/kg単回投与およびASA中等量にPSLを併用する施設が多い.
4. 用法・用量
初期治療としてIVIGと併用する場合はRAISE Study4)に準じた用法・用量を用いるのが一般的であり,IVIG不応例に対する追加治療として使用する場合も初期治療に準じて行う.有熱期はPSL 2 mg/kg/日を分3で経静脈的に投与する.解熱し全身状態が改善した後に経口に変更する.RAISE Studyでは,CRPが陰性化した後に同量で5日間継続し,再発熱や他の主要症状の悪化,炎症マーカーの再上昇などの再燃の兆候がなければ1 mg/kg/day分2を5日間,0.5 mg/kg/day分1を5日間投与後中止する.漸減中に再燃の兆候を認めた場合は減量の中止や再増量,IVIGの追加投与等の治療を行う.
また,PSL投与中は,体温やCRP値などの炎症性マーカーの変化等による再燃の判断が難しい場合もある.そのため,PSL投与中は血液検査や心臓超音波検査をより頻回に実施し,再燃が疑われる場合は適切な介入を行うことが望ましい.再燃はPSL投与開始後4~5日目,もしくは1 mg/kg/dayへの減量後に発生することが多い.
5. 有用性
PSLはKD患者に対して広く使用された時期があったが,死亡例の疫学調査ではPSL投与症例が多い傾向にあったこと58),PSL単独療法はCAAの発生頻度を増すと結論した後方視的研究59),ASA,フルルビプロフェン,PSL+ジピリダモールの3治療群による前方視的ランダム比較試験60)によってPSLの有用性が証明されなかったことなどから長く禁忌とされてきた.
2006年にKD患者全例に対するIVIG+PSL初期併用療法とIVIG療法のCAA予防効果を検証するランダム化比較試験61)が報告された.臨床試験はエントリー率低値により目標症例数まで到達しなかったものの,IVIG+PSL初期併用療法はCAA合併率を有意に減少することが明らかとなった.また,Kobayashiスコア20)を用いて定義された重症KD患者に対してPSLはよりCAA形成抑制効果が高いことが想定されたため62),これらの患者を対象としたIVIG+PSL初期併用療法の有用性を検討するランダム化比較試験(RAISE Study)4)が実施された.RAISE Studyの結果,Kobayashiスコア5点以上の重症川崎病患者に対するIVIG+PSL初期併用療法は,IVIG療法と比較してCAA合併例と追加治療必要例の割合を有意に減少させることが明らかとなった.Cochrane Libraryによる系統的レビュー・メタ解析7)ではIVIG+PSL併用療法はIVIG療法と比較してCAA合併リスクを下げる(統合オッズ比0.13, 95%CI 0.05–0.32)中等度のエビデンスを有すると評価された.また,大規模前方視的コホート研究(Post RAISE)5)においてはIVIG+PSLによる初期治療成績は,RAISE StudyのIVIG+PSLの成績とほぼ同等であったと報告されている.
IVIG不応例に対するPSLの有用性は適切なデザインのランダム化比較試験が実施されていないため,因果効果は現時点で明確ではない.一方,追加治療としてのIVIG+PSL併用療法がIVIG療法やPSL療法と比較してCAA形成リスクが低く,追加治療の必要性が少ないとの後方視的観察研究63)が報告されており,一定の有効性を有することが想定されている.ただし,病日が進んだ段階でPSLを投与することはCAA形成リスクを下げない可能性63, 64)も同様に指摘されているため注意が必要である.
6. 副作用
急性期のKD患者に対するPSL投与中に発生する副反応としては,ウイルス感染症への罹患(数%),満月様顔貌(投与例の大部分),解熱直後の低体温(数%),便潜血陽性(1%程度),高脂血症(数10%),好中球優位の白血球増多(ほぼ全例)などが認められる.これらは適切な治療,もしくは経過観察のみで改善する例がほとんどである.尿路感染症や敗血症といった細菌感染症への罹患(1%未満)にも注意が必要であり,川崎病の再燃とを鑑別した上で適切な抗菌薬投与を行う.重篤な副作用としての報告はないものの,PSL投与による洞徐脈65)や副腎機能不全66)にも注意が必要である.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG不応予測例に対するIVIG+PSLによる初期治療 | I | A |
| IVIG不応例に対するIVIG+PSLによる追加治療 | IIa | C |
B. メチルプレドニゾロンパルス
1. 目的
IVMPは,強力で迅速な免疫抑制・抗炎症作用によって早期に血管炎を鎮静化させることを目的として,ステロイド薬の中でも電解質作用が少ないメチルプレドニゾロンを大量に点滴静注する治療法である.小児のリウマチ性疾患や腎疾患などの重症例に広く用いられ,KDでもIVIG不応例への追加治療やIVIG不応が予測される重症例に用いられている.
2. 作用機序
ステロイドは細胞質内受容体に結合し,核内でNF-κBなどの遺伝子の発現を調節し抗炎症作用を示す(ゲノム作用)57).IVMPでは,細胞質内受容体の飽和量を大幅に上回る大量のステロイドを静注するため,ゲノム作用以外の機序も関与すると予想される.この非ゲノム作用には,細胞質内受容体と複合体を構成する蛋白質による作用,細胞膜のステロイド受容体を介する作用,さらに大量投与ではステロイドの細胞膜への陥入による膜結合蛋白質の機能変化があり,ゲノム作用よりも急速に発現する57, 67).
KDでは,IVMPは早期に効果を認めることから,主に非ゲノム作用によって免疫細胞の働きや炎症性サイトカインを抑制すると推測される.IVIG不応例あるいは不応予測例において,IVMPによって炎症や冠動脈病変に関わるサイトカインの産生68)や遺伝子レベルの転写量69)が低下することが報告されている.
3. 適応
KDに対する保険適用はない.IVIG不応予測例に対する初期IVIGとの併用治療,またはIVIG不応例に対する追加治療として用いる.
4. 用法・用量
腎疾患や膠原病では,メチルプレドニゾロン20~30 mg/kgを1日1回,2~3時間かけて点滴静注し,3日間投与する方法が標準的である67).KDでは,初回IVIGとの併用では30 mg/kgを1回のみ23, 24, 70),IVIG不応例に対する使用では同量を1日1回,1~3日間とする報告37, 68, 69, 71–73)が多い.
5. 有用性
リスク層別化していないKD全例に対する二重盲検ランダム化比較試験70)では,発熱日数,IVIG追加の割合,CAA合併率は,IVIG+IVMP群とIVIG+プラセボ群で同等であった.ただし,IVIG追加例の事後解析では,IVIG+IVMP群のCAA合併率は有意に少なかった.IVIG不応予測例に対するIVIG+IVMP初期併用療法について,Sanoスコア(歴史対照比較研究)23),Egamiスコア(非盲検化ランダム化比較試験)24)に基づいた研究では,IVIG単独投与と比べ早期に解熱し,CAA合併率も有意に少なかった.EgamiスコアによるIVIG不応予測例に対するIVIG+IVMP初期併用療法の前方視的コホート研究では74),2nd lineにIVIG, 3rd lineにIFXかPEを用いてCAAを抑制できた.PSLまたはIVMPを含むステロイドと初期IVIGの併用療法に対するメタ解析では6, 7),IVIG単独に比べCAAの発生率が有意に低下することが示されている.Cochrane Libraryによるランダム化比較試験の系統的レビュー・メタ解析におけるIVMPのみ(one-off steroid use)の感度解析では7),CAAの抑制効果に統計学的な有意差は認めなかった(統合オッズ比0.56, 95% CI 0.29–1.08).
IVIG不応例に対する追加治療としてIVMPの効果をIVIG追加と比較した場合,CAA合併率が同等であることが複数の研究で示されている37, 38, 68, 71).IVMPの半減期が3時間と短いことから67),終了後にPSLの後療法(1~2 mg/kg/dayで開始し1~3週間かけて漸減)を行う報告72, 73)もある.
6. 副作用
KDにおけるIVMPの有害事象の検討では,洞徐脈(6~82%),高血圧(10~91%),高血糖(6~55%),低体温(6~9%)などが報告されている72, 75).よって,IVMP実施時には,心電図モニター,血圧測定などによる注意深いバイタルサインの観察が望まれる.消化性潰瘍の予防にH2ブロッカーなどの抗潰瘍剤,血栓症の予防にヘパリンをIVMPと併用する報告もあるが72, 73),その必要性は確立していない.ステロイド全般の副作用として,感染症,消化性潰瘍,精神障害,大腿骨頭壊死,副腎機能抑制などがあるが,短期投与のIVMPではまれと考えられる.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG不応予測例に対するIVIG+IVMPによる初期治療 | IIa | B |
| IVIG不応例に対するIVMPによる追加治療 | IIa | B |
III. 免疫抑制剤(Table 5)
A. シクロスポリンA
1. 目的
2008年以降,T細胞を含む免疫細胞のCa2+/NFAT(nuclear factor of activated T cells)経路に関連する複数の遺伝子が,KD罹患感受性やCAA発症など重症度への関与が報告され76–78),KD血管炎においてCa2+/NFAT経路活性化が重要な役割を担うことが示唆されている.Ca2+/NFAT経路を抑制する薬剤がCsAである.CsAによるCa2+/NFAT経路抑制によって血管炎や血管壁破壊を阻止することが目的である.
2. 作用機序
CsAの作用機序は,T細胞を含む免疫細胞活性化のシグナル伝達において重要な役割を持つカルシニューリンに結合して,転写因子NFATの脱リン酸化による核内移行を阻害し,IL-2などの炎症性サイトカイン産生を抑制する79).
3. 適応
KDの急性期(重症であり,冠動脈障害の発生の危険がある場合).IVIG不応予測例に対する初期IVIGとの併用治療,またはIVIG不応例に対する追加治療として用いる.経口液剤は2020年2月にKDに対する保険適用が得られたが,カプセルや静注製剤は適応外使用である.
4. 用法・用量
IVIG不応予測例に対して初期強化療法としてIVIGに併用し,通常,CsA液剤を5 mg/kg/日,朝夕の食前に2回に分けて経口投与し,原則5日間服用する11).3日目の投与前にトラフ値を測定し,60~200 ng/mLの至適濃度の範囲内であることを確認し,投与量を調節することが可能である.なお,吸収の安定性から食前服用が推奨される.
IVIG不応例への追加治療としても,CsA液剤を5 mg/kg/日,朝夕の食前に2回に分けて経口投与する80, 81).開始5日間で効果を認めるようであればCRP陰性化もしくは10~14日間を目安として漸減・中止する場合もある80, 81).静注用CsAについて,3~4 mg/kg/dayを分2で静注や3 mg/kg/dayで持続静注し,適宜経口用CsAに変更する81, 82)という報告がある.
5. 有用性
初期治療として,IVIG不応予測例を対象として,IVIG+ASAによる標準治療と比較して,標準治療にCsAを加える試験治療群がCAA形成リスクを減少させるかを検証するランダム化比較試験(KAICA Trial)が実施された.その結果,標準治療+CsA群が有意にCAAの形成リスクが低いことが報告されている(リスク比0.46, 95% CI 0.25–0.86)11).
IVIG不応例に対する3rd lineとしてのCsAを投与した国内外の観察研究では,多くの例で治療後5日間以内に解熱が得られ,CRPなどの炎症所見が改善していた80, 81).しかし,CsA不応例も存在し,その場合3回目のIVIGが有効である場合も経験される80).4か月未満児への使用経験は少ない83).
6. 副作用
KD児への使用では,現在まで重篤な副作用の報告はないが,稀な副作用を検出できる十分な使用経験がないため注意が必要である.血清検体で高カリウム血症を約40%に認めるが無症候性であり,血漿検体では認めず,偽性高カリウム血症の可能性が指摘されている80).低マグネシウム血症の報告もあるが81),電解質異常にともなう不整脈の報告はない.その他,5%以上の頻度の副作用として多毛(長期使用),1%から5%未満の副作用として血圧上昇,悪心・嘔吐,振戦が報告されている.CsAはCYP3A4で代謝されるため,同様にCYP3A4で代謝されるマクロライド系抗生物質はCsAの血中濃度を上昇させることがあるため併用には注意が必要である.一方,スタチンとの併用ではスタチンの血中からの消失が遷延するとされている.
CsAを川崎病治療に使用する際,生ワクチン接種後の期間の安全性に関する明確な根拠はない.主治医が個々のベネフィット・リスクを慎重に判断した上で,感染症の発現に十分注意して本剤を投与する必要があると考えられる.
B. メソトレキセート
血管炎を抑制することを目的とし,IVIG不応例に低用量のメソトレキセート(MTX)が有効であったという報告が海外である84, 85).その作用機序は,1)プリン代謝関連酵素の抑制,2)T細胞活性化抑制,3)選択的B細胞抑制,4)メチルトランスフェラーゼ活性の抑制などが考えられるが詳細は明らかでなく,日本ではKDに対しては適応外使用である.体表面積あたり10 mg/m2(最大16 mg),経口投与,週1回を解熱するまで投与する.ランダム化比較試験の成績はなく,従来の報告はいずれも後方視的検討である.低用量MTX投与後24時間以内に有意に最高体温は下降し,CRPは投与後1週間で有意に低下した85).通常量のMTXによって,よく認められる副作用(白血球減少,肝障害,潰瘍性口内炎など)は,低用量では少ないが嘔気・嘔吐が問題になることがある.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG不応予測例に対するIVIG+CsAによる初期治療 | IIa | B |
| IVIG不応例に対するCsAによる追加治療 | IIb | C |
IV. 生物学的製剤(Table 5)
A. インフリキシマブ
1. 目的
主にIVIG不応例や重症例に用いられ,TNF-αと特異的に結合することによって炎症経路を抑制し血管炎を鎮静化させる.
2. 作用機序86)
IFXは抗ヒトTNF-αモノクローナル抗体である.1分子あたりマウスの蛋白質を約25%含むため,抗キメラ抗体(中和抗体)がおおむね40%で出現し,慢性投与では効果の減弱やアレルギー反応が生じることがある.その作用機序は,可溶型TNF-αへの結合・中和,受容体に結合したTNF-αの解離,TNF-α産生細胞の傷害によるTNF-αの抑制とされている.
3. 適応
保険適用は,既存治療で効果不十分なKDの急性期であり,IVIG不応例に対する追加治療として用いる.
4. 用法・用量
通常は,IVIG不応のKDに対して5 mg/kgを生食50~250 mLで希釈して2時間以上かけて点滴静注する.投与終了後2時間で血中濃度はピークに達し,半減期は8~10日と長い.また頻回投与にともなう副作用の観点からも,急性疾患であるKDに対しては単回投与が原則である.米国では,2nd lineにおけるIFX 10 mg/kg単回投与とIVIG追加のランダム化比較試験(KIDCARE trial)が進められている87).
5. 有用性
IVIG追加にも不応の3rd line以降での使用が主である.第10病日未満にIFXが投与されればCAA合併の頻度が低く3),第9病日以内の投与が望ましい.約20%でIFX不応であり,不応の場合は速やかに追加治療を行う.2nd lineでも有効性が期待できるが,今後の検証を要し,3rd lineの使用に習熟した専門施設で行うべきである.2005年から2014年の全国調査では,2nd lineでの使用は434例中2.8%であったが2),2015年の保険適用以後の特定使用成績調査(SAKURA Study)では,291例中11.3%が2nd lineであった88).IFX投与後解熱までの平均時間は16.6時間と短く,IFX投与後48時間後の解熱率は77.4~83.6%であった88, 89).後方視的研究であるが,IFX投与群は非投与群に比べて,その後のPEの有効率90)やCAAの早期退縮率91)が高い可能性が示されている.3rd lineでのIFXと4th lineでのPEを主軸とした治療による低い遠隔期CAA合併率が,複数の後方視的研究において報告されている74,92).
2nd lineでは1st lineのIVIG不応例に対するIVIG追加とIFX投与を比較した複数のランダム化比較試験において,IFX群の解熱率が高いものの,CAAの発生率については有意差がないことが報告されている8, 93, 94).2019年のCochrane LibraryによるTNF-α阻害剤に関する系統的レビュー・メタ解析では10),IVIG不応例に対する投与はIVIG追加と比較して,不応のリスクを下げる(統合リスク比0.46, 95%CI 0.28–0.76)低いレベルのエビデンスを有し,CAAの合併リスクについては現時点で統計学的有意差を認めない(統合リスク比0.48, 95% CI 0.11–2.06)と評価されている.
1st lineでのIVIG+IFXによる初期治療強化療法は,ランダム化比較試験の報告はあるものの9),CAAの合併率を有意に減少させた報告はなく,すべてのKD症例に推奨するエビデンスはない.
6. 副作用
IFXの主な副作用を下記に示す.KDに対するIFX処方には,製薬会社が提供するe-learningにより使用適正情報を理解した小児科専門医が要件とされている.
(1)Infusion reaction
KDでは原則として単回投与であるため抗ヒスタミン薬等の前投薬の有無は施設により異なるが,投与開始後は頻回の観察,バイタルサインの確認を行うことは必須である.特定使用成績調査(SAKURA Study)ではinfusion reactionは294例中4例(1.4%)で認めた87).単施設で55例を検討した別の報告では95),前投薬使用下にinfusion reactionは1.8%でみられたが,その1例は川崎病再発による7か月間隔での2回目のIFX投与であった.再発等の理由でIFXの再投与を行う場合は,特に注意が必要と思われる.
(2)感染症増悪(結核,ウイルス性肝炎)
結核感染を除外するため,ていねいな問診と胸部レントゲン検査をIFX投与前に実施することが推奨される.必要に応じ胸部CT撮影も考慮する.インターフェロン-γ遊離試験またはツベルクリン反応は結果に時間を要するため,IFX投与が想定される場合には事前に検査することが望ましい.HBs抗原,HBs抗体,HCV抗体検査をIFX投与前に実施することが推奨される.なお,IVIG投与後には抗体が陽転化する可能性があるため,抗体検査はIVIG治療前の血液検体で行うことが望ましい.
(3)心不全増悪
成人ではニューヨーク心臓協会(NYHA)心機能分類III, IV度ではIFX投与による心不全増悪,死亡の報告があり禁忌とされている.KDにおいても心不全をともなう症例ではIFX投与は避け,他の治療を検討することが望まれる.
(4)1歳未満への投与,生ワクチンとの間隔について
添付文書では,1歳未満の乳児を対象とした国内臨床試験は実施されていないため,注意が必要とされている.また,日本川崎病学会,日本小児循環器学会,日本小児リウマチ学会が刊行した「既存治療で効果不十分な急性期川崎病に対するインフリキシマブの薬事承認と仕様の手引き」96)では,BCG接種後6か月間以上,その他の生ワクチン接種後3か月間以上は投与を控えることが推奨されている.
(5)その他
他疾患におけるIFX長期投与の場合は,悪性腫瘍の発症,脱髄性病変の増悪(髄鞘化の障害)も報告されているが,現在のところKDに対するIFXの単回投与でこれらの副作用は報告されていない.IFX投与川崎病患者14例の遠隔期(中央値23か月後)に頭部MRIを施行した報告でも,髄鞘化の障害はみられていない97).
B. その他
KDに対する保険適用はなくエビデンスも不十分であるが,生物学的製剤として,可溶性TNFα受容体拮抗薬(エタネルセプト),抗IL-6受容体抗体(トシリズマブ),IL-1受容体拮抗薬(アナキンラ)が報告されている.エタネルセプトは,半減期も短く副作用としての感染症罹患リスクが低いことが特徴である.予防接種時期が好発年齢であるKDにおいて今後有効な治療選択肢の一つとなる可能性が想定されている.2019年に報告された1st lineでのIVIG単独とIVIG+エタネルセプト皮下注の併用を比較した二重盲検ランダム化比較試験では98),解熱率には有意差を認めなかったものの,冠動脈径の変化はIVIG+エタネルセプト群で有意に低かった.トシリズマブはIVIG不応KDの4例に使用され,全例で解熱は得られたものの,2例に巨大瘤を生じたと報告されている99).アナキンラは,不応例における有効性がケースシリーズで報告されている100).アナキンラの安全性と有効性に関するPhase I/IIa試験(ANAKID trial)が米国で進行中である101).
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG不応例に対するIFXによる追加治療 | IIa | B |
V. 蛋白分解酵素阻害剤(Table 5)
A. ウリナスタチン
1. 目的
好中球から放出される蛋白分解酵素や炎症性サイトカインを抑制し,血管内皮細胞の傷害を軽減する.
2. 作用機序
ウリナスタチン(UTI)はヒト尿性trypsin inhibitorで,ヒト尿から高度精製され,trypsinを始めとする種々の蛋白分解酵素(膵酵素)に対して阻害作用を有する分子量67,000の多価酵素阻害剤(セリンプロテアーゼインヒビター)である.由来は血中のinter-α-trypsin inhibitorであると考えられている.全身諸臓器(肝,腎,膵,肺,心,副腎,胃,大腸,脳,精巣)で産生が確認されている.
(1)TNF-α抑制作用
多くのサイトカイン抑制作用を有する.好中球からのTNF-α, IL-6, IL-8の遊離を抑える.単球からのTNF-αの産生と分泌を抑制する102).またTNF-αにより活性化される血管内皮細胞上のICAM-1の発現を抑制し,内皮細胞を保護する機能がある.
(2)好中球エラスターゼ阻害
好中球からはエラスターゼをはじめ種々の蛋白分解酵素が放出される.UTIはライソゾーム膜を安定化させ,好中球からの各種酵素の放出を抑制する.また,放出された好中球エラスターゼの不活化にも作用し,結果的にフリーラジカルの除去(抗酸化作用),サイトカイン・接着分子の活性を低下させる.またTNF-αを含む心筋抑制因子の遊離阻害作用,凝固阻害作用も有する103).
3. 適応
KDに対しても小児に対しても保険適用はない.初期治療としてIVIGとの併用を考慮するほか,IVIG不応例の追加治療として投与されることがある.
4. 用法・用量
小児の用法・用量は確立されていない.5,000単位/kg/回を3~6回/日(1日投与量は30万単位を超えない)で点滴静注することが多い.半減期は,30万単位/10 mL静注で40分である.
5. 有用性
急性期KDでは,好中球でプロスタグランジンH2とトロンボキサンA2のmRNAの亢進を抑制する104).さらに好中球により誘導される血管内皮細胞の障害を防御する105).1993年における最初の使用報告例106)の後,症例報告が相次ぎ,(1)軽症例での単独の効果,(2)併用によるIVIGの減量効果,(3)IVIG不応例や再燃例の一部での有効性等が報告されている107).いずれも少数例の検討であり,前方視的な臨床試験は存在しないが,歴史的には不応例に対する代替治療薬として開発された3).
その後,初期治療としてUTIとIVIGとを併用することにより,不応例として追加治療の頻度が減少(調整オッズ比0.30, 95% CI 0.20–0.44)し,またCAA発症率も低い(調整オッズ比0.32, 95% CI 0.17–0.60)ことが報告された25).また,サブグループ解析ではKobayashiスコア7点以上のハイリスク例で,より効果が高い(CAA発症の調整オッズ比0.21, 95%CI 0.08–0.57)ことが示されている.IVIG不応例に対する追加治療では,ケースシリーズ研究として,IVIG再投与にUTIを併用した7例でCAA発症を認めなかったことが報告されている108).
6. 副作用
慎重投与の対象として,(1)薬剤過敏症またはその既往歴のある患者,(2)過敏性素因患者,(3)過去にUTIの投与を受けた患者が添付文書に記載されている.副作用には,重大なものとしてアナフィラキシーショック(頻度不明)があり,そのほかに肝機能異常(0.5%),白血球減少(0.2%),発疹,瘙痒感などの過敏症状(0.1%),下痢(0.1%),血管痛(0.1%),一過性AST・ALT上昇,好酸球増多,注射部位の血管痛がある.またIVIG製剤との同一ルートの混注は白濁を生じるため,複数の静脈路を確保するか,UTI投与時は一時的にIVIG投与を停止してUTI投与前後に生理食塩水等を用いて静脈路をフラッシュするなどの配慮が必要である.
B. その他
UTI以外の蛋白分解酵素阻害剤として,好中球エラスターゼを選択的に,より強力に阻害するシベレスタットナトリウム水和物(SSH)がある.適応症は,全身性炎症反応症候群にともなう急性肺障害であり,KDに対しては適応外使用である.初期治療におけるIVIGとの併用,IVIG不応例への追加治療としての使用等の報告がある109, 110).小児の用法・用量は確立されていないが,1時間当たり0.2 mg/kg持続点滴静注での投与報告が多い.適応,用量,投与期間について,現時点で確立したエビデンスはない.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG+UTIによる初期治療 | IIb | C |
| IVIG不応例に対するIVIG+UTIによる追加治療 | IIb | C |
VI. 血漿交換療法(Table 5)
1. 目的
KDの病態に関与する炎症性サイトカインやケモカインを血液中より直接除去することにより,高サイトカイン血症を是正する.
2. 作用機序
TNF-α, IL-1βなどの炎症性サイトカインは,生物学的製剤の有効性や動物モデルより,KDの炎症病態の主座をなすことが示されている.PEにより,TNF-α, IL-1β, IL-6, IL-17, G-CSFなどが除去され,全身炎症を鎮静化させる111).一方,活性化単球の抑制効果やregulatory T細胞の増加等の作用も報告されている112).
3. 適応
IVIG不応例が適応であるが,PEの実施にあたり,深鎮静ときに人工呼吸器管理や集中治療室での管理を必要とし,侵襲が高い点に留意するべきである.したがって,IFXやステロイドを含むIVIG不応例への標準治療が奏功しない,あるいは使用できない例,重症感染症合併例,KDSSなどに主に考慮される.
4. 用法・用量
置換液は5%アルブミンもしくは新鮮凍結血漿(FFP)を用い,循環血漿量(ml)〔体重(kg)/13×(1-Hct/100)×1,000〕: 〔Hct=ヘマトクリット値(%)〕の約1~1.5倍を1回あたりの置換量とする.外頸静脈,大腿静脈,鎖骨下静脈などに,小児透析用ダブル・ルーメンカテーテルを留置し,2時間程度で実施する.KDSSの際には,初回治療時には長時間かけ,急激な循環動態の変動を防止する.抗凝固療法として,開始時にヘパリンナトリウム(15~30 U/kg)を静注し,その後10~30 U/kg/時で,ACT(activated clotting time)を200秒前後に維持する.体重10 kg未満の児で低血圧が懸念される場合は,濃厚赤血球と5%アルブミンを等比で混合した液で回路を充てんした後に開始する113).FFPにはクエン酸ナトリウムが含有されており,主にFFPで置換すると,低血症(口唇,手指の痺れ間,悪心,嘔吐,痙攣,意識障害)をきたしうる.FFPを用いたPEの施行中には定期的にイオン化を測定し,必要に応じグルコン酸Caで補正する.解熱が得られるまで,最大6日連続で実施する.
5. 有用性
PEの歴史は古く,IVIGの登場以前に遡る114).全国調査によれば1),IFXが積極的に導入されるようになった現在も,年間60~80名のKDが本治療を受けており,他の治療法が無効な場合の最終的手段として試みられることが多い.本治療は重症例に限定された治療であり,有効性の検証を目的とした前方視的臨床試験は存在せず,後方視的コホート研究にとどまる115, 116).本治療を受けた125名のIVIG不応患者のうち,PE開始時にCAAを認めなかった105名のうち,急性期には21名にCAAを認めたが,約1年後の遠隔期ではCAAは0名であった.PE開始時に冠動脈拡張を認めた14名は,急性期は巨大瘤1名を含む瘤3名と拡大を11名に認めたが,遠隔期には巨大瘤と瘤を各1名に認めたのみであった.一方,開始時にすでに瘤を形成していた6名は,遠隔期では2名はCAAが消失したが,4名は巨大瘤が残存した116).PE施行日数の中央値は3日(1~6日)であった.本治療は解熱まで平均3日程度を要し,その間にCAAが出現あるいは進行する可能性があるため,他の治療法と同様にCAAを生じる前に開始することが望ましい.また,治療法が未確立であるIVIG不応KDSSへの有効性も報告されている117).
6. 副作用
体外循環にともなう低血圧・ショック,出血,貧血,低体温.アルブミン置換にともなう凝固障害,新鮮凍結血漿によるアレルギー反応と低Ca血症,感染症などのほか,カテーテル挿入血管の血栓形成や損傷,全身麻酔にともなう合併症が生じる可能性がある.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG不応例に対するPEによる追加治療 | IIa | C |
VII. 抗血小板薬(Table 6)
Table 6 抗血小板薬,抗凝固薬,血栓溶解剤,抗狭心症薬など| 一般名 | 作用機序 | 投与経路・用法用量 | 主な副作用 | 注意事項 |
|---|
| アスピリン | シクロオキシゲナーゼ-阻害 | 30~50 mg/kg/日,分3, 解熱から48~72時間経過し解熱が維持されている場合に3~5 mg/kg分1に減量. | 肝機能障害,出血(頭蓋内出血,消化管出血,鼻出血等),ショック,アナフィラキシー,中毒性表皮壊死融解症・皮膚粘膜眼症候群,喘息の悪化,消化性潰瘍・消化器症状など. | |
| ジピリダモール | 抗血小板疑集抑制作用 | 2~5 mg/kg/日,分3. | 頭痛(0.9~4.4%),心悸亢進(0.4~0.6%),重大な副作用として狭心症状の悪化(0.1%未満),出血傾向(頻度不明)など. | 小児の保険適用はないが保険償還あり. |
| ホスホジエステラーゼ阻害 |
| チクロピジン | 抗血小板疑集抑制作用 | 2~5 mg/kg/日,分3. | 血栓性血小板減少性紫斑病,無顆粒球症,重篤な肝障害(いずれも頻度不明)など. | 投薬の適応は慎重に行う.投与初期には2週間ごとに血液検査が必要.小児は保険適応外. |
| ADP受容体阻害による血小板アデニル酸シクラーゼ活性増強 |
| クロピドグレル | 抗血小板疑集抑制作用 | 0.2~1 mg/kg/日,分1. | 出血(頭蓋内出血1%以下,消化管出血1%以下,他頻度不明),胃十二指腸潰瘍,血栓性血小板機能低下症,間質性肺炎,汎血球減少,中毒性表皮壊死融解症・皮膚粘膜眼症候群,横紋筋融解症など. | チクロピジンに比して肝機能障害や無顆粒球症の副作用が少ない.小児は保険適応外. |
| ADP受容体阻害による血小板アデニル酸シクラーゼ活性増強 |
| 未分画へパリン | 凝固因子(II, VII, IX, X,XI, XII)の生理的阻止因子であるアンチトロンビンIII (ATIII)を活性化し抗凝固作用を示す. | 10~20単位/kg/時を持続静注(初めに50単位/kgを単回静注してもよい). | 出血が最大の副作用(頻度不明),ヘパリン惹起血小板減少症(頻度不明),肝機能障害(0.1~5%未満),発疹(頻度不明),脱毛・白斑(頻度不明)など. | APTT 46~70秒(対照の1.5~2倍)が目安.小児は保険適応外. |
| 低分子へパリン(ダルテヘパリン) | アンチトロンビンIIIを介して主にXa因子を阻害することで抗凝固作用を発揮する. | 汎発性血管内血液凝固症では75単位/kg/日を24時間かけて持続静注.血液透析時では開始時に15~20単位/kgを投与後,7.5~10単位/kg/時を持続点滴静注皮下注. | 未分画ヘパリンよりも出血の副作用は少ない.皮下出血(3.8%),ヘパリン惹起血小板減少症(0.4%),頭痛・めまい(1~10%未満),便秘・下痢(1~10%未満),肝機能異常(1~10%未満)など. | 同上.小児は保険適応外. |
| ワルファリン | ビタミンK依存性凝固因子である第II, VII, IX, X因子の生合成を阻害し抗凝固作用を呈する. | 12か月未満では0.16 mg/kg/日,1歳以上から15歳未満では0.04~0.10 mg/kg/日を1日1回投与. | 出血(頻度不明),過敏性(頻度不明),肝機能障害・黄疸(頻度不明)など. | PTINR 2.0~2.5, トロンボテスト10~25%を目安に調節.ワルファリンは胎盤を通過し催奇形性があるので,妊娠初期の母体への投与は禁忌.小児の保険適用あり. |
| ウロキナーゼ | プラスミンへの変換を促進しフィブリンを分解する. | 全身投与では1~1.6万単位/kg(最大96万単位)を30~60分かけて点滴静注.冠動脈内注入(ICT)では0.4万単位/kgを10分間で注入,最大4回まで. | 出血性脳梗塞(0.1~ 0.5%未満),脳出血(0.1%未満),消化管出血(0.1%未満),肝機能障害(0.1%未満),発疹等の過敏症(0.1%未満)など. | ヘパリン,ワルファリン,アスピリン,ジピリダモール,塩酸チクロピジン,および他のt-PA製剤との併用は相加作用により出血傾向が増大する可能性あり.アプロチニン製剤との併用ではウロキナーゼの線維素溶解作用を減弱させる可能性がある.小児は保険適応外. |
| アルテプラーゼ | 同上. | 29.0~43.5万単位/kg (0.5~0.75 mg/kg).総投与量の10%を1~2分で静注し,残りを60分間で点滴静注. | 脳出血(0.4%),消化管出血(0.6%),肺出血(0.08%)などの出血傾向,心室細動などの重篤な不整脈(0.08%),ショック・アナフィラキシー様症状(0.1%),肝機能異常(0.1%~1.0%未満)など. | 他の血栓溶解薬,血液凝固阻止薬,抗血小板薬などとの併用により出血の危険性が増大する.小児は保険適応外. |
| モンテプラーゼ | アルテプラーゼよりも半減期の延長,フィブリン親和性の増強,プラスミノーゲンアクチベーター活性が増強されている. | 2.75万単位/kgを2~3分間で静注. | 脳出血・消化管出血(0.1~5%未満),肺出血(頻度不明)などの出血傾向,心破裂・心室中隔穿孔(0.1~5%未満),再灌流後の心室期外収縮・心室頻拍・心室細動(0.1~ 5%未満)などの不整脈,ショック・アナフィラキシー様症状(頻度不明),肝機能異常(0.1~5%未満)など. | 同上.小児は保険適応外. |
| プロプラノロール | β受容体(β1, 2非選択性)競合的遮断. | 1日0.5~2.0 mg/kgを低用量から開始し,1日3–4回に分割投与.効果不十分なときは1日4.0 mg/kgまで増量可.1日90 mgを超えないこと. | うっ血性心不全(またはその悪化),徐脈,末梢性虚血(レイノー様症状等),房室ブロック(0.1~5%未満),失神を伴う起立性低血圧(0.1%未満),無顆粒球症,血小板減少症,紫斑病(0.1%未満),気管支痙攣(0.1~5%未満),呼吸困難,喘鳴(0.1%未満)など. | 作用発現が早く短時間作用.レニン分泌抑制作用が強い.心筋虚血をともなう冠動脈狭窄,心筋梗塞後,心不全に小児適用あり(ただし狭心症は適応外). |
| カルベジロール | 同上. | 0.05 mg/kg/回 1日2回から開始し,0.1~0.5 mg/kg/回1日2回までゆっくり増量.成人の最大量(20 mg)を超えない. | めまい(8.9%),心不全の悪化(9.4%),動悸(2.7%),徐脈(2.7%),血圧低下(1.9%),糖尿病悪化(2.3%),全身倦怠感(1.9%)など. | α1受容体遮断作用あり,β遮断作用は軽度.小児の慢性心不全に対して保険償還がある. |
| メトプロロール | β受容体(β1選択性)競合的遮断. | 0.5~1.0 mg/kg/回 1日2回. | (頻度不明)心原性ショック,うっ血性心不全,房室ブロック,徐脈,洞機能不全,肝機能障害など. | 小児は保険適応外. |
A. アスピリン
1. 目的
抗炎症作用を目的として中等量を解熱後数日まで用い,その後は抗血小板作用を期待して低用量に減量し,KD発症後2~3か月間使用する.CAAを残した患者では継続し,遠隔期における抗血栓治療の重要な位置を占めている.
2. 作用機序
ASAは,シクロオキシゲナーゼを阻害し,トロンボキサンA2やプロスタグランジンE2(PGE2)を抑制する.ASAがシクロオキシゲナーゼをアセチル化するため本来の基質であるアラキドン酸が結合できず,トロンボキサンA2の生成が抑制される.ASAはトロンボキサンA2の強力な血小板凝集作用を抑制し,その効果は低用量でも認められる.一方,低用量のASAではPGE2産生は抑制されない.
3. 適応
すべての剤型で川崎病(川崎病による心血管後遺症を含む)に対して保険適用がある.
4. 用法・用量
日本では急性期に中等量(30~50 mg/kg/日,1日3回分割投与)が推奨され,この用法・用量で保険適用がある.抗血小板効果は低用量で十分であるが,抗炎症効果も考慮した用量設定である.米国で推奨されている80~100 mg/kg/日の高用量では,日本人は肝機能障害を起こす頻度が高いため推奨されない.急性期にはASAの吸収が悪く,抗炎症作用としては十分な血中濃度になっていないとの指摘もあるが,ASAを用いないと2~4病週にみられる血小板凝集能の亢進が30~50 mg/kg投与下で抑制される118).
通常は,解熱から48~72時間経過し解熱が維持されている場合に低用量(3~5 mg/kg/日,1日1回投与)に減量する.減量後は抗血小板薬として2~3か月間使用する.
5. 有用性
1970年代にASAが広く使われるようになってからの死亡率の改善119)および,1980年代前半の前方視的研究120)により,ASAの急性期から遠隔期にかけてのCAA改善に対する優位性が確立された.同じCOX-1抑制作用を持つ抗炎症薬のフルルビプロフェンは本研究で成績が劣った.IVIG治療が確立された1980年代後半以降,臨床試験には必ずASAが併用されている40–42).ASA単独では急性期におけるCAA抑制効果は証明されていないものの,IVIGとの併用によってCAAが抑制され遠隔期に改善するという有用性が示されている.
近年,急性期におけるCAA抑制効果はIVIGの比重が高く121),ASAは病初期から低用量でよいとする報告が散見される122–125).最近の2つのメタアナリシスでは,低用量は中等量・高用量に比して発熱期間(平均差0.30, 95%CI 0.02–0.58)126)や追加治療の割合(統合リスク比1.39, 95%CI 1.00–1.93)127)は増加する傾向であるが,CAA合併率は上昇しない(統合リスク比1.15, 95%CI 0.93–1.43)126),(リスク比0.85, 95%CI 0.63–1.14)127).今後の前方視的試験の結果によって,初期治療の用量について再考される可能性がある.
6. 副作用
治療前に肝逸脱酵素上昇があっても,KDの胆道系浮腫によるうっ滞性肝障害によるものであり,ASAを使用しても問題はないと考えられている.回復期あるいは遠隔期に肝逸脱酵素の上昇が認められた場合には,減量・休薬などで適切に対応する.
その他の副作用として出血,消化性潰瘍があり,頻回の鼻出血や黒色便として認められる.頻度は不明だが小児でも経験し,減量や休薬を要することがある.Reye症候群の頻度は減少したが,水痘やインフルエンザ罹患時においてはなお注意が必要である.インフルエンザ,水痘の罹患中および回復期にKDを発症した場合,ASAは用いずIVIG単独,あるいは他の抗炎症薬,抗血小板薬で治療を行う.低用量使用とReye症候群の発症は関連がないとされているが12),服用中の児に対しては予防的にインフルエンザワクチンの接種が望ましい.
B. その他
作用機序が異なる抗血小板薬として,ジピリダモール(ホスホジエステラーゼ阻害血小板内cAMP濃度上昇),チクロピジン,クロピドグレル(ともにADP受容体阻害→血小板アデニル酸シクラーゼ活性増強→血小板内cAMP濃度上昇)があるが,KDでのエビデンスは少なく保険適応外である(ジピリダモールは保険償還を受けることができる).CAAの患者に対して,ASAに加えて抗血小板薬をもう1剤併用するか,あるいは抗凝固療法を併用するかについては,明確な基準やリスクベネフィットを含めたエビデンスレベルの高い報告はない.
それぞれの用量・用法はTable 6を参照されたい.ジピリダモールは古くから使用経験があり,頻度の多い副作用として頭痛がある.チクロピジンは,血栓性血小板減少性紫斑病,無顆粒球症,重篤な肝障害といった副作用が投与後2か月以内にみられることがあり,慎重に使用する.クロピドグレルは成人の冠動脈疾患の血栓予防においてASA併用のエビデンスが蓄積されており,小児の用量設定の報告もある128).作用機序はチクロピジンに類似するが肝障害はより少ない.成人において,ASAとの併用は心筋梗塞予防には効果があるが出血イベントも増加し,心血管死亡の予後改善には至らなかった129).
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| IVIG+ASAによる初期治療 | I | A |
| CAAに対するASA投与 | I | C |
| CAAに対するASA以外の抗血小板薬投与 | IIb | C |
VIII. その他の心血管治療薬(Table 6)
A. 抗凝固薬
急性期KDでは,血小板の増多と活性化,凝固線溶系の活性化が認められる.CAAを合併しない症例には原則として抗凝固薬は不要である.しかし特に巨大瘤(Zスコア10以上,または瘤径8 mm以上)の症例では,抗血小板薬に加え抗凝固薬を併用することが推奨される130–132).梗塞の多くはKD発症2年以内に生じると報告されており133),この期間の抗凝固治療は慎重に行うべきである.KDでの抗凝固薬として最も多く使用されるのはワルファリンであり,ワルファリンの使用が難しいときにはヘパリンが用いられる.新しい抗凝固薬としてビタミンKに依存せずに凝固因子を阻害する直接経口凝固薬(DOAC)が登場し,成人の心房細動に用いられているが,KDに対するエビデンスはなく適応外使用である.
A-1. ワルファリン
1. 目的
CAAにおける血栓形成予防.
2. 作用機序
ビタミンK依存性凝固因子であるII, VII, IX, X因子の合成を阻害することで抗凝固作用を発現する.
3. 適応
巨大瘤,心筋梗塞の既往,瘤内の血栓形成などが適応である.心筋梗塞や肺静脈血栓症などの血栓塞栓症に対しては,小児でも保険適用がある.
4. 用法・用量
12か月未満では0.16 mg/kg/日,1歳以上から15歳未満では0.04~0.10 mg/kg/日を1日1回投与する.ワルファリンの効果は個人差が大きく,特にCYP2C9とVKORC1の遺伝子多型がワルファリンの投与量に大きく影響を及ぼすことが報告されている134).同一個人でも効果に変動を認めるため,定期的にプロトロンビン時間(PT)の国際標準化(INR)を用いて投与量を調節する.日本循環器学会のガイドライン135)ではPTINR 2.0~2.5が目標とされる.
急性期の炎症反応が強いときはワルファリンのコントロールが難しく,またワルファリンの効果が発現・安定するまでには数日の時間を要する.急性期に冠動脈瘤が確認され早急に抗凝固治療が必要な場合は,ヘパリンの持続静注を行った後にワルファリンに置換するほうが安全であるとする報告もある136).
ワルファリンの効果は食事の影響を受けやすく,ビタミンKが豊富な納豆,青汁,クロレラ,ビタミンK強化の人工乳では効果が減弱し,母乳栄養や摂食不良の状態では効果が増強する.薬剤では,作用増強するものとして,ST合剤,アセトアミノフェン,抗菌薬(エリスロマイシンなど),抗真菌薬(フルコナゾールなど),タンパク同化ステロイド,アミオダロン,スタチンなどが含まれる.作用を減弱する薬剤としては,フェノバルビタール,カルバマゼピン,リファンピシンなどがある.ワルファリン適正使用情報137)を参考にされたい.
5. 有用性
急性期におけるワルファリンの有効性に関する大規模臨床試験の報告はまだない.巨大瘤においては,後方視的研究ではあるが,ASAとワルファリンの併用療法が心イベント回避に有効であることが遠隔期では報告されている130–132).小瘤でのワルファリンの使用は勧められないが,中等瘤での使用は瘤の状況により使用が考慮される12, 135).巨大瘤が中等瘤以下に退縮する場合は,ワルファリン使用の中止も考慮される12,135).しかし,ワルファリンによる心筋梗塞予防の限界もあり133, 138),また出血や血栓の問題もあることから139),長期的な適応に関してはリスクとベネフィットを勘案して治療を決定するべきである.
6. 副作用
最大の副作用は出血である.鼻出血,歯肉出血が多く,女性では月経過多を認める.頭蓋内出血,腹腔内出血にも十分注意が必要である.また催奇形性があり,妊娠6~9週の期間にワルファリンを内服すると骨形成,軟骨形成の異常,小脳症などが認められるとされる140).ただし発生頻度は約5%で,さらに1日量が5 mg以下ではリスクが低いと報告されている141).
A-2. ヘパリン
1. 目的
CAAにおける血栓形成予防.CAAを合併し,血栓形成が早期に惹起されることを危惧する場合は,まずヘパリンの持続点滴静注を行う.その後,炎症が鎮静化した後にワルファリン内服に移行する.当初からワルファリンを開始するよりヘパリンを用いたほうが安全であったとする報告もある136).
2. 作用機序
未分画ヘパリンは健康食用獣の小腸粘膜,肝,肺より抽出されたものである.トロンビン(IIa)とアンチトロンビンIII(ATIII)に結合してATIIIを活性化し,IIaをはじめIXa~XIIa因子およびカリクレインを阻害することで血液凝固を抑制する.低分子ヘパリンは未分画ヘパリンと同様にATIIIに結合するが,IIaとは結合できず,ATIIIを介して第Xa因子を阻害することで抗凝固作用を発揮する.
3. 適応
巨大瘤,心筋梗塞発症時,瘤内の血栓形成などが適応である.添付文書では,小児における安全性,有効性は確立していないと記載されている.
4. 用法・用量
未分画ヘパリン:10~20単位/kg/時を持続静注(初めに50単位/kgを単回静注してもよい)142).活性化部分トロンボプラスチン時間(APTT)または活性化凝固時間(ACT)を対照値の1.5~2.5倍とすることが推奨される.
低分子ヘパリン:小児の投与量は確立していない(ダルテヘパリンの成人の投与量は,汎発性血管内血液凝固症に対しては75単位/kg/日を24時間かけて持続静注,血液透析時は透析開始時に15~20単位/kgを投与後,7.5~10単位/kg/時を持続点滴静注).
5. 有用性
中等瘤以上のCAAを形成した症例に当初からワルファリンを使用した症例とヘパリンから開始し,ワルファリンに移行した症例を比較したところ,重篤な出血がワルファリン症例に多かったとする報告がある136).
6. 副作用
ヘパリン起因性血小板減少症(HIT)に注意する.出血,肝機能障害,脱毛,発疹,下痢.未分画ヘパリンより低分子ヘパリンのほうがHITや出血は少ないとされる.
A-3. 直接経口抗凝固薬(DOAC)
1. 目的
心房細動,静脈血栓症における血栓形成予防
2. 作用機序
ビタミンKに依存せず,直接トロンビンやXa因子を阻害することで抗凝固作用を発現する.トロンビン阻害薬であるダビガトランとXa因子阻害薬であるリバーロキサバン,アピキサバン,エドキサバンの2種類に分類される.
3. 適応
成人での適応は,非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制,深部静脈血栓症及び肺塞栓症の治療・再発抑制となっている.現状ではKDには保険適用はない.将来的にはワルファリンやヘパリンの代替となる可能性がある.
4. 用法・用量
成人量はタビガトラン150 mgを1日2回,リバーロキサバン15 mgを1日1回,アビキサバン5 mgを1日2回,エドキサバン60 mg(体重60 kg未満は30 mg)を1日1回.小児の用法・用量は確立していない.
5. 有用性
非弁膜症性心房細動,静脈塞栓症において有効性,安全性ともにおおむねDOACがワルファリンより優れているとされる143, 144).人工弁置換術後の症例に関しては,血栓症,出血ともにDOACがワルファリンに劣ると報告されている145).ワルファリンと異なり,食事による影響を受けにくくモニタリングも不要であるという利点はあるが,薬効のモニタリングが難しいこと,ワルファリンに比べて半減期は短く,飲み忘れにより効果が減弱することと,緊急時の中和薬がないことは弱点である146).
6. 副作用
出血(消化管出血,頭蓋内出血),間質性肺炎,アナフィラキシー,急性肝不全など.
B. 血栓溶解薬
1. 目的
CAAに生じた血栓の溶解.KD発症後の心筋梗塞は2年以内に生じることが多く133),その要因の多くは瘤内血栓による急性冠動脈閉塞である.心機能障害の範囲を縮小し,心機能低下を軽減する目的で,心筋梗塞発症12時間以内に速やかに再灌流療法を行う147).成人では経皮的冠動脈インターベンション(PCI)による血栓吸引療法が行われるが,小児では体格的な問題や出血性合併症が少ない148)ことから血栓溶解療法が適応されることが多く,日本循環器学会のガイドラインでも推奨されている135).成人においても,発症12時間以内かつ最初の接触から2時間以内にprimary PCIが施行できない場合には,血栓溶解療法が推奨されている147).また,CAA内に無症候性血栓が同定され,心筋梗塞の発症が危惧される場合も血栓溶解療法が適応される.
2. 作用機序
血栓溶解薬は線溶系の活性化酵素であるプラスミノーゲン活性化因子(PA)に属するタンパク製剤である.線溶系の活性化は,プラスミノーゲンをプラスミンにすることで開始され,プラスミンは血栓の構成成分であるフィブリンを分解することで血栓を溶解する.血栓溶解薬には第一世代であるウロキナーゼ,遺伝子組み換えで合成された組織型プラスミノーゲン活性化因子(tPA)があり,tPAには第二世代アルテプラーゼ,第三世代改変型tPAのモンテプラーゼがある.ウロキナーゼはフィブリン親和性が低く線溶系活性を更新するのに対し,アルテプラーゼは天然型のtPAでフィブリン親和性が高くフィブリン分子に結合することによりフィブリン血栓上でプラスミンを活性化させ,フィブリン分子を分解し血栓を溶解させる.モンテプラーゼはtPAのアミノ酸配列を置換し血中半減期を長くしているので,総投与量の減量と急速単回投与が可能となっている.
3. 適応
急性心筋梗塞およびCAA内血栓.小児は保険適応外である.
4. 用法・用量
血栓溶解の効果は,静脈内投与と冠動脈内投与とはほぼ同程度とされる.冠動脈内投与の適応が認められているのはウロキナーゼのみである.
- (1) ウロキナーゼ
- 静脈内投与:1.0~1.6万 単位/kg(最大96万 単位)を30~60分かけて点滴静注
- 冠動脈内投与:0.4万 単位/kgを10分間で注入.最大4回まで.
- (2) アルテプラーゼ
- 静脈内投与:29.0~43.5万 単位/kg(0.5~0.75 mg/kg)
- 総量の10%を1~2分で静注,残りを1時間で点滴静注
- (3) モンテプラーゼ
- 静脈内投与:2.75万 単位/kgを2~3分で静注
5. 有用性
KD既往成人で急性冠症候群をきたした50例のcase report reviewでは,冠動脈内血栓溶解療法が11例に行われ,9例の有効性が報告されている149).また,Harada et al.の全国調査148)では,血栓溶解療法を行った20例中14例に効果を認めたとされ,静脈内投与は瘤径が10 mm以下の症例に有効で,冠動脈内投与は10 mmを超える瘤でも有効であったとしている.
6. 副作用
脳出血,出血性梗塞,消化管出血,肺出血,アナフィラキシー,ショックなど.
C. 抗狭心症薬と冠拡張薬
急性期に狭心症状をきたすことはまれである.しかし,発症早期に血栓性の心筋梗塞をきたす症例や発症1か月以内に起こる冠動脈破裂をきたすことが報告されている133).狭心症治療に対しては,心負荷を軽減する治療(心拍数の低下,前・後負荷の軽減,冠血流の増加)を図ることが大切であり,そのためにはβ遮断薬,Ca拮抗薬,硝酸薬が有効となる.また,急性期において冠動脈破裂が切迫していると考えられる場合は,KDの治療に加えて十分な鎮静と降圧が必要となり,β遮断薬,Ca拮抗薬が考慮される.
C-1. β遮断薬
労作性狭心症の第一選択薬である.β受容体を競合的に阻害し,β受容体の作用である心筋収縮増強作用,平滑筋弛緩作用などを抑制する.冠攣縮がある場合はα受容体作用が優位となり,冠トーヌスが亢進し冠攣縮性狭心症が増悪する可能性があるので注意を要する.また,肝臓ではβ2受容体を介してグリコーゲンの分解が行われており,β遮断薬はこの過程を阻害するため,特に新生児・乳児では低血糖の発現に注意する.
心筋虚血をともなう冠動脈狭窄,心筋梗塞後,心不全,不整脈などに小児の保険適応のある薬剤はインデラルのみ(ただし狭心症は適応外)である.カルベジロールは添付文書上の小児適応外である(が保険償還を受けることはできる).
心不全をきたす可能性があるため少量から投与を開始し,忍容性および治療上の有用性をもとに個々の患者に応じて維持量を設定する.
- (1)プロプラノロール
- 1日0.5–2.0 mg/kgを低用量から開始し,1日3–4回に分割投与
- 効果不十分な時は1日4.0 mg/kgまで増量可.1日90 mgを超えないこと.
- (2)カルベジロール
- 1回0.05 mg/kg 1日2回から開始し,1回0.1–0.4 mg/kg 1日2回まで漸増する(成人の最大量20 mg/日を超えないこと).経口投与.
- (3)メトプロロール
- 1–2 mg/kg/日1日2~3回に分割,経口投与
C-2. カルシウム拮抗薬
Ca拮抗薬は血管平滑筋細胞のCa2+流入を抑制し,冠攣縮予防に有効であり,冠攣縮性狭心症の第一選択薬である147).KDの心筋梗塞は安静時や睡眠時にも発症しており,冠攣縮を合併していると考えられる場合もある150).また,急性期において冠動脈破裂が切迫していると考えられる場合は,KDの治療に加えて十分な鎮静と降圧が必要となり,β遮断薬,Ca拮抗薬が考慮される.代表的薬剤としてアムロジピン(6歳以上の高血圧に対し0.06~0.3 mg/kg/日,1日1回経口投与),ニフェジピン(1~2 mg/kg/日,1日3回に分割経口投与,徐放薬は1日1~2回経口投与),ジルチアゼム(1.5 mg/kg/日,1日3回に分割経口投与)があるが,アムロジピンのみ6歳以上の小児の高血圧に対して保険適応がある.ニフェジピン,ジルチアゼムの小児の保険適応はない.未熟心筋での心筋収縮は心筋細胞外のCaに依存する割合が高く,特にジルチアゼムは心筋細胞L型Ca2+チャネルのブロック作用も有することから,乳児期早期までの患者には使用禁忌である.
C-3. 硝酸薬
冠動脈拡張と前負荷減少による冠動脈血流増加,および前・後負荷減少による左室仕事量減少により心筋虚血を改善させる.狭心症,心筋梗塞発症時には硝酸薬の舌下,経口での投与を試みる151).長期使用により耐性が生じるため漫然とした使用は控える.
ニトログリセリン舌下錠(成人では1~2錠(0.3~0.6 mg),小児では体格に合わせ1/2~1/3錠)と持続静注(0.1~20 µg/kg/分)は小児の保険適用がある.
クラス分類とエビデンスレベル| 治療法 | クラス分類 | エビデンスレベル |
|---|
| 巨大CAAに対するASAとワルファリンの併用 | I | C |
| 巨大CAAに対するヘパリン持続静注療法 | IIa | C |
| 冠動脈塞栓症に対するASAとヘパリン持続静注療法 | I | C |
| 小児の血栓性心筋梗塞に対する血栓溶解療法 | I | C |