Table 1 Patients’ characteristics| Case No. (gender) | Op. age | BW (kg) | MR grade | Diameter of MV ring (mm) (% of normal) | Associated cardiac lesions |
|---|
| 1 (F) | 1y 4m | 8.8 | moderate | 20.0 (114%) | none |
| 2 (F) | 5m | 6.3 | moderate | 17.3 (117%) | VSD (Pp/Ps=0.9, Qp/Qs=1.94) |
| BW: Body weight, MR: Mitral valve regurgitation, MV: Mitral valve, Op: Operation, Pp/Ps: Pulmonary to systemic systolic blood pressure ratio, Qp/Qs: Pulmonary to systemic blood flow ratio, VSD: ventricular septal defect. |
症例1(Table 1)
症例
1歳4か月,女児.体重8.8 kg.
現病歴
40週,3,396 gで出生.1歳時に初めて心雑音を指摘された.胸部X線写真で心胸郭比(CTR): 60.8%と心拡大を認めた.
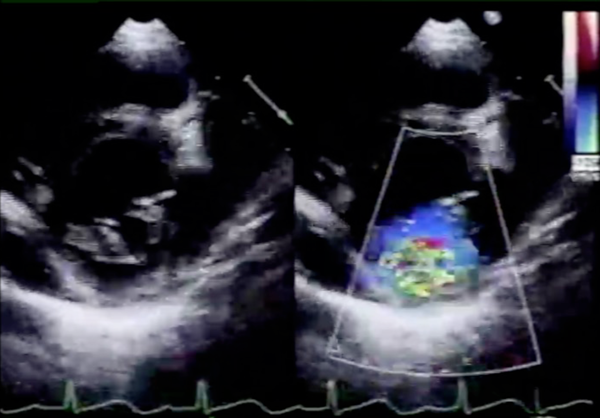
心臓超音波検査(Fig. 1)
後尖,特にP2を中心とした低形成によるmoderate MRを認めた.僧帽弁輪径は20.0 mm(114% of normal)であった.
心臓カテーテル検査
MR: 3度,LVEDVI: 132.9 mL/m2(246.7% of normal)であった.
手術(Fig. 2, 3)
胸骨正中切開後に自己心膜を採取し,0.625% GA溶液に5分間浸透させた後,生理食塩水で3回洗浄した.上行大動脈送血,上下大静脈脱血で人工心肺を確立し,心停止後,右側左心房切開で僧帽弁に到達した.超音波診断と同じP2を中心とした後尖の低形成であった(Fig. 3-A).後尖を弁輪に沿って両交連近くまで切開し(Fig. 2-A),弁下に付着していた二次腱索を切除した(Fig. 2-B, Fig. 3-B).自己心膜の縫着は7-0ポリプロピレン糸を用いた連続縫合で,まず弁輪側を縫着した後,前尖との距離と接合の深さに合わせて自己心膜をトリミングして弁尖側に縫着した(Fig. 2-C, D, Fig. 3-C).生理食塩水による逆流テストで逆流が制御できたことを確認し,左心房を閉鎖した.人工心肺離脱前に経食道心臓超音波検査(TEE)で逆流がmild以下に制御できたことを確認した.人工心肺からの離脱は容易であった.人工心肺時間及び心停止時間は,それぞれ125分,92分であった.
術後経過
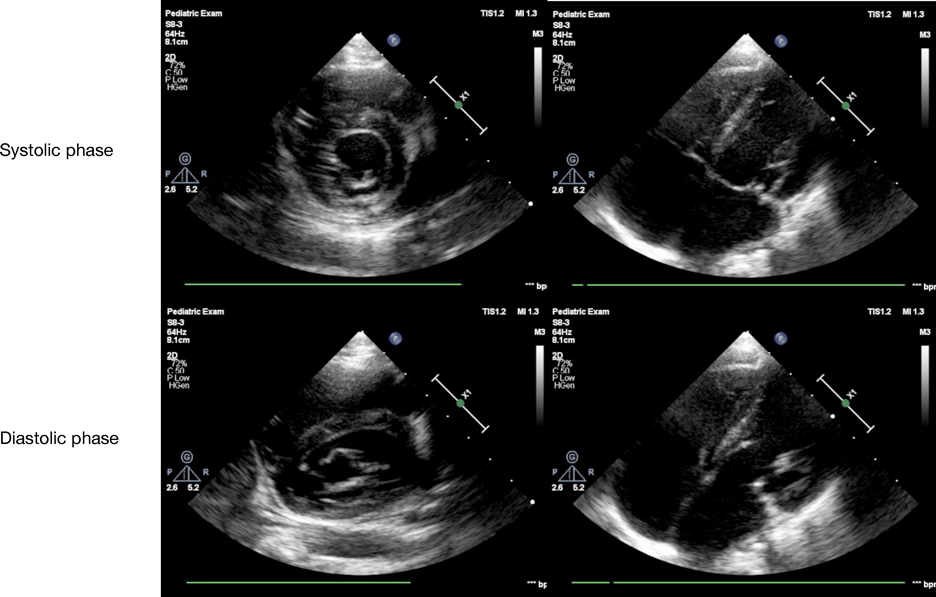
術後18日の心臓超音波検査では,MRはmildであった.術後9年6か月時,MRはtrivialで,また,僧帽弁位の最大流速(Vmax)は0.9 m/sであった.自己心膜を含めた後尖の可動性は低下しているものの,自己心膜の肥厚は軽度で,石灰化は認めていない(Fig. 4).
症例2(Table 1)
症例
5か月,女児.心室中隔欠損(Ventricular septal defect: VSD)を合併.体重6.3 kg.
現病歴
41週,3,146 gで出生.3か月時に初めて心雑音を指摘された.胸部X線写真でCTR: 63.0%と心拡大を認めた.
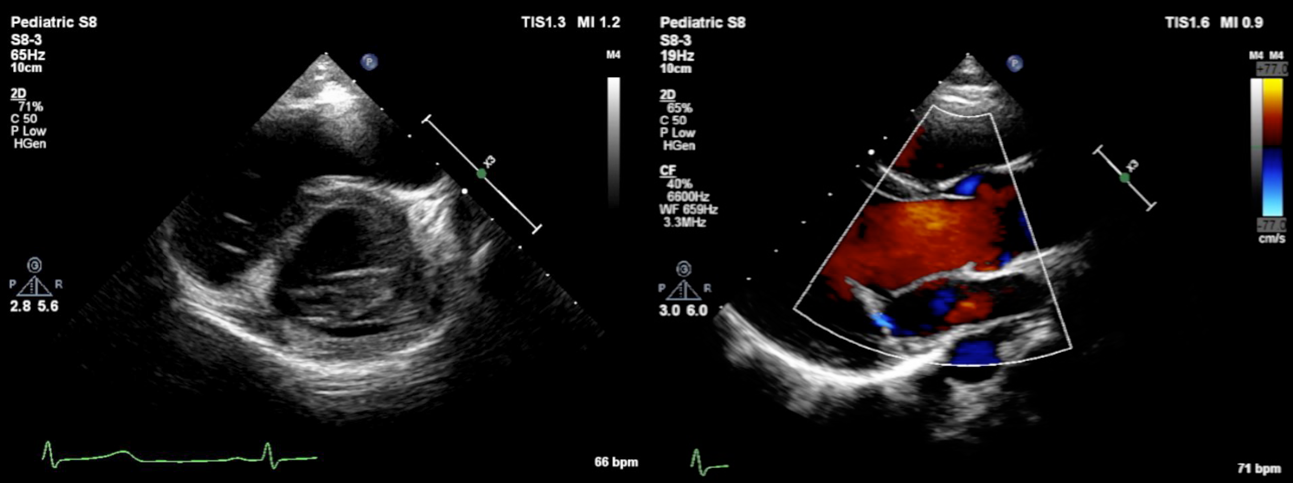
心臓超音波検査
肺動脈弁下部型VSDとP2を中心とした後尖低形成によるmoderate MRを認めた.僧帽弁輪径は17.3 mm(117% of normal)であった(Fig. 5).
心臓カテーテル検査
Pp/Ps: 0.90, Qp/Qs: 1.94, MR: 3度,LVEDVI: 126.7 mL/m2(256.0% of normal)であった.僧帽弁輪の拡大は軽度であり,後尖低形成が主病変であるため,VSD閉鎖のみではMRは改善しないと判断し,同時に後尖延長による僧帽弁形成を施行する方針とした.
手術
右側左心房切開で僧帽弁に到達した.P2を中心とした後尖低形成であった.症例1と同様にGA処理自己心膜を用いて後尖延長術を行った.左心房を閉鎖した後,主肺動脈を横切開して,VSDパッチ閉鎖を施行した.人工心肺離脱前にTEEで僧帽弁逆流がtrivialに制御できたことを確認した.人工心肺からの離脱は容易であった.人工心肺時間及び心停止時間は,それぞれ169分,110分であった.
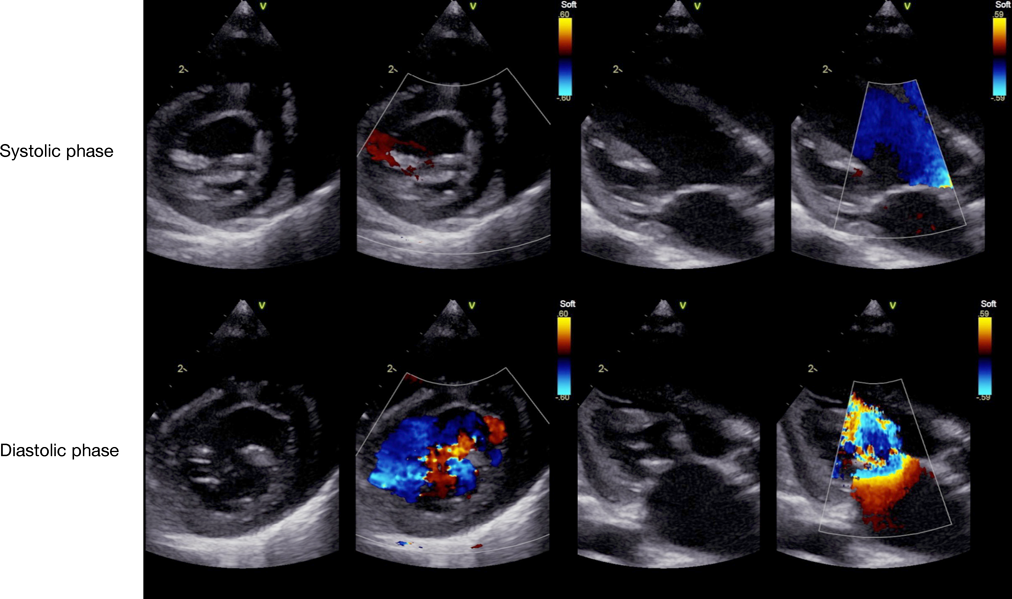
術後経過
術後11日の心臓超音波検査では,MRは消失し,Vmax 1.5 m/sであった(Fig. 6).術後3年2か月時,MRの再発はなく,自己心膜を含めた後尖の可動性は低下しているものの,自己心膜の肥厚は軽度で,石灰化は認めていない.Vmax 1.6 m/sと進行は認めていない(Fig. 7).
先天性僧帽弁閉鎖不全(Congenital MR)は,大きく3つの形態に分類される7).すなわち正常な弁の動きがあるもののcleftや弁輪拡大が原因となるもの(Carpentier分類Type I),正常腱索または乳頭筋の離断・延長で起こる弁の逸脱によるもの(Type II),乳頭筋または腱索の先天的異常により弁の動きが制限されるもの(Type III)に分けられる.今回の2例は,P2を中心とした後尖全体の低形成で,type Iのpartial leaflet defectあるいはtype IIIのshort chordaeに相当すると考えられる.
諸家がそれぞれの弁形態に応じた弁形成術を報告している1, 3, 7, 8).これまで,小児期の僧帽弁閉鎖不全では,弁輪拡大が主体の病変やどちらかの交連(P1またはP3)に限局した病変に対してはcommissural annuloplastyが比較的簡単で,かつ有用でその遠隔期成績も良好であると報告されている9–12).我々は,2005年1月から2018年6月まで2歳未満の小児僧帽弁閉鎖不全(房室中隔欠損や単心室を除く)に対する手術23例中,後尖の低形成を5例経験した(Table 2, 3).そのなかでP1またはP3の低形成3例ではcommissural annuloplastyであるKay法13)を行った.術後早期遠隔期ともに逆流はmild以下で,Vmaxの上昇を認めていない.しかし,自験2例のようなP2中心の後尖低形成で弁輪拡大のほとんどない症例では,commissural annuloplastyでは両交連の縫縮か,後尖弁輪全域の縫縮が必要となり,弁形成後に弁輪の狭小化が問題となる.
Table 2 Etiology of mitral valve regurgitation less than 2 years old (n=23) (2005. 1–2018. 6)| Etiology | n |
|---|
| Chordal/papillary muscle rupture | 7 |
| Prolapse | 6 |
| Cleft | 2 |
| Posterior leaflet hypoplasia | 5 |
| P1/P3 | 3 |
| P2 | 2 |
| Hammock valve | 1 |
| Infective endocarditis | 2 |
| Operative cases for pediatric mitral valve regurgitation in our hospital. Excluding atrioventricular septal defect and single ventricle physiology. |
Table 3 Operations for pediatric mitral valve regurgitation (n=27) (2005. 1–2018. 6)| Operative techniques | n |
|---|
| Valve repair | 7 |
| Commissural annuloplasty (Kay) | 17 |
| Artificial chordae | 6 |
| Commissural edge to edge | 6 |
| Posterior leaflet extension | 3 |
| Cleft suture | 2 |
| Leaflet resection | 2 |
| Papillary muscle splitting | 1 |
| Valve replacement | 3 |
| Operations for pediatric mitral valve regurgitation in our hospital. There are 23 patients (seeTable 2), 27 operations. Several techniques were applied in same patient. Excluding common atrioventricular valve and single ventricle physiology. 3 cases of valve replacement were re-operations after valve repair. |
Ohyeは,弁輪拡大の伴わない症例では,自己心膜を用いた後尖延長による弁面積の拡大と,長く深いcoaptation zoneを作成することが重要と述べている.さらに,弁腹を延長するだけでは弁尖の可動性は改善せず,同時に乳頭筋や腱索に侵襲を加えて,弁尖自由端の可動範囲を改善する必要があるとも述べている5).自験2例では,左室の拡大に比して僧帽弁輪径の拡大はごく軽度であった.2例とも心不全症状は認めず,弁輪拡大をきたすより早期に手術介入することができたためと考えられた.以上のことから,後尖延長を行い,同時に心筋に直接に付着する二次腱索を切除することで,弁面積の拡大と後尖全体の可動性の改善が得られた.
症例1, 2はいずれも良好に経過しており,それぞれ術後9および3年の心臓超音波検査では,僧帽弁逆流はそれぞれtrivial, noneにとどまっていた.また,僧帽弁位の最大流速もそれぞれ0.9, 1.6 m/sと上昇は認めていなかった.しかし,両症例とも,前尖の動きは良好で,自己心膜で延長した後尖の高度な肥厚や石灰化は認めていないものの,可動性は大きく低下している.Kalfaらは,後尖は本来であれば3つのscallopに分かれているために,後尖全体を一枚の心膜で延長すると,開放時(拡張期)に樋(gutter)のようになり(gutter effect),解放制限をきたすと述べている.その予防として,後尖の一つのscallop,特に前方(P1)は残すほうがよいと指摘している1).しかし,P2が中心の後尖低形成例では,後尖全体の延長を行わざるをえない.本術式は,弁輪拡大のない,P2を中心とした後尖の低形成によりMRを来した症例で,前尖の大きさと動きが正常または正常に近いものが後尖延長術の良い適応であると思われる.
自己心膜(autologous pericardium)を使用した弁形成や置換術はすでに1960年代に報告されている14).その後の実験,臨床研究では,新鮮自己心膜は肥厚や退縮を起こしやすいと報告された15).1991年にChauvaudらは,新鮮自己心膜に比較して,GA処理を行った自己心膜は扱いやすく,抗石灰化に優れていると述べ,リウマチ性,感染性,先天性などの僧帽弁疾患に対してGA処理(15分)した自己心膜を用いた弁尖延長による形成術(いわゆるCarpentier’s technique)を病変に応じて系統だって報告した4).GA処理を行った異種心膜は石灰化が進むが,自己心膜では石灰化のリスクは軽減すると報告されている16).小児例において心膜の処理時間は3分から15分まで様々で,一定の見解はない1, 4, 6, 8, 17).また,再手術例では心膜は繊維性肥厚を伴っているため,KalfaらはGA処理を行わずに使用していると述べている1).我々は小児の大動脈弁閉鎖不全に対して積極的にGA処理自己心膜で弁尖延長または作成術を行っている17).処理時間は初回手術例で5分,再手術例で3分とし,特に再手術例ではできるだけ余分な組織を切除するように努めているが,初回例のようにはならない.初回例,再手術例の5~7年の経過では自己心膜弁尖の可動性は良好であったが,再々手術例では,初回例に比較して早期に可動性が低下した.至適な処理時間については今後検討する必要がある.
成人例の報告では,Dillonらは後尖延長を行った症例の7年後の再手術所見では繊維性肥厚,退縮や石灰化を認めなかったと報告している18).一方,Fukunagaらは,成人例における僧帽弁形成(補填や延長術)に使用したGA処理(15分)自己心膜の再手術例14例中5例にmicroscopicな石灰化を認めたと報告している19).今回報告した2例は3~9年の経過では,心エコー上石灰化は認めていないが,今後も慎重にさらなる長期の経過観察を行う必要があると思われる.
引用文献References
1) Kalfa D, Vergnat M, Ly M, et al: A standardized repair-oriented strategy for mitral insufficiency in infants and children: Midterm functional outcomes and predictors of adverse events. J Thorac Cardiovasc Surg 2014; 148: 1459–1466
2) Vida VL, Zanotto L, Carrozzini M, et al: Repair techniques for mitral valve insufficiency in children. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2018; 21: 41–45
3) Walter EMD, Komoda T, Siniawski H, et al: Surgical reconstruction techniques for mitral valve insufficiency from lesions with restricted leaflet motion in infants and children. J Thorac Cardiovasc Surg 2012; 143 Suppl: S48–S53
4) Chauvaud S, Jebara V, Chachques JC, et al: Valve extension with glutaraldehyde-preserved autologous pericardium. J Thorac Cardiovasc Surg 1991; 102: 171–178
5) Ohye RG: Mitral regurgitation in congenital heart defects: Surgical techniques for reconstruction. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2012; 15: 75–79
6) Takahashi H, Kadowaki T, Maruo A, et al: Mid-term results of mitral valve repair with autologous pericardium in pediatric patients. J Heart Valve Dis 2014; 23: 302–309
7) Chauvaud S, Fuzellier JF, Houel R, et al: Reconstructive surgery in congenital mitral valve insufficiency (Carpentier’s techniques): Long-term results. J Thorac Cardiovasc Surg 1998; 115: 84–93
8) Oppido G, Davies B, McMullan DM, et al: Surgical treatment of congenital mitral valve disease: Midterm results of a repair-oriented policy. J Thorac Cardiovasc Surg 2008; 135: 1313–1321
9) Stellin G, Padalino M, Vida VL, et al: Surgical repair of congenital mitral valve malformations in infancy and childhood: A single-center 36-year experience. J Thorac Cardiovasc Surg 2010; 140: 1238–1244
10) Ando M, Takahashi Y: Durability of mitral valve repair performed before the age of 5 years. Circ J 2016; 80: 124–129
11) 佐野俊二,横田祥夫,節家直巳,ほか:先天性僧帽弁閉鎖不全症の外科治療と遠隔成績.胸部外科1985; 38: 969–975
12) Okita Y, Miki S, Kusuhara K, et al: Early and late results of reconstructive operation for congenital mitral regurgitation in pediatric age group. J Thorac Cardiovasc Surg 1988; 96: 294–298
13) Kay JH, Egerton WS, Zubiate P: The surgical treatment of mitral insufficiency and combined mitral stenosis and insufficiency with use of the heart-lung machine. Surgery 1961; 50: 67–74
14) Frater RW, Berghuis J, Brown AL Jr., et al: The experimental and clinical use of autogenous pericardium for the replacement and extension of mitral and tricuspid valve cusps and chordae. J Cardiovasc Surg (Torino) 1965; 6: 214–228
15) Miura T, Eishi K, Sakamoto I, et al: Time-dependent change in fresh autologous pericardium applied for posterior mitral annuloplasty: Degree of calcification and its influence on the repaired mitral valve. Gen Thorac Cardiovasc Surg 2012; 60: 334–340
16) Vincentelli A, Zegdi R, Prat A, et al: Mechanical modifications to human pericardium after a brief immersion in 0.625% glutaraldehyde. J Heart Valve Dis 1998; 7: 24–29
17) 今井健太,藤原慶一,吉澤康祐,ほか:小児大動脈弁疾患に対するグルタールアルデヒド処理自己心膜を用いた大動脈弁形成術.日小児循環器会誌2015; 31: 329–337
18) Dillon J, Yakub MA, Nordin MN, et al: Leaflet extension in rheumatic mitral valve reconstruction. Eur J Cardiothorac Surg 2013; 44: 682–689
19) Fukunaga N, Sakata R, Koyama T: Reoperative analysis after mitral valve repair with glutaraldehyde-treated autologous pericardium. Interact Cardiovasc Thorac Surg 2017; 25: 912–917